缩短腹腔镜胰十二指肠切除术学习曲线的初步经验体会
吴昊钧,陈利平,马文杰,李 唐,廖尔文
(1.四川大学华西医院胆道外科,四川 成都,610041;2.四川大学华西医院上锦分院普外一科)
腹腔镜胰十二指肠切除术(laparoscopic pancreaticoduodenectomy,LPD)首次报道于1994年,其一直被认为是最具挑战性的手术之一,因为LPD需要在腹腔镜下切除众多器官,并完成大量消化道重建,导致在LPD学习初期,会存在较高的并发症发生率。随着手术器械、技术及术后护理的进步,不断有经验丰富的肝胆胰外科医疗中心将并发症发生率、术后死亡率控制在可接受的水平,全世界掌握LPD的肝胆胰外科医生数量开始迅速增加[1]。在过去的17年时间里,大量临床研究证实了LPD的安全性、可行性及与开腹胰十二指肠切除术相似的预后。相较开腹胰十二指肠切除术,LPD具有出血少、术后进食早、术后疼痛轻、术后住院时间短、康复快等优势[2-4]。但前提是由经验丰富的肝胆胰外科医生施术[5-6]。LPD专家共识于2016年制定,国内LPD的推广进入了快速发展期。就像开腹胰十二指肠切除术一样,LPD也存在学习曲线,一旦到达、超越某个临界点,LPD即可变成具有可行性、安全性的常规手术。文献报道,LPD的学习曲线为30~50例[7-9]。自2019年6月我中心开展首例LPD,至2021年7月已完成28例,现将我中心LPD的经验体会报道如下。
1 资料与方法
1.1 临床资料 回顾性收集2019年6月至2021年7月行LPD患者的临床资料。纳入标准:(1)患者一般情况良好,可耐受气腹;(2)胆总管下段占位、胰腺占位及壶腹部占位,拟行LPD。排除标准:(1)术中改变手术方式,改行姑息性胃肠吻合、胆肠吻合等;(2)中转开腹。患者均完全了解手术过程、风险、LPD的优势及中转开腹的可能性,均书面知情同意。本研究经四川大学华西医院伦理委员会同意。
1.2 手术方法
1.2.1 术前准备 患者术前均行上腹增强CT,层厚0.625~1 mm,并以此进行3D重建(图1)。直观呈现病灶与血管、重要解剖结构的关系,用于手术规划与术中引导。手术均由经验丰富的固定肝胆胰外科团队完成,参与人员均具有普外腹腔镜手术基础,常规左右固定站位双主刀模式进行术中操作。

图1 3D重建示例
1.2.2 手术步骤 我中心开展LPD时已有学习与借鉴[10-11],自首例开始,手术已趋向流程化、模块化。(1)探查:包括全腹腔探查、Kocher切口探查、建立胰后隧道等。借鉴华西医院彭兵等的报道[11],重视彻底下降结肠肝曲及横结肠系膜,通常降至显露整个十二指肠水平部,以充分显露胰头、十二指肠区域。十二指肠水平部后自下而上做Kocher切口,充分显露下腔静脉、腹主动脉、左肾静脉及近端空肠。然后解剖胰腺下缘,显露肠系膜上静脉并建立胰颈后方隧道。解剖胰腺上缘,显露肝总动脉、肝固有动脉、胃十二指肠动脉及门静脉,完成探查。后期部分LPD将解剖胰腺上缘显露动脉放在离断胰颈后。(2)切除:离断胆管一般选在右肝动脉横跨的位置以远,位于胆管前方的肝动脉需在离断胆管后游离并移位至胆管后方,以防止吻合口狭窄等相关并发症发生。离断胃的方式分为是否保留幽门。距幽门环以远2~4 cm离断十二指肠或切除约1/3远端胃。用超声刀离断胰腺组织,接近主胰管时改为剪刀剪开,以便于吻合。离断钩突部位组织时,将门静脉/肠系膜上静脉向患者左侧牵拉,暴露门静脉左后方的肠系膜上动脉轮廓,沿动脉血管鞘走行离断,整块切除其右侧180°的组织。No.14a/b、No.8、No.9、No.12组淋巴结在进行各管道骨骼化时即行整块淋巴结清扫。我中心进行了1例门静脉侧壁切除修补、2例门静脉切除重建,先悬吊汇入门静脉的分支,按照动脉优先入路离断标本后再进行血管修补与重建(图2)。(3)消化道重建:胰肠吻合采用缝合4层的导管对黏膜的胰肠吻合。第一层为4-0 Prolene缝线行胰腺后壁与空肠浆肌层连续缝合;空肠开孔,第二层用5-0 PDS Ⅱ缝线全层“8”字缝合主胰管后壁与空肠开口后壁,置入支撑引流管作内引流,然后用该PDS尾线环绕支撑管并固定;第三层用5-0 PDS Ⅱ缝线连续缝合主胰管与空肠开口上壁、前壁、下壁;第四层用4-0 Prolene缝线连续缝合胰腺前壁与空肠前壁浆肌层,完全关闭胰腺与空肠之间的间隙。胆肠吻合用4-0倒刺线1根单层连续缝合。对于保留幽门的LPD,手工行十二指肠空肠端侧吻合,用2根可吸收线或倒刺线双层前后壁分别连续缝合。对于不保留幽门的LPD,则使用切割闭合器行胃肠吻合,开口采用1根倒刺线双层连续缝合关闭(图3)。

图2 蓝染为门静脉,肿瘤侵犯门静脉时,向右侧牵拉门静脉
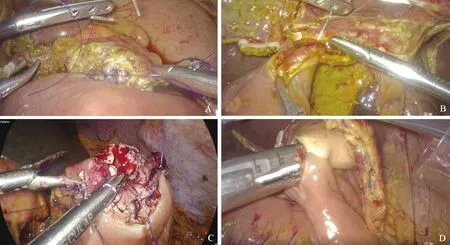
图3 A:胰肠吻合;B:胆肠吻合;C:十二指肠空肠吻合;D:胃空肠吻合
1.3 观察指标 统计中转开腹率,收集成功实施LPD患者的临床资料,包括手术时间、术后住院时间、并发症发生率、再手术发生率、死亡率;并发症包括术后腹腔出血、胆漏、胰瘘、胃瘫、肝功能不全等。术后出血定义为引流管可见血性液或便血所致的术后输血或二次手术;胆漏定义为术后5 d以上引流管内仍有胆汁样液体,且其中胆红素浓度为血清胆红素指标3倍以上[12];胰瘘定义按照国际胰瘘研究组发布的2016版定义及分级标准[13]。

2 结 果
2.1 术前情况 2019年6月至2021年7月拟行LPD 33例,28例成功完成手术,其中男12例,女16例;平均(57.7±2.8)岁,BMI平均(23.7±0.5)kg/m2,6例(21.4%)有腹部手术史;9例(32.1%)术前减黄,其中1例(3.6%)行内镜逆行胰胆管造影,8例(28.6%)行经皮经肝胆道引流术;经术前减黄后,9例患者均在总胆红素降至200 μmol/L以下施术,术前经内镜逆行胰胆管造影放置鼻胆管或临时胆道支架可能增加肝十二指肠韧带区域的炎性反应,因此仅1例为外院放置鼻胆管支架,余者均行经皮经肝胆道引流术减黄,为减轻胆道压力、减少术后胆漏,术后应保留经皮经肝胆道引流管约1个月。
2.2 术中情况 5例中转开腹,中转率15.2%,28例成功完成LPD,包括3例血管切除重建,其中2例联合门静脉/肠系膜上静脉节段切除重建,1例行联合门静脉楔形切除局部缝合重建。中转开腹患者中1例发生在前11例内,4例发生在15例后;中转开腹均发生于探查阶段,1例由于瘤体过大,4例由于术区粘连严重、门静脉受侵犯等导致镜下解剖困难;其中3例行门静脉重建。2例(7.1%)患者术中输血,2例(7.1%)术后进入ICU,10例(35.7%)行胃肠吻合,18例(64.3%)行保留幽门的十二指肠-空肠吻合。手术时间平均(379.2±94.7)min,基于28例成功完成LPD病例的手术时间绘制散点图(图4)与学习曲线(图5),可以看出,开展LPD初期,手术时间更长,至第11例时手术时间缩短,因此CUSUM曲线以上升为主,手术时间479.6 min,称为上升期;第12~16例,手术技术提高,但手术时间缩短不明显,表明技术水平未达到平稳,因此曲线波动,手术时间368.2 min,称为波动期;第17例及以后,手术技术已经较为成熟且稳定,手术时间再次缩短,因此CUSUM曲线迅速下降,手术时间294.3 min,称为成熟期,可认为渡过学习曲线。
2.3 术后情况 术后住院13(10,14.75)d。再次手术1例,为第13例,术后胆漏并发膈下脓肿、感染性休克,开腹探查为胆肠吻合口前壁破口,再次手术缝合胆肠吻合口,放置T管及腹腔引流管,充分引流后好转出院。术后30 d内死亡1例,为第7例,46岁男性,病理诊断为胰腺癌,术前及术中无特殊,C级胰瘘,术后7 d腹腔引流管出现大量鲜血,急诊行介入检查,未见明显动脉性出血,预防性栓塞胃十二指肠动脉断端。介入治疗后生命体征平稳,家属要求暂不行剖腹探查,介入栓塞后第8天腹腔引流管再次引流鲜血,家属放弃有创抢救,循环衰竭死亡。术后30~90 d死亡1例,为第17例,74岁女性,病理诊断胰腺癌,术前经皮经肝胆道引流术减黄,术中无特殊。术后并发消化道出血,内科治疗好转于术后第12天出院,第41天因便血急诊再次入院,入院后出现呼吸心跳骤停,复苏失败死亡。术后病检结果示胰腺导管腺癌12例,胆管癌8例,十二指肠乳头腺癌 4例,神经内分泌肿瘤2例,其他良性疾病2例。术后并发症总发生率为32.1%,其中胰瘘5例(17.9%)、胆漏3例(10.7%)、腹腔出血1例(3.6%)、消化道出血8例(28.6%)。
3 讨 论
LPD具有非常明显的学习曲线。手术时间经常被用作评估学习曲线的主要指标。文献报道,渡过学习曲线的例数在30~60例,开展初期,手术时间多在8~10 h,手术时间随着术者经验的积累而缩短,手术时间进入4~6 h内,可开展血管切除重建,也被认为渡过了LPD学习曲线[15-18]。如何帮助肝胆胰外科医师安全、快速地渡过学习曲线,成为LPD推广应用亟待解决的问题。
我们共顺利完成28例LPD,第12例开始,已有手术时间进入6 h内,根据CUSUM所示,进入成熟期17~28例时手术时间为294.3 min,包括3例血管切除重建。因此我中心进行16例左右即渡过学习曲线,将LPD作为常规手术开展,学习曲线明显缩短。本文现就LPD的主要难点分享经验如下。
3.1 手术时间长 这是准备开展LPD必然面临的挑战。我中心学习曲线上升期手术时间为479.6 min。LPD开展初期,6 h甚至8 h以上的手术时间是极为常见的,因此开展LPD必须具备毅力、恒心。与众多学者一样,我中心主张手术团队成员应尽量固定,包括经验丰富的肝胆胰外科医生[19]。我中心在开展LPD的准备期,腹腔镜肝切除、腹腔镜胃结直肠手术也同期进入学习曲线,进行2 h甚至更长腹腔镜手术的频次为20~30台/月,参与LPD的医生具有腹腔镜操作与配合基础。保持长时间不舒适手术站位、姿势,使外科医师容易疲劳、焦躁。结合LPD的难度,这些因素可能导致术中失误率增加。因此我中心早期标本切除后、消化道重建前会将手术流程放缓稍作休整;重建阶段团队其他医师轮换台上一位双主刀医师,亦可缓解手术时间过长的不良影响。完成19例后,手术时间进入5 h,医师基本不再轮换;手术时间达4 h左右时,LPD已被视为常规手术。
3.2 LPD术中的血管处理及出血应对措施复杂 我中心的实际情况是前期意外损伤血管出血的发生率较高,后期则转变为目的性处理指定血管,以计划性预防出血为主。腹腔镜下扎实的缝合技术是必须的,我中心在开展LPD前期,进行了更多的出血点缝扎。我们的经验是同期开展其他腹腔镜手术时可使镜下缝合技术得到训练,这与LPD术中的血管缝合是相互促进的;采用双主刀模式,发生紧急出血时均可进行镜下缝合,处理血管可能更加及时、流畅。总结以下易出血之处:(1)胃结肠干变异较多,应尽量在汇入门静脉处结扎,此处在切除钩突过程中可能会因为牵拉静脉而反复被触碰,导致钛夹或血管夹意外掉落,术中再次出血。(2)离断钩突时,胰腺钩突与肠系膜上动脉、门静脉、肠系膜上静脉间血管的交通支容易出血,如胰十二指肠下动脉、胰十二指肠上后静脉等。我中心的经验是,离断钩突时于门静脉上下端预置阻断带,无需血管切除重建时,将门静脉向患者左侧牵拉至显露肠系膜上动脉,由右侧术者行主要离断操作;靠近钩突富血管区域时,用LigaSure(图6)烧灼后不剪断,改用合成夹将近端整束组织夹闭后再离断。(3)肝动脉、冠状静脉变异多,清扫7、8、9、12a组淋巴结时容易损伤,我中心主要依靠术前3D重建进行术前辨识,在探查、切除过程中仔细辨认,采取不同的清扫方向加以保护。
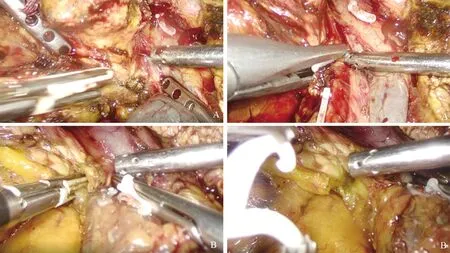
图6 离断钩突时,用LigaSure烧灼组织后再用合成夹夹闭
3.3 腹腔镜下显露解剖困难 一般而言,肿瘤过大、严重肥胖、严重胆管炎、胰腺炎、合并肿瘤侵犯大血管等,相较开腹手术,在层次解剖、视野显露方面LPD的难度可能更大。文献报道,LPD学习曲线进入上升期后,随着术者经验的积累、信心的增加,LPD选择更具挑战性、高风险病例的比例不断上升,这一时期中转开腹率、术后并发症发生率反而未明显降低[20]。本研究中中转开腹的5例患者均因腹腔镜下层次解剖长时间无进展及操作区域无法有效暴露,其中4例处于学习曲线上升期后。显露解剖困难主要出现在探查、切除阶段,我中心认为除熟悉常用的流程化入路以外,了解、掌握一些其他LPD入路,在必要时进行转换会非常有帮助。我中心借鉴的入路为彭兵教授团队流程优化的LPD结肠上区前入路[11],门静脉/肠系膜上静脉受侵犯时,采用肠系膜上动脉优先入路[21]。这些均是结肠上区优先入路,当胰腺下缘与横结肠系膜致密粘连、结肠上区入路难以深入解剖时,转而采用结肠下区的左侧或右侧入路[22],还能继续向门静脉/肠系膜上静脉血管鞘分离前进。我中心认为暴露门静脉/肠系膜上静脉血管鞘是LPD切除中重要的标志与节点。此外,我中心早期探查阶段先解剖出肝总动脉与胃十二指肠动脉,离断胃十二指肠动脉,并在胰腺上缘解剖至门静脉鞘平面后再离断胰腺;后期实践发现,当胰腺上缘由于肿瘤或淋巴结肿大导致局部粘连、难以显露与解剖时,选择先离断胰腺,完全显露门静脉/肠系膜上静脉前方的静脉鞘后再探查动脉,有时可化繁为简,并减少分离出血。
3.4 消化道重建较繁杂 LPD开展前期,探查与切除阶段时间较长,重建阶段术者容易懈怠;如果选择固定的消化道重建方式,消耗的时间、精力是不断减少的。目前成熟的镜下胰肠吻合方式较多,暂无公认的最佳方法,但基本上以导管对黏膜吻合为主,存在操作技巧方面的不同,兼顾张力、血供、密封性[23-25]。我中心胰肠吻合时主刀立于患者两腿之间,采用彭兵教授胰管-空肠的导管对黏膜“兵式”吻合,胆肠吻合由左侧术者完成,胃肠吻合由右侧术者完成。本研究中的消化道相关并发症:(1)胰瘘5例,发生率17.9%,其中C级胰瘘1例。(2)胆漏3例,其中1例再次手术重新行胆肠吻合,2例引流1个月左右自行愈合。(3)术后消化道出血8例,均表现为黑便、血色素下降,住院期间Clavien-Dindo评级[26]未超过Ⅱ级,未行术后胃镜检查,无法确定是否由吻合口并发症引起;其中1例出院后消化道出血复发,未及时就诊,术后41 d急诊就诊,抢救无效死亡。消化道出血是我中心遇到发生率最高的术后并发症,消化道手工吻合、钉枪闭合后关闭入口时均采用连续缝合的方式,早期胃肠连续缝合出现过收线不紧的情况,需要缝合数针后倒回仔细收紧缝线。尝试更换缝线、加固枪道的方式预防术后消化道出血,但效果并不理想;我中心针对性采取的措施转为延迟术后住院至10 d左右,严密观察,并与患者建立密切随访,强调出院1个月内监测大便性状、定期复查血常规的重要性。
综上,现阶段LPD已越来越流程化、标准化,有一定腹腔镜手术基础的中心开展LPD应以模仿借鉴为主,适当开拓创新。本研究借鉴成熟的手术流程化及重建吻合方式,16例LPD后即渡过学习曲线进入成熟期,低于其他研究报道的例数。笔者认为固定的手术团队、同期适量频次开展其他腹腔镜手术、目的性处理特定血管预防出血、熟悉多种LPD入路、选择固定的消化道重建方式,术前辅助3D重建以增加重要解剖结构辨识度等,均是尽早渡过LPD学习曲线的有效措施。总之,增加手术的安全性、优化手术流程、缩短学习曲线、提高患者预后是LPD不断努力前进的方向。

