草酸改性Ti电极用于电化学还原CO2制甲醇
古铭岚,苏永庆,代灵英,王晗雪,张咪
(云南师范大学 化学化工学院,云南 昆明 650500)
自然界无法吸收的CO2导致了严重的环境破坏[1-3],电化学CO2还原反应(eCO2RR)是解决此问题的有效途径[4]。近年来在研究催化eCO2RR的性能中也有了较大的进展[5-13]。Ti具有良好的化学稳定性和耐腐蚀性[14-16],Ti表面的氧化膜可以通过热处理、化学处理、阳极氧化和微弧氧化进行改性[17-21]。Qiu等[22-23]采用阳极氧化法制备了不同煅烧温度(450,550,650 ℃)的TiO2纳米管电极,eCO2RR的主要产物为CH3OH,450 ℃焙烧电极的催化性能最好,法拉第效率达到85.8%。在众多氧化膜改性方法中,热氧化处理不仅能在Ti表面形成致密、厚实的氧化膜,而且具有操作简单、条件温和、效率高等优点。本文就草酸热处理改性纯Ti电极催化电化学还原CO2的性能进行研究。
1 实验部分
1.1 材料与仪器
CO2(纯度为99.9%);Ti片(纯度为99.9%);草酸、碳酸氢钾、氯化钾、无水乙醇、丙酮均为分析纯;溶液用水为蒸馏水。
三电极体系的一室型反应装置;CHI660电化学工作站;GC-14A气相色谱仪;FlexSEM1000扫描电子显微镜(SEM)。
1.2 电极材料的制备
1.2.1 纯Ti电极的制备 剪切为3 cm×3.5 cm的纯Ti片,打磨;Ti片依次经无水乙醇溶液、去离子水超声清洗,每次3 min。
1.2.2 草酸改性Ti电极的制备 剪切为3 cm×3.5 cm的纯Ti片,打磨;Ti片依次经75%乙醇溶液、去离子水、超纯水超声清洗3次,每次5 min;Ti片浸没于5%草酸溶液中,放置在100 ℃烘箱中2 h, 取出后在室温条件下自然冷却;依次用去离子水、超纯水反复超声清洗Ti片直到Ti片表面的污垢清洁干净,室温下自然晾干,备用;将以上制备的Ti片置于马弗炉中,设置升温速度为5 ℃/min,终温为450 ℃,时间为6 h,而后自然冷却至室温,得到草酸改性的Ti电极。
1.3 实验原理和方法
本实验采用三电极体系的一室型反应装置,装置为自行组织装置,见图1,电解质为KHCO3溶液,三个电极分别为工作电极、辅助电极(Pt电极)、参比电极(饱和甘汞电极),并与电化学工作站相连接,进行线性扫描伏安法(LSV)和恒电位电解法(I-t)测试。通过LSV曲线确定eCO2RR的电极电压,在该电极电压下进行I-t测试以确定电解效率。
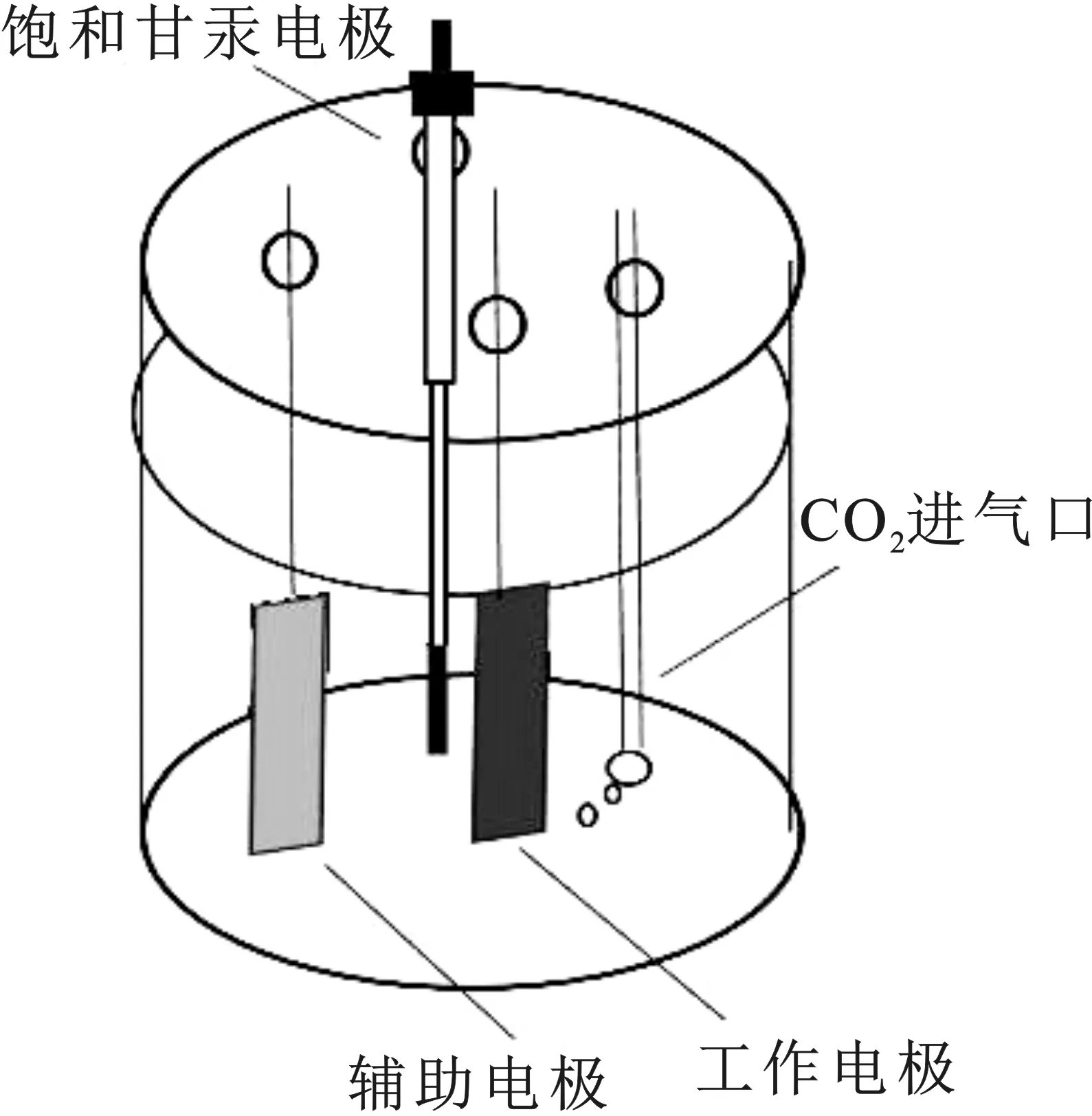
图1 三电极体系的一室型反应装置示意图Fig.1 Schematic diagram of one chamber reactor with three electrode system
电解的产物采用气相色谱仪进行定性和定量检测,色谱仪的工作条件为:气化室温度为220 ℃;色谱柱温度为50 ℃,以20 ℃/min升至180 ℃;检测器温度为260 ℃,进样量为1 μL。
实验的目标产物为CH3OH,故只对CH3OH以及溶液中的其他产物进行定量检测和分析计算。通过绘制CH3OH的气相色谱标准曲线(GC曲线),根据与检测样品的出峰位置和峰面积的对比,可确定产物和得出样品溶液中CH3OH的浓度。
CO2阴极还原为甲醇的理论反应方程式如下:

可见,反应过程中转移的电子数Z为6。对eCO2RR来说,需要计算各还原产物的法拉第效率(FE),计算方法如下:
式中n——产物的物质的量,mol;
Z——电子转移数;
F——法拉第常数,96 485 C/mol;
Q——电解过程中消耗的总电量,C。
2 结果与讨论
2.1 纯Ti电极的CO2阴极还原
2.1.1 LSV曲线的测试 在图1所示的一室型电解池中,电解液是0.5 mol/L KHCO3溶液,通入CO2的流速为30 mL/min,通入时间为30 min至溶液达到饱和,采用恒电位扫描法,进行-2.5~0 Vvs.SCE的线性极化扫描,LSV曲线见图2。
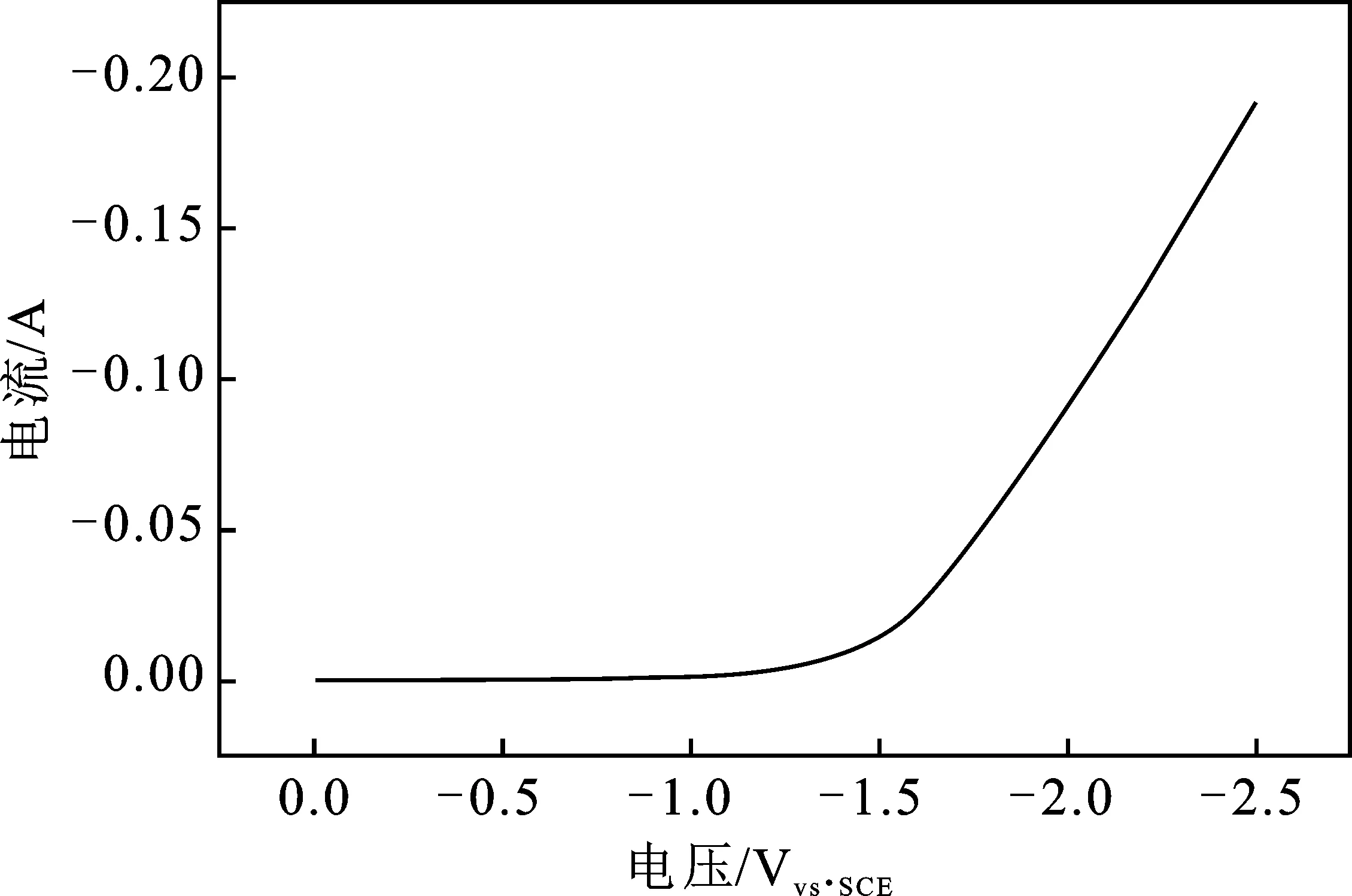
图2 纯Ti电极LSV曲线图Fig.2 LSV curve of pure Ti electrode
由图2可知,曲线的拐点出现在约-1.2 Vvs.SCE的位置,说明在-1.2 Vvs.SCE附近CO2开始发生了还原反应。
在-1.2~-1.7 Vvs.SCE电位之间进行了恒电位电解实验,电解时持续以流速为5 mL/min的速度通入CO2,运行时间为3 h,灵敏度 0.1 A/V,电解后,收集液体,在气相色谱仪中进行检测产物。
2.1.2 电解产物分析 为了更好地对产物进行定性和定量分析,首先通过气相色谱仪分别测定了饱和CO2的0.5 mol/L KHCO3溶液、1×10-6mol/L CH3OH水溶液,以及含有 1×10-6mol/L CH3OH的饱和CO2的 0.5 mol/L KHCO3溶液,见图3~图5。
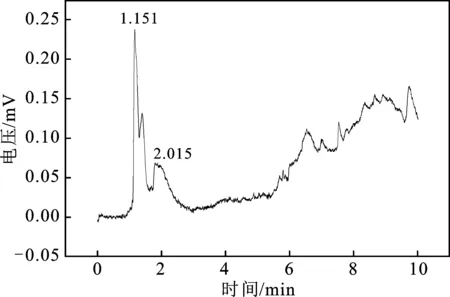
图3 饱和CO2的 0.5 mol/L KHCO3溶液GC图Fig.3 GC diagram of 0.5 mol/L KHCO3 solution saturated with CO2
由图3~图5检测结果来看CH3OH的出峰位置在1.278 min附近。
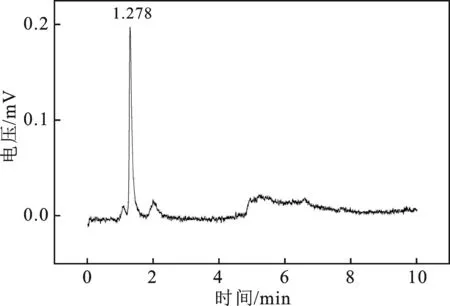
图4 1×10-6 mol/L CH3OH水溶液GC图Fig.4 GC diagram of 1×10-6 mol/L CH3OH aqueous solution
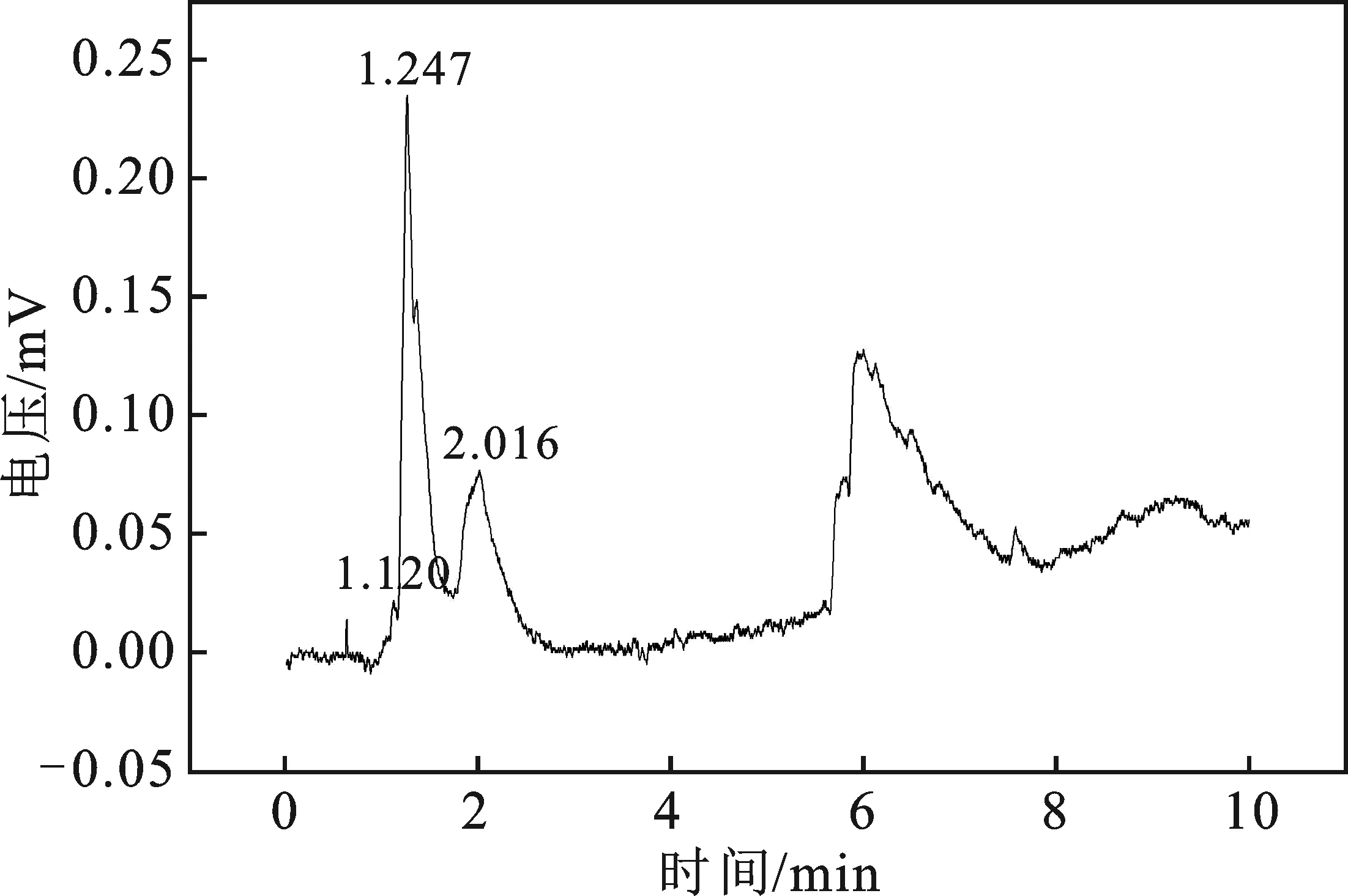
图5 含有 1×10-6 mol/L CH3OH的饱和CO2 的0.5 mol/L KHCO3溶液GC图Fig.5 Diagram of pure Ti electrode electrolytic products
在一室型电解池中,以纯Ti电极为阴极,阳极是Pt电极,电解液0.5 mol/L KHCO3溶液,通入流速5 mL/min的CO2,在-1.4 Vvs.SCE电解电压下电解3 h。 将电解后的电解液进行气相色谱分析,见图6。
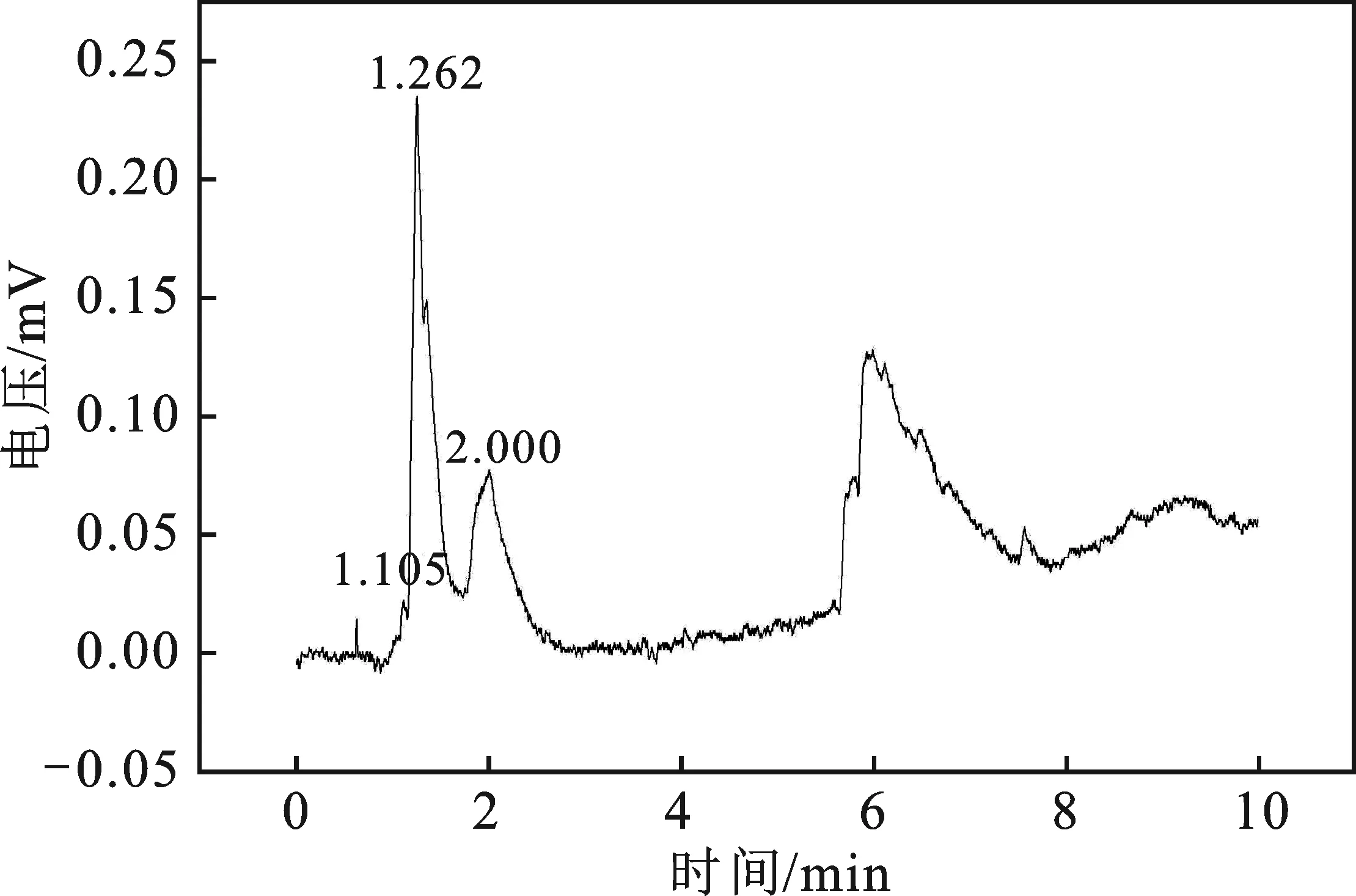
图6 纯Ti电极电解产物图Fig.6 Diagram of pure Ti electrode electrolytic products
由图6可知,电解后的电解液中有CH3OH产生。
2.1.3 电解电压对产物的影响 图7为不同电解电压下的I-t曲线图。
由图7可知,随着阴极电压的增大(向负方向增加,负号表示阴极电压),电流也增大(向负方向增加,负号表示阴极电流)。在电压为-1.2~-1.4 Vvs.SCE之间电解时,电流随时间的变化不大,说明在此电位区间电极的性能较为稳定。当电压继续增大到-1.6 Vvs.SCE和-1.7 Vvs.SCE时,阴极电流随着电解时间的延长不断增加,说明电极上的反应变得更活跃。

图7 纯Ti电极在-1.2~-1.7 Vvs.SCE之间I-t曲线Fig.7 I-t curves of pure Ti electrode between -1.2~-1.7 Vvs.SCE
表1为利用法拉第效率公式计算出的不同电解电压下的电解3 h的CH3OH产物的FE,图8为电解电压对CH3OH的FE的影响趋势图。
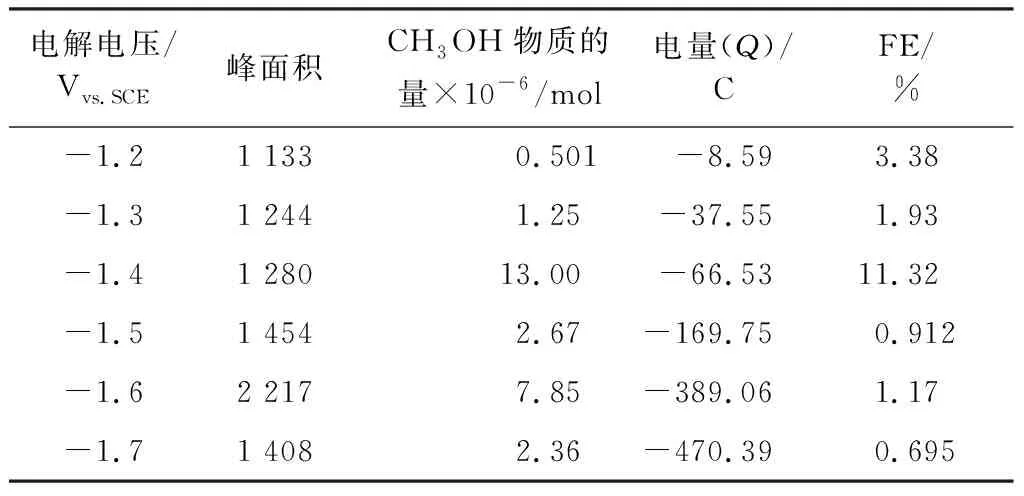
表1 不同电解电位下的电解结果Table 1 Electrolysis results under different electrolysis potentials
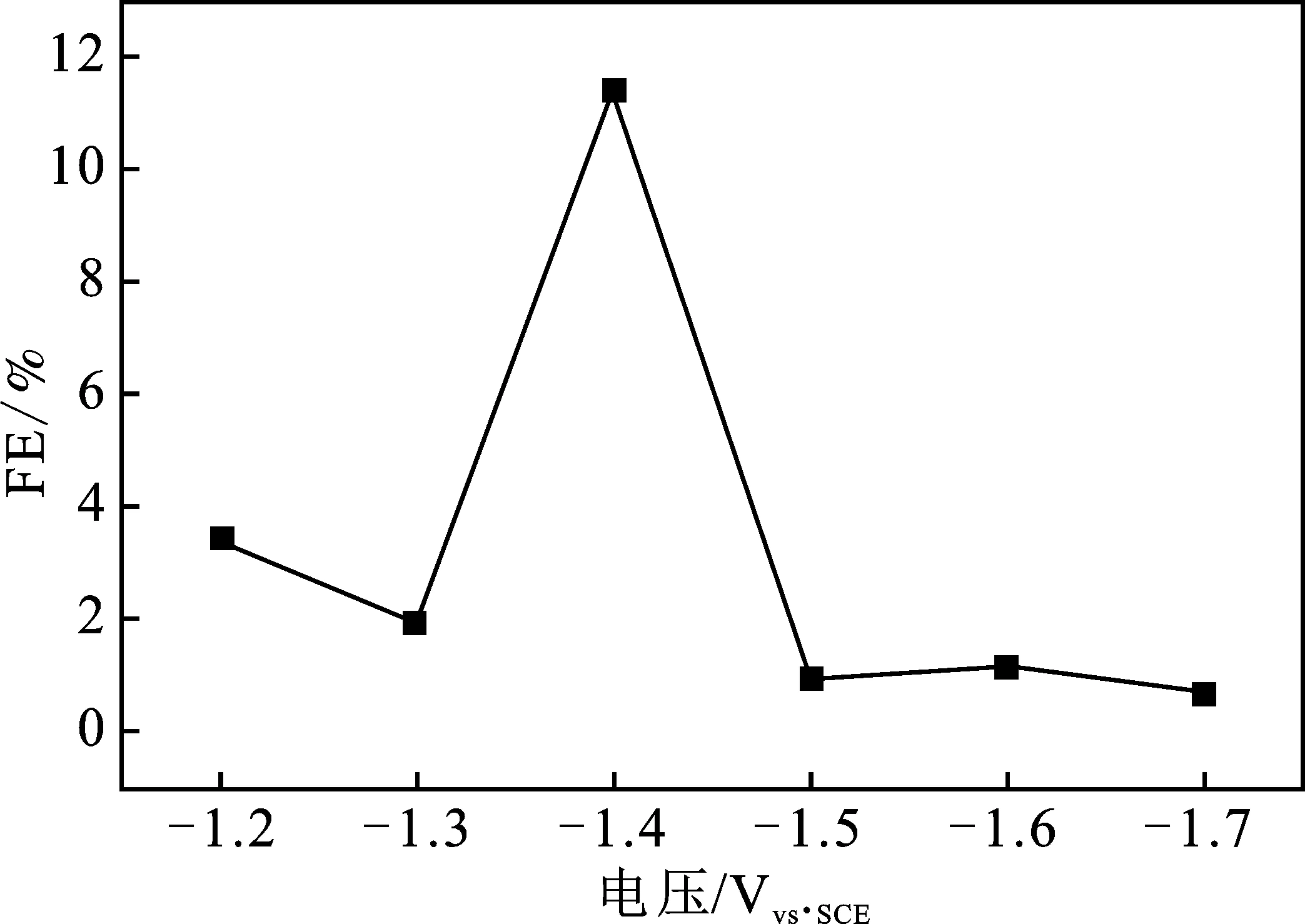
图8 电解电压对CH3OH的FE的影响Fig.8 Influence of electrolytic voltage on FE of CH3OH
由表1和图8可知,在电位为-1.4 Vvs.SCE时,CH3OH的FE最大,为11.32%,而其他电解电压下的CH3OH的FE要小得多,这说明在-1.4 Vvs.SCE时的电解,CH3OH的选择性是最好的。
2.2 草酸处理Ti电极的CO2阴极还原
2.2.1 LSV曲线的测试 实验操作同2.1.1节。图9为草酸处理Ti电极的LSV曲线图,曲线的拐点仍出现在约-1.2 Vvs.SCE处,说明在-1.2 Vvs.SCE附近CO2开始发生了还原反应。在一室型电解池中,以草酸处理Ti电极为阴极,阳极是Pt电极,电解液0.5 mol/L KHCO3溶液,通入流速为5 mL/min的CO2,在-1.4 Vvs.SCE电解电压下电解3 h。将电解后的电解液进行气相色谱分析,结果见图10,与图5对比表明电解后的电解液中有CH3OH产生。
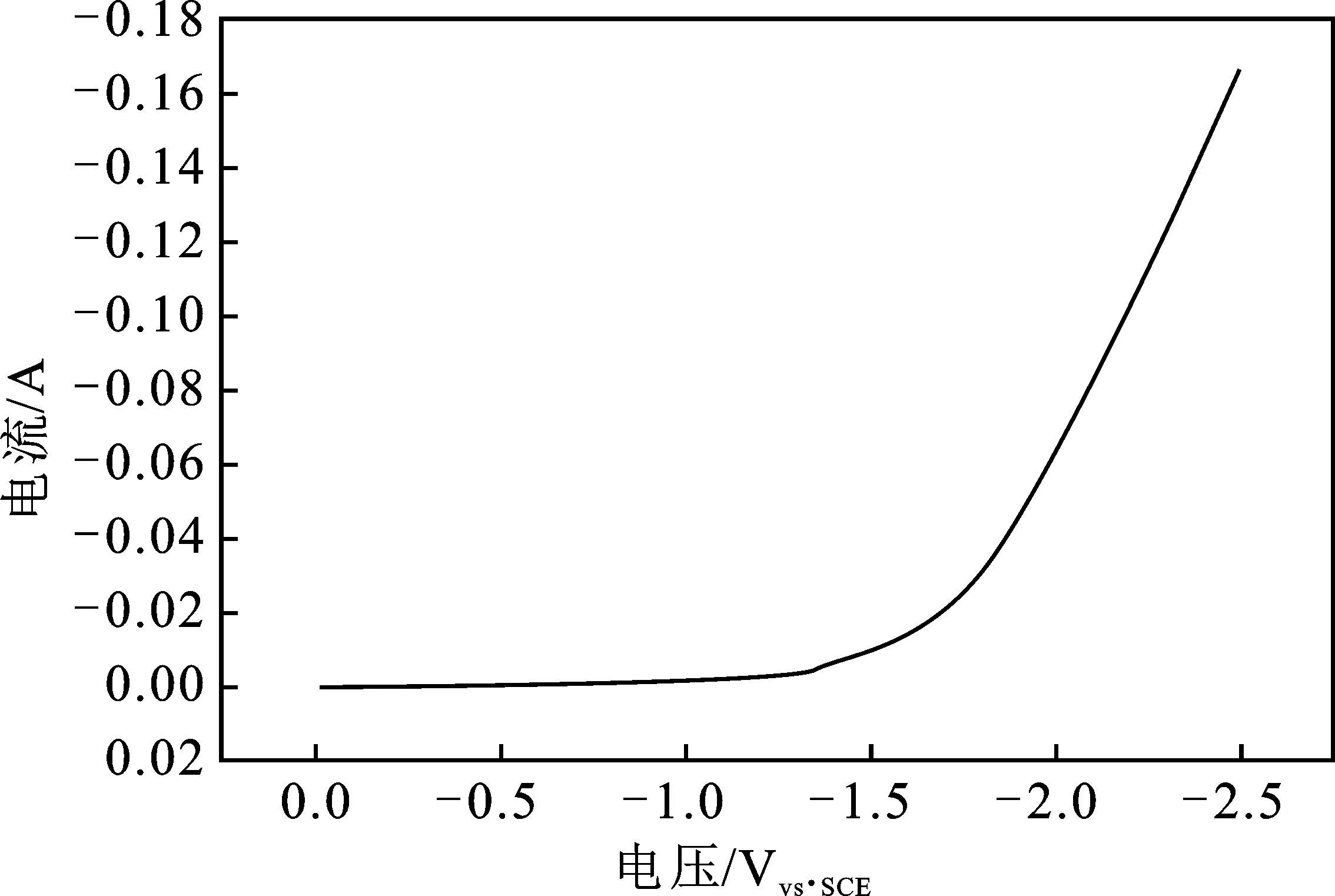
图9 草酸处理Ti电极LSV曲线图Fig.9 LSV curve of Ti electrode was modified by oxalic acid

图10 草酸处理Ti电极电解产物图Fig.10 Diagram of electrolytic products of Ti electrode was modified by oxalic acid
2.2.2 电解电压对产物的影响 以草酸处理Ti电极为阴极,阳极是Pt电极,电解液0.5 mol/L KHCO3溶液,通入流速5 mL/min的CO2,在-1.2~-2.0 Vvs.SCE电位之间进行了恒电位电解实验,电解时间为3 h。图11为不同电解电压的I-t曲线图。
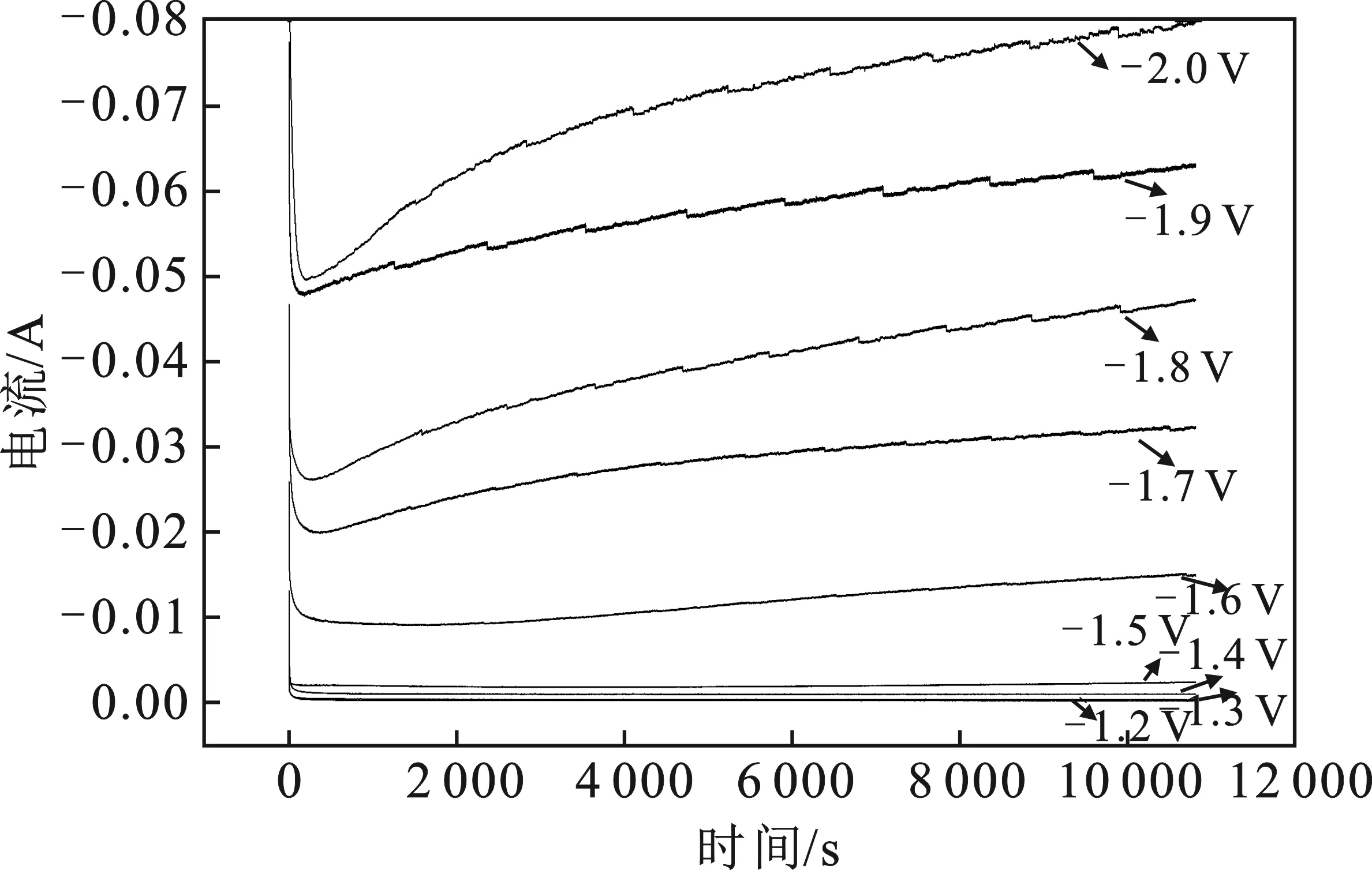
图11 草酸处理Ti电极在-1.2~-2.0 Vvs.SCE 之间I-t曲线Fig.11 I-t curves of oxalic acid-treated Ti electrode between -1.2~-2.0 Vvs.SCE
由图11可知,在电压为-1.2~-1.6 Vvs.SCE之间电解时,电流随时间的变化不大,说明在此电位区间电极的性能较为稳定。在电压调至-1.7~-2.0 Vvs.SCE时,阴极电流随着电解时间的延长不断增加,说明电极上的反应变得更活跃。
利用法拉第效率公式计算出的不同电解电压下产物甲醇的FE,见表2和图12。
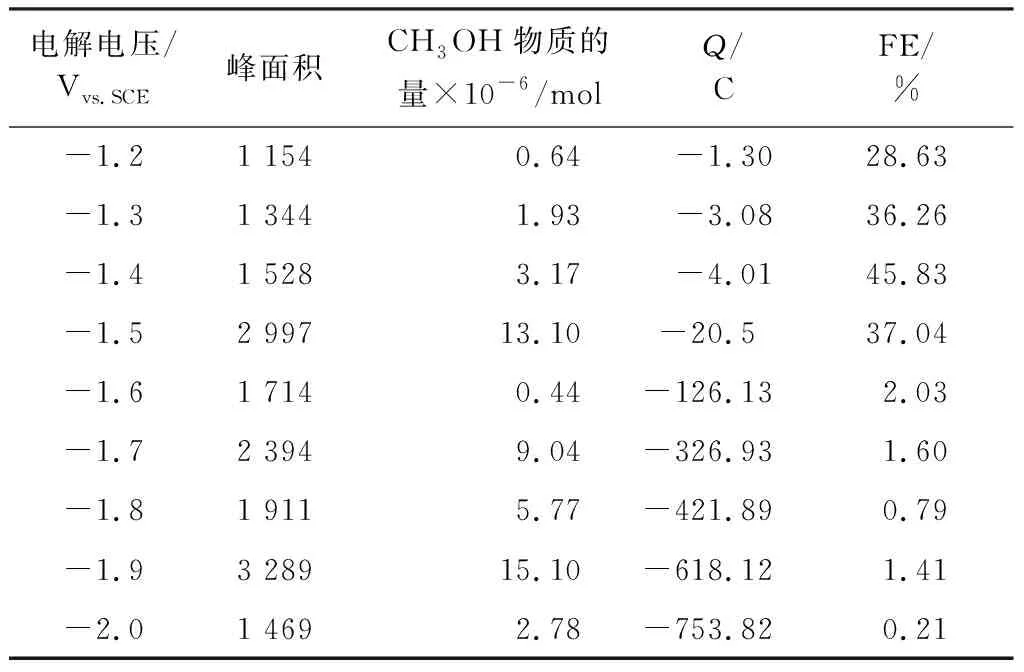
表2 不同电解电位下的电解结果Table 2 Electrolysis results at different electrolytic potentials
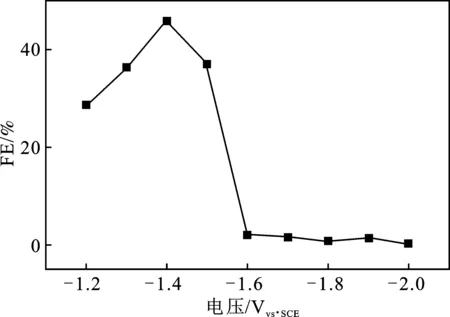
图12 电解电压对CH3OH的FE的影响Fig.12 Influence of electrolytic voltage on Fe of CH3OH
由表2和图12可知,在电位为-1.4 Vvs.SCE时,CH3OH的FE最大,为45.85%,而其他电解电压下的CH3OH的FE要小得多,这说明在-1.4 Vvs.SCE时的电解,CH3OH的选择性是最好的。
2.2.3 电解时间对产物的影响 以0.5 mol/L KHCO3溶液为电解液,电解电压为-1.4 Vvs.SCE,通入流速5 mL/min的CO2,电解时间分别为1,3,5,10 h的电解实验。电解开始时的电流为-7.105×10-3A,电解时间10 h时后的电流为-5.876×10-4A,电流略有减小但变化不大,说明电极稳定性较好。不同电解时间对CH3OH的FE的影响见表3。
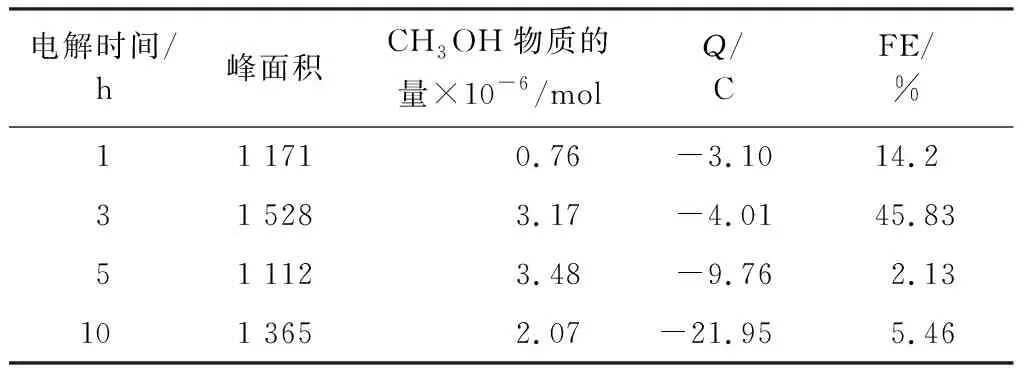
表3 不同电解时间对CH3OH的FE的影响Table 3 Influence of different electrolytic time on FE of CH3OH
由表3可知,电解时间为3 h时,产物甲醇的FE最大,随着电解时间的增长,虽然产物CH3OH的量有所增加,但增加不大,致使FE反而变小。
2.2.4 电解液浓度对产物的影响 分别以0.4,0.5,0.6 mol/L KHCO3溶液为电解液,电解电压为-1.4 Vvs.SCE,通入流速5 mL/min的CO2,电解时间为3 h,产物CH3OH的FE见表4。

表4 不同电解液浓度对CH3OH的FE的影响Table 4 Influence of different electrolyte concentrations on FE of CH3OH
由表4可知,0.5 mol/L KHCO3溶液作电解液时,产物甲醇的FE最大,为45.83%。
2.3 电极的表征
2.3.1 扫描电子显微镜(SEM) 利用SEM来观察所制备电极表面的微观形貌,测试的主要技术参数为:放大倍数(Mag)在 16~800 000倍之间,分辨率为 4.0 nm(20 kV,SE),加速电压 0.3~20 kV之间。
图13为纯Ti电极仅经砂纸打磨过后的×5.00 k的SEM图。

图13 纯Ti电极×5.00 k SEM图Fig.13 SEM image of ×5.00 k of pure Ti electrode
由图13可知,除了因砂纸打磨而在电极表面留下的划痕以外,表面较为光滑。
图14为草酸处理Ti电极后的×5.00 k的SEM图。
由图14可知,电极表面呈现出凹陷和孔洞,且较为均匀,微观表面粗糙度明显增加。与纯Ti电极相比,经草酸处理后的电极的有效微观表面积和表面活性有较大的增大,可见草酸处理Ti电极在CO2阴极还原为CH3OH的效果是非常明显的。

图14 草酸处理Ti电极×5.00 k SEM图Fig.14 SEM image of ×5.00 k of Ti electrode was modified by oxalic acid
3 结论
将CO2通入KHCO3溶液中,以Ti电极作阴极,在阴极电压-1.2 Vvs.SCE以下时电解,可得到CH3OH,在-1.4 Vvs.SCE时,CH3OH的FE最大,产物CH3OH的选择性最好。在-1.4 Vvs.SCE以下,随着其他还原反应的发生,CH3OH的法拉第效率急剧下降。Ti电极经草酸腐蚀和热处理改性后,微观表面由原来的光滑变成了凹陷和孔洞,极大地增加了微观表面积和对CO2还原的反应活性。草酸处理Ti电极的阴极还原CO2的最优条件为:电解电压为-1.4 Vvs.SCE,电解液为0.5 mol/L的KHCO3水溶液,电解时间为3 h,产物CH3OH的FE达到了45.83%。在电解过程中,电流变化不大,表明电极稳定性较好。

