THF对CO2水合物储气蓄冷特性影响
王洪粱,吴强
(黑龙江科技大学 安全工程学院,黑龙江 哈尔滨 150022)
CO2水合物性质稳定,常温下其储运压力较低,蓄冷量大[1],储气量高[2],集传统水系灭火剂和二氧化碳灭火剂优点于一身,有望成为一种新型环保灭火材料。近年来,为了改善水合物的形成条件,常常使用促进剂[3],而THF是最常用的热力学促进剂[4]。Strobel[5]和de Deugd R等[6]发现添加THF可以得到最佳的热力学条件。Anthony Delahaye等[7]采用差热分析和差示扫描量热法测定了THF-CO2水合物分解焓。D L Zhong等[8-9]和G Yue等[10]研究了以水合物为基础的气体分离技术,研究表明THF能够提高相平衡参数。CO2水合物作为灭火新材料,其储气蓄冷特性研究较少。本文通过实验研究了THF对CO2水合物储气蓄冷特性的影响。
1 实验部分
1.1 材料
二氧化碳气体,由哈尔滨黎明燃气有限公司提供;THF纯度为99.9%,由哈尔滨分析仪器有限公司提供。此外,所有实验都使用去离子水。
1.2 实验装置
反应釜由316不锈钢制成,内径9.2 cm,高度26.5 cm,体积容量1 500 cm3。反应釜周围有一个水套,水浴温度由一个外部恒温箱进行控制。在反应釜的侧面装有一个矩形观察窗和一个照明窗口,用于目视观察。反应釜中安装两个温度传感器(Ω,T型,±0.01 K)分别测量釜内气相和液相的温度,安装有一个罗斯蒙特智能压力传感器(3051S型,±20 kPa) 用于监测反应釜内压力。储气罐采用304不锈钢制成,容积为12.0 L,储气罐安设有一个压力传感器和温度传感器,其型号和精度与反应釜中传感器相同。压力和温度数据由数据采集系统(国家仪器)采集,并通过可视软件记录在计算机中。数据采集单元与计算机相连,每秒采集实验数据。
二氧化碳水合物实验装置见图1。
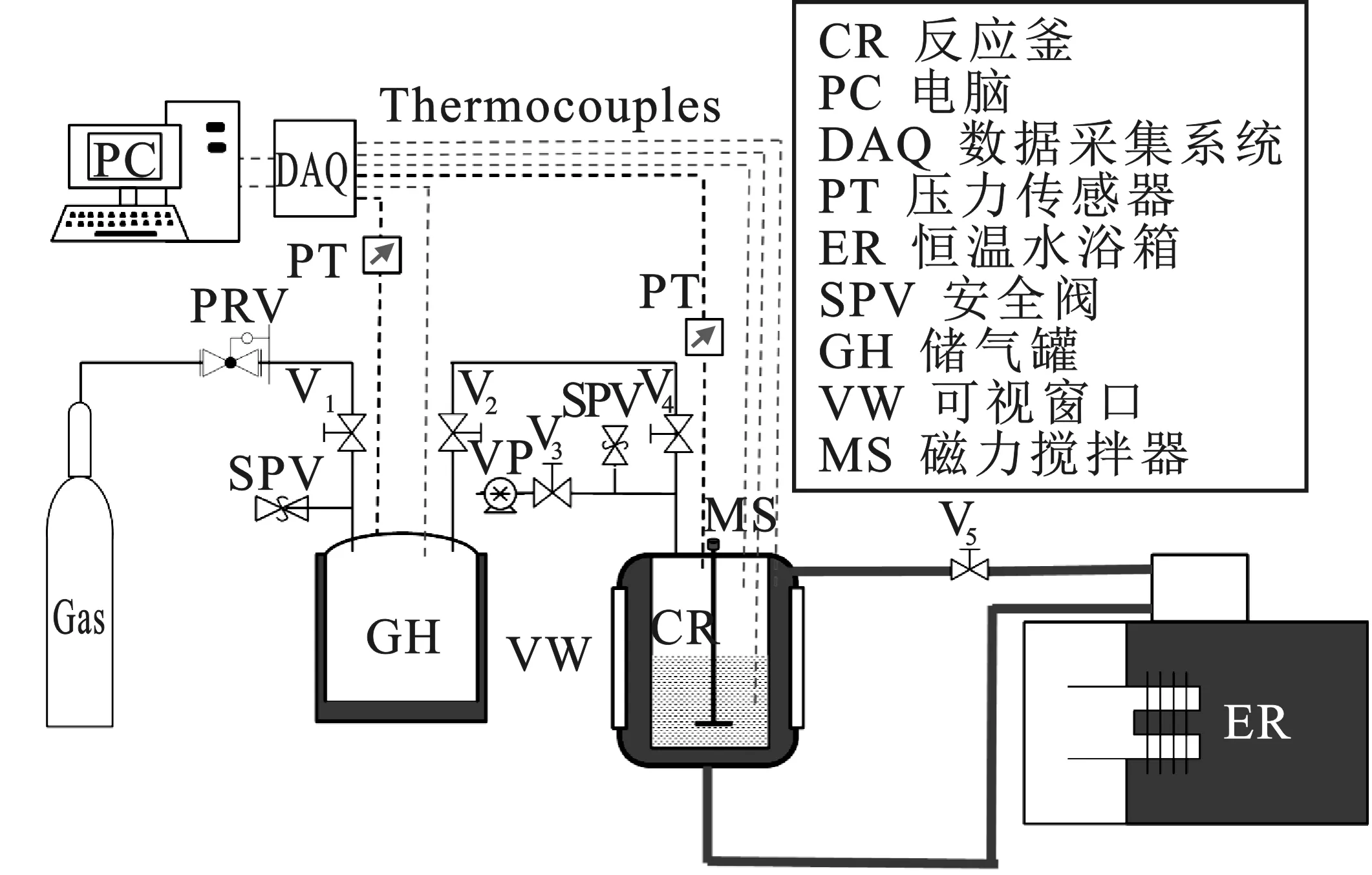
图1 二氧化碳水合物实验装置图Fig.1 Carbon dioxide hydration experimental device
1.3 实验方法
实验制备了3种浓度的THF溶液分别为摩尔含量1.0%,2.0%,3.0%,下文中THF浓度均指摩尔浓度。采用不同浓度的650 mL THF浓度水溶液进行CO2水合物生成实验,测定CO2水合物形成过程中的储气和蓄冷规律。在每次实验运行之前,采用去离子水对反应釜进行清洗。在反应釜中加入实验溶液,使用气源反复置换釜内气体,排除釜内空气。调节外部恒温箱,使系统温度固定在288.15 K。采用储气罐给反应釜进行供气,持续供气12 h,使反应釜中溶液达到溶解平衡,溶解平衡后釜内压力为3.0 MPa;关闭储气罐供气阀,打开搅拌器并设定搅拌速度为500 r/min,设置恒温箱温度为271.15 K,在固定温度下进行了定容水合物生成实验。随着水合物的形成,釜内压力不断下降,直到反应釜2 h内没有明显的压降,实验结束。
1.4 计算方法
1.4.1 CO2水合物储气量及储气速率计算
1.4.1.1 CO2水合物储气量计算 由于CO2在水溶液中的溶解度较大,因此在计算CO2水合物储气量时,不仅需要计算气相CO2的变化量,还要考虑液相中CO2的变化量。由质量守恒定律,反应釜中任何一个时刻CO2摩尔数是相同的,水合物形成时消耗摩尔数可由式(1)计算:
nCO2=ngtol-ng-nl
(1)
式中nCO2——水合物形成时的CO2储气量,mol;
ngtol——反应釜中总的CO2的量,mol;
nl——液相中CO2的溶解量,mol;
ng——反应釜中气相CO2的量,mol。
此次实验是由储气罐给反应釜供气,因此反应釜中总的CO2的量ngtol,可根据供气前后储气罐中的气体状态参数按式(2)进行计算:
(2)
式中,PGT,TGT,VGT分别为储气罐的压力、温度和容积,0状态为供气前储气罐内气体状态,1状态为供气后储气罐内气体状态。
反应釜中气相CO2的量ng,由釜内气体状态参数,按式(3)计算:
(3)
式中,P、V和t分别为t时刻反应釜中气相压力、体积和温度。式(2)和式(3)中的R为理想气体常数8.31 J/(mol·K)。Z是根据Pitzer相关系数计算的压缩系数,按式(4)进行计算,式中 B0和B1使用公式(5)计算,pr和Tr使用式(6)计算。
(4)
(5)
(6)
式(6)中Pc,Tc为CO2的临界压力和临界温度,对于CO2气体Pc=7.381 MPa,Tc= 304.19 K,ω=0.225。
液相中CO2物质的量nl由式(7)进行计算。
nl=ns·mCO2=(nwtol-nw)mCO2
=(nwtol-nCO2nHN)mCO2
(7)
式中,nwtol为反应前注入系统中水的量,mol;ns为水合反应后剩余水的量,mol;mCO2为水合物存在状态下CO2气体的溶解度,%;nw为水合反应消耗水的量,mol;nHN为CO2水合物的水合数。
文献[11]对SI型水合物的水合数nHN1测定结果为7.23,SⅡ型CO2水合物的水合数nHN2在文献中没有准确测定。依据文献[12]CO2-THF水合物结构中THF占据所有8个大空腔,CO2分子占据16个小空腔,因此计算得出SⅡ型水合物每摩尔CO2气体的水合数nHN2为8.5。
mCO2为水合物存在状态下CO2气体的溶解度,%,Larryn W Diamond等[13]研究得出了水合物存在状态下CO2气体的溶解度mCO2计算公式:
mCO2=1.570 451+7.887 505×10-2(T-273.15)+4.734 72×10-3(T-273.15)2+4.564 77×10-4(T-273.15)3-3.796 084×10-5(T-273.15)4
(8)
公式(9)是由式(1)~式(8)得出的水合物形成时的CO2储气量计算式:
(9)
由水合物形成公式,水合物相中CO2储气量nCO2与CO2水合物生成量nh相等,即:
(10)
1.4.1.2 CO2水合物储气速率 采用正向差分法计算CO2水合物储气速率,如公式(11)所示:
(11)
式中Δt是两个时刻之间的时差,取1 min[14]。
CO2水合物储气速率的平均值(Rav30)通过公式(12)[15]每30 min计算一次。
Rav=
(12)
1.4.2 CO2水合物蓄冷量及蓄冷速率计算
1.4.2.1 CO2水合物蓄冷量计算
Qtotal=nh·Qh
(13)
式中,Qtotal为CO2水合物总蓄冷量,kJ;Qh为每mol水合物分解热,依据Anthony Delahaye等[7]的测定结果SI型CO2水合物的分解焓Qh1为65.0 kJ,结构SⅡ型CO2水合物的分解焓Qh2为165.0 kJ。
1.4.2.2 CO2水合物蓄冷速率计算
(14)
式中Δt是两个时刻之间的时差,取1 min。
CO2水合物蓄冷速率的平均值(Qav30)通过公式(14)每30 min计算一次。
Qav=
(15)
2 结果与讨论
尽管二氧化碳水合物灭火材料具有许多优点,但仍需改善水合物的形成条件来实现CO2水合物灭火材料的工业应用。THF能够极大改善CO2水合物的形成条件,是目前应用较多的热力学促进剂。通过改变促进剂THF浓度,研究在搅拌作用下促进剂对CO2水合物生成过程的影响。实验选用了3.0 MPa 的固定实验压力,选取500 r/min为实验搅拌速度,配制了3种浓度的THF体系(1.0%,2.0%,3.0%均为摩尔浓度)为研究对象。表1显示了CO2水合物储气实验结果包括实验结束时的储气量nCO2(mol)、SI型水合物储气量nSⅠ(mol)和SⅡ型水合物储气量nSⅡ(mol),以及CO2水合物蓄冷实验结果包括实验结束时的蓄冷量QCO2(kJ)、 SI型水合物储气量QSⅠ(kJ)和SⅡ型水合物储气量QSⅡ(kJ)。
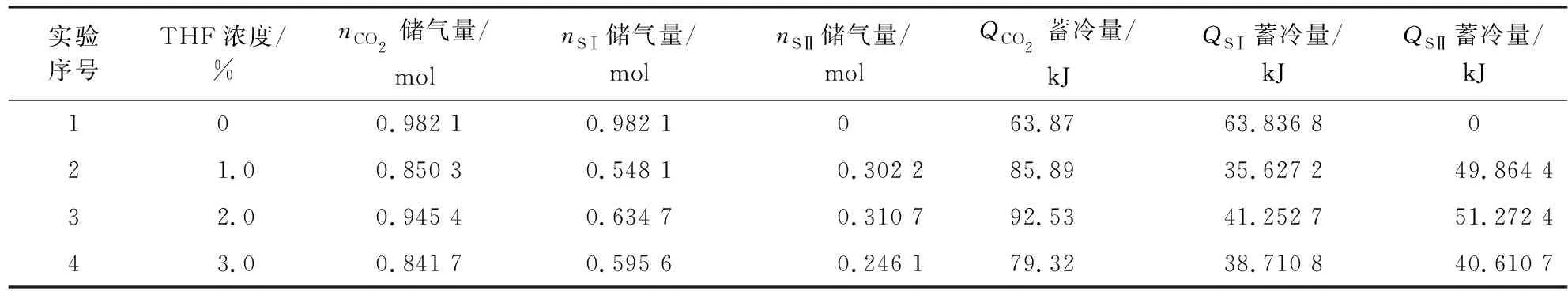
表1 THF体系下CO2水合物形成实验条件及结果Table 1 Summary of experimental conditions and results for CO2 hydrate formation with THF system
2.1 CO2-THF水合物形成过程分析
CO2水合物的储气蓄冷特性不仅取决于形成条件,还取决于水合物形成时的晶体结构。促进剂种类的不同,CO2水合物生成过程和晶体结构是不同的。
图2为THF作用下CO2水合物生成过程。以1%THF体系为例,对比纯水体系水合物形成曲线可知,1%THF体系CO2水合物生成曲线与纯水体系下CO2水合物生成曲线有明显不同。纯水体系下随着水浴温度的不断下降,反应釜内压力和温度也随着下降,即曲线A-E段(该段时间定义为诱导时间Tind),到达E点后,釜内相平衡条件打破,釜内压力开始急剧下降,水合物开始大量生成,600 min后,釜内压力基本恒定,水合实验结束;而1%THF体系CO2水合生成过程分为两段进行(B-C段和C-D段),随着釜内温度的降低,压力由A点下降到B后,相平衡打破,水合物开始形成,釜内压力下降较为平缓,到达C点后,相平衡二次打破,水合物二次形成,压力开始急剧下降,600 min后,釜内压力基本恒定,水合实验结束。THF体系下水合物生成过程分两段进行主要是因为体系中存在热力学促进剂THF,根据文献报道,少量的THF可以使CO2水合物的结构由SI型改变为SⅡ型,考虑到单一的THF水合物(SⅡ型),THF占据全部8个大笼,由此可以推断出CO2+THF体系中THF也同样占据大笼,只有16个小笼子能被二氧化碳分子占据[16],因此储气量和储气速率下降,且均小于SI型水合物。1%THF体系下,CO2水合物最先形成SⅡ型水合物,即图中B-C段形成,到达C点后SⅡ型水合物生成结束,开始生成SI型水合物,CO2开始被大量消耗,即图中C-D段生成。

图2 典型的P和T随CO2水合物形成变化曲线Fig.2 Typical P and T changes with time for CO2 hydrate formation
THF通过改变部分CO2水合物的晶体结构,同时改变了水合物的形成时间和形成条件。图3显示了THF体系下CO2水合物形成时间。
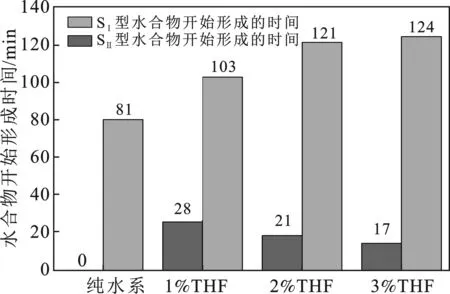
图3 THF体系下CO2水合物形成时间Fig.3 Formation time of CO2 hydrate with THF system
由图3可知,THF能极大地缩短诱导时间,从纯水体系的81 min缩短至17 min(3%THF),诱导时间缩短了近80%;随着THF浓度的增加,诱导时间逐渐缩短。这主要是由实验开始形成的水合物晶型不同造成的,纯水实验系统只生成SI型水合物,因此实验诱导时间较长;系统添加THF后,实验最先形成SⅡ型水合物,因此诱导时间大幅缩短,这与文献[17]获得的规律相一致。
2.2 THF对CO2水合物储气特性影响分析
THF的添加,改变了CO2水合物的晶体结构,影响了水合物的储气特性。从水合物的储气量来分析,THF体系形成水合物时的储气量曲线形状与纯水体系是不同的,结果见图4。
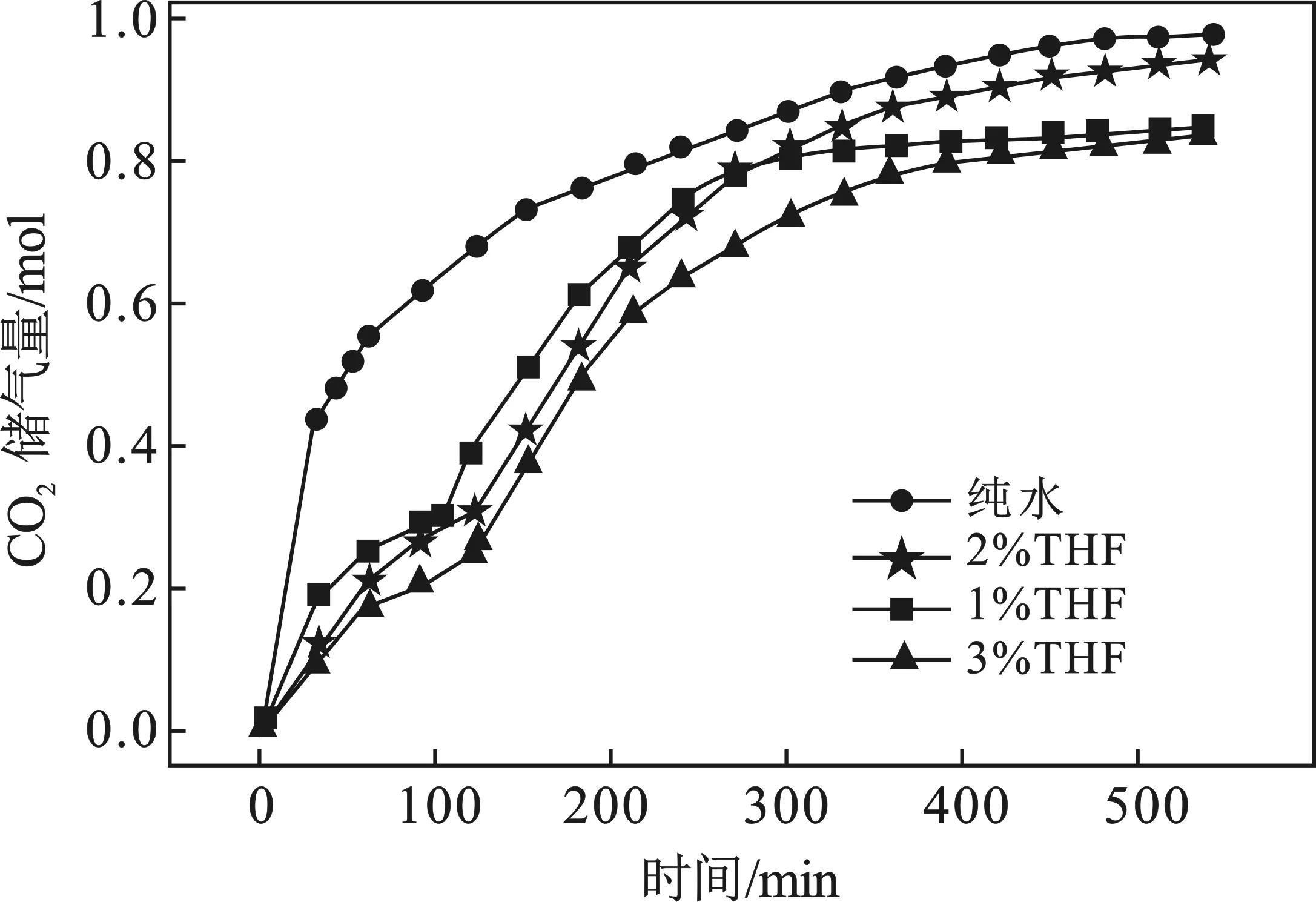
图4 THF体系下二氧化碳水合物储气量曲线Fig.4 Gas storage capacity curve of CO2 hydrate with THF system
纯水系CO2水合物形成时,储气量曲线只有一个储气峰段,在水合物刚形成时储气量急剧增加,随着时间的推移,储气量曲线慢慢平缓,540 min后达到平衡状态。而THF体系下CO2水合物形成时,储气量曲线均出现两个峰段,第1个峰段均低于纯水系,主要是因为在THF的作用下,最先形成SⅡ型水合物,THF占据大笼,只有16个小笼子能被二氧化碳分子占据,因此储气量下降,均小于SI型水合物。第2个峰段为SI型水合物的形成时间,速率明显提高,但从总储量来看,THF体系储气量均小于纯水系。纯水体系CO2水合物最终储气量达到0.982 1 mol,而加入THF促进剂后,2%THF体系CO2的储气量最高为0.945 4 mol,储气量下降了3.7%,1%THF体系和3%THF体系的最终储气量接近相等,分别为0.850 3,0.841 7 mol,同纯水系相比下降了13.4%,因此从总的储气量来看,在3种浓度的THF体系中,2%THF体系对CO2水合物储气量的影响最小。
THF体系下CO2水合物的储气量分为两部分,SI型水合物储气量和SⅡ型水合物储气量,各型的储气量见图5。

图5 THF体系下各晶型CO2水合物储气量Fig.5 Gas storage capacity of each CO2 hydrate crystal form with THF system
由图5可知,2%THF体系下,SⅠ型水合物储气量和SⅡ型水合物储气量均超过其他体系分别为0.634 7,0.310 7 mol,1%THF体系下CO2水合物SⅡ型水合物储气量大于3%THF体系,而SⅠ型水合物储气量小于3%THF体系。从储气量的分布能够看出,THF体系下SI型水合物储气量占比较大,均超过65%。因此SI型水合物形成越多,其储气量越大。
CO2水合物储气速率也是研究储气特性重要方面之一。图6显示了THF体系下CO2水合物的储气速率。
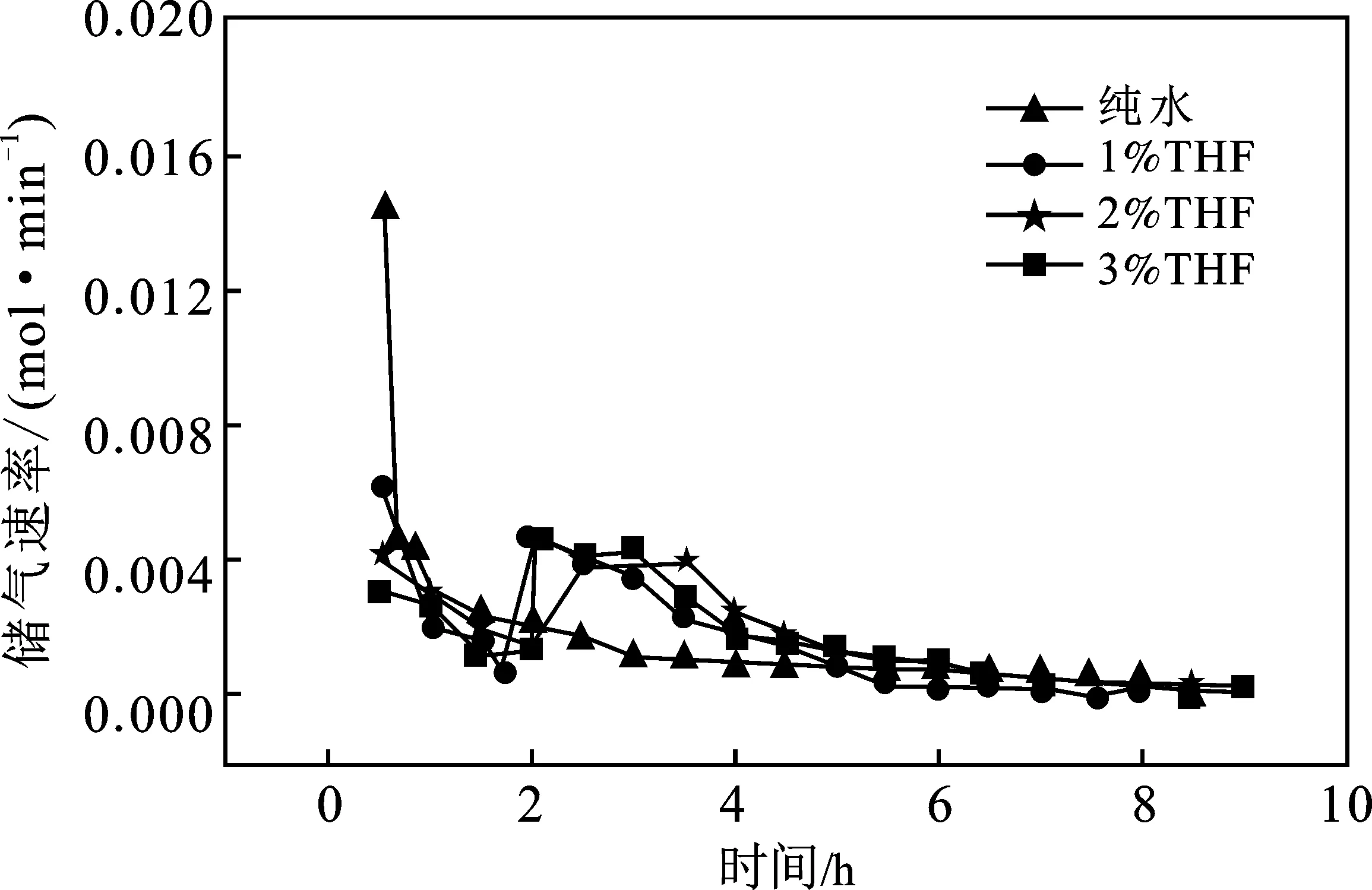
图6 THF体系下CO2水合物形成速率Fig.6 Rate of CO2 hydrate formation at different initial molar concentration of THF
由图6可知,所有THF体系在形成开始时,均表现出很高的形成速率,随后曲线开始下降,一段时间后又上升的过程,依据水合物的形成过程,可知初始水合物速率曲线由高到低段为SⅡ型水合物储气速率,由低到高再下降段为SⅠ型水合物储气速率;由此可见,THF存在下SⅡ型水合物储气速率低于SⅠ型水合物储气速率。1.0%THF、2.0%THF和3.0%THF体系水合物形成时的速率依次为0.006 3,0.004 1,0.003 1 mol/min均低于纯水体系的0.014 7 mol/min,THF浓度越高生成的SⅡ型水合物越多,与CO2竞争水合物笼的THF分子就越多,抑制了水合物的储气速率。随着SⅡ型水合物的形成结束,开始形成SⅠ型水合物,其储气速率达到第二个峰值,之后所有体系的形成速率逐渐下降,最终在540 min左右达到零。
通过以上分析知道THF能够改善CO2水合物的形成条件,大幅缩短水合物形成的诱导时间,但THF的存在降低了水合物的储气量和储气速率,综合3种THF体系下的储气量和平均储气速率,2%THF体系下CO2水合物储气量最高,平均水合反应速率也最高,是CO2水合物形成时的最优选择。
2.3 THF对CO2水合物蓄冷特性影响
蓄冷特性是CO2水合物作为防灭火新材料最重要特性之一。本研究主要从蓄冷量和蓄冷速率两个方面来考察CO2水合物的蓄冷特性。
图7为THF体系下CO2水合物蓄冷量曲线图。
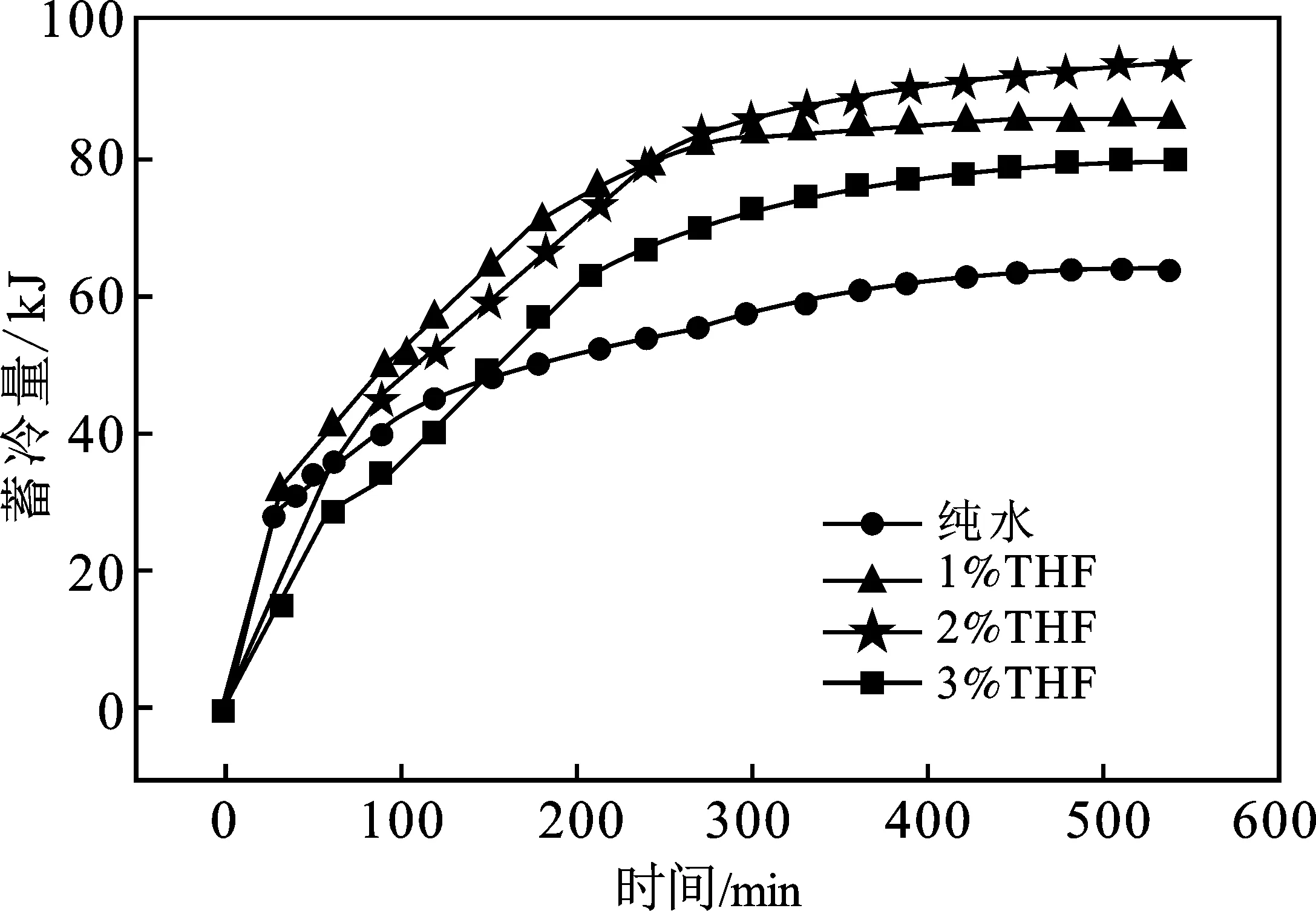
图7 THF体系下二氧化碳水合物蓄冷量曲线Fig.7 Cold storage capacity curve of CO2 hydrate with THF system
对比储气量曲线图,由图7可知,THF体系下CO2水合物蓄冷量曲线形状与储气量曲线是不同的,THF体系下储气量曲线存在两个峰段,但蓄冷量曲线峰段划分不明显,这主要是由于不同晶型的水合物蓄冷量是不同的,每mol SⅠ型水合物蓄冷量为65 kJ,而每mol SⅡ型水合物的蓄冷量高达165 kJ,SⅡ型水合物蓄冷量依靠其更高的蓄冷密度弥补了形成速率的下降。
从总蓄冷量来看,纯水体系CO2水合物最终蓄冷量最低为63.8 kJ,THF体系下均形成大量的SⅡ型水合物,因此THF体系CO2水合物的蓄冷量均高于纯水系,其中2%THF体系下蓄冷量最高达到92.5 kJ,是纯水体系的1.45倍。从各水合物晶型蓄冷量分布来看(图8),2%THF体系下SⅡ型水合物蓄冷量最大达到51.3 kJ,其他THF体系下SⅡ型水合物蓄冷量占比也均超过50%,因此SⅡ型水合物形成越多,其蓄冷量越大。

图8 THF体系下各晶型CO2水合物蓄冷量Fig.8 Cold storage capacity of each CO2 hydrate crystal form with THF system
CO2水合物蓄冷速率也是研究蓄冷特性重要方面之一。图9显示了THF体系下CO2水合物的蓄冷速率。
由图9可知,CO2水合物蓄冷速率在水合物形成时最高,纯水系、1.0%THF、2.0%THF和3.0%THF体系水合物形成30 min内平均蓄冷速率依次为0.940 4 ,1.037 9,0.673 5,0.504 9 kJ/min,THF体系下,水合物蓄冷速率曲线与储气速率曲线相似,同样存在先下降后上升再下降的过程,这种现象主要是由于SⅡ型水合物蓄冷结束时,SⅠ型水合物开始大量蓄冷产生的。与储气速率曲线不同的是,开始阶段1%THF体系蓄冷速率超过纯水体系,且纯水体系水合物蓄冷速率下降更快,30 min后,THF体系蓄冷速率均超过纯水体系,这主要是由于SⅡ型水合物分解焓远超SⅠ型水合物分解焓造成的。540 min后蓄冷速率逐渐归零。
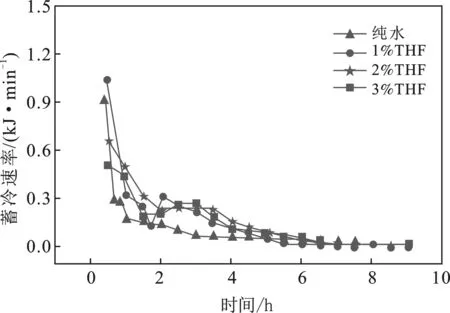
图9 THF体系下CO2水合物蓄冷速率Fig.9 Cold storage rate of CO2 hydrate with THF system
3 结论
在搅拌反应釜中,考察了THF体系下CO2水合物储气蓄冷性能,从水合物形成过程来看,THF的添加改变了CO2水合物形成晶型,大幅缩短了水合物的形成时间,大幅提高水合物形成速率和蓄冷效率。但同时THF会降低水合物储气量和储气速率,其中2%THF体系的储气量和储气速率最高,与纯水体系比2%THF的储气量下降了13.4%。SⅡ型水合物储气量的减少,造成了CO2水合物SⅠ型水合物储气占比超过65%,储气速率也存在两次储气峰值。水合物的蓄冷特性由水合物的晶型和形成量共同决定,因此具有与储气特性相似的规律,但是由于每mol SⅡ型水合物的蓄冷量为SⅠ型水合物的2.5倍,因此水合物的蓄冷量中SⅡ型水合物的蓄冷量的占比超过50%,超过SⅠ型水合物的蓄冷量;从总蓄冷量来看,2%THF体系蓄冷量最高。因此,THF改变了CO2水合物的蓄冷储气特性,而在这些THF体系中2%THF体系蓄冷储气性能最好,能够为CO2水合物灭火材料提供工业应用基础。
此研究在分析水合物的形成过程时,划分水合物形成晶体结构,具有一定的局限性,在未来的研究中会进一步通过拉曼光谱分析仪分析水合物晶体结构在水合物形成过程中的变化。但对研究CO2水合物的储气蓄冷特性,为CO2水合物灭火材料研究具有很好的借鉴意义。

