SAFB通过调节Wnt信号通路活性促进结直肠癌增殖
焦红丽,王珺娆,胡敏萱,黄 元,丁彦青,冶亚平
结直肠癌是消化系统常见的恶性肿瘤,病死率较高是导致患者死亡的主要癌症之一[1]。近年来,全球范围内结直肠癌的发病率呈逐年上升趋势,且发病年龄逐渐年轻化[2-3]。支架附着因子B(scaffold attachment factor-B, SAFB)属于核蛋白家族成员,其通过直接或者间接与基因启动子相结合,抑制相关基因转录,同时也是稳定基因组3D结构的重要因素[4],在人体组织中广泛表达。本课题组前期实验结果显示,SAFB与结直肠癌的演进密切相关[5],SAFB低表达可通过SAFB-TAK1-NF-κB信号轴发挥抑制结直肠癌演进的功能,但SAFB是否在结直肠癌的发生,尤其是增殖过程中发挥作用,以及发挥作用的具体分子机制尚不完全清楚。本课题组利用多种体内外实验结合公共数据库分析,着重探讨SAFB对结直肠癌细胞增殖能力的影响,并探讨可能的分子机制,以深化对结直肠癌发生与演进机制的系统化研究,并为临床结直肠癌的诊断与治疗提供参考。
1 材料与方法
1.1 组织样本收集南方医科大学南方医院存档的结直肠癌石蜡标本175例和手术切除的新鲜配对结直肠癌样本50对,配对样本包括肿瘤组织和癌旁正常黏膜组织。所有标本均经病理检查确诊为结直肠癌,所有患者均未接受放、化疗。
1.2 细胞及试剂人结直肠癌细胞株HCT116、SW620、SW480和HCT15,均购自美国ATCC模式生物库;慢病毒包装质粒购自上海吉凯公司;逆转录病毒表达载体pSUPER-retro-puro、慢病毒表达载体psin-EF2-puro及双荧光素酶报告基因质粒为课题组自存。SAFB抗体购自美国Abcam公司;通用型SP试剂盒(SP-9000)、DAB显色剂购自北京中杉金桥生物公司;RT-PCR主要试剂:Trizol购自Invitrogen公司,SYBR GREEN MIX购自日本TOYOBO公司,逆转录试剂盒购自日本TAKARA公司;0.25%胰酶、胎牛血清、DMEM、RPMI-1640培养基、无酚红DMEM培养基,均购自美国Gibco公司。
1.3 双荧光素酶报告基因实验细胞铺板,待细胞长至60%左右汇合度时洗去含血清的培养基,加入预先配好的转染液,37 ℃培养6 h后更换为含10%胎牛血清的完全培养基,转染48 h后,根据双荧光素酶报告基因实验试剂盒说明书检测荧光素酶活性,分析信号通路活性情况。
1.4 稳定细胞株的构建磷酸钙法制备慢病毒、逆转录病毒,建立SAFB过表达、干扰稳定细胞株,将含有重组质粒SAFB/psin-EF2-puro、SAFB shRNA1、SAFB shRNA2及阴性对照质粒psin-EF2-puro、pSUPER-retro-puro、慢病毒包装质粒及逆转录包装质粒的转染液加入产病毒细胞293FT中转染,转染结束24~48 h后,用含1 μg/mL嘌呤霉素的培养基筛选出转染成功阳性细胞克隆,扩大培养,并收集以上细胞株的RNA和蛋白,采用RT-PCR和Western blot法进行鉴定。
1.5 裸鼠皮下成瘤实验细胞用胰酶消化制成单细胞悬液,无血清培养基洗3遍,调整细胞浓度为每毫升1×107个;1 mL注射器吸取细胞液用于裸鼠皮下注射接种,每只裸鼠注射200 μL细胞液(每只约2×106个细胞),每组6只;隔天用游标卡尺测量1次肿瘤体积,肿瘤体积计算公式为体积=长度×宽度×高度/2;处死裸鼠并分离肿瘤组织后,置于10%中性福尔马林中固定,24 h后进行蜡块制作,切片,行HE及免疫组化染色。
1.6 统计学分析采用SPSS 20.0 软件进行数据学分析,采用One-way ANOVA检验分析MTT、平板克隆实验结果数据,检验时需要进行Levene方差齐性检验,若方差齐,采用Fisher方差分析进行整体比较,采用LSD-t检验进行组间多重比较,采用Dunnett法进行多个处理组和一个对照组的比较;若方差不齐,则采用近似F检验Welch法分析进行整体比较,采用DunnettT3检验进行组间多重比较。
2 结果
2.1 结直肠癌组织和癌旁正常黏膜组织中SAFB的表达Oncomine(http://www.oncomine.com)及TCGA数据库(http://gepia.cancer-pku.cn/index.html)检测结果显示,结直肠癌组织中SAFB的表达水平明显低于癌旁正常黏膜组织,且其表达量随着临床分期的增加呈下降趋势(P<0.01,图1A)。基因富集分析(gene set enrichment analysis, GSEA)结果显示,在SAFB低表达组中出现结肠癌相关基因的显著富集(P<0.001,图1B)。RT-PCR检测结果显示,结直肠癌组织中SAFB mRNA表达水平均低于癌旁正常黏膜组织(图1C)。
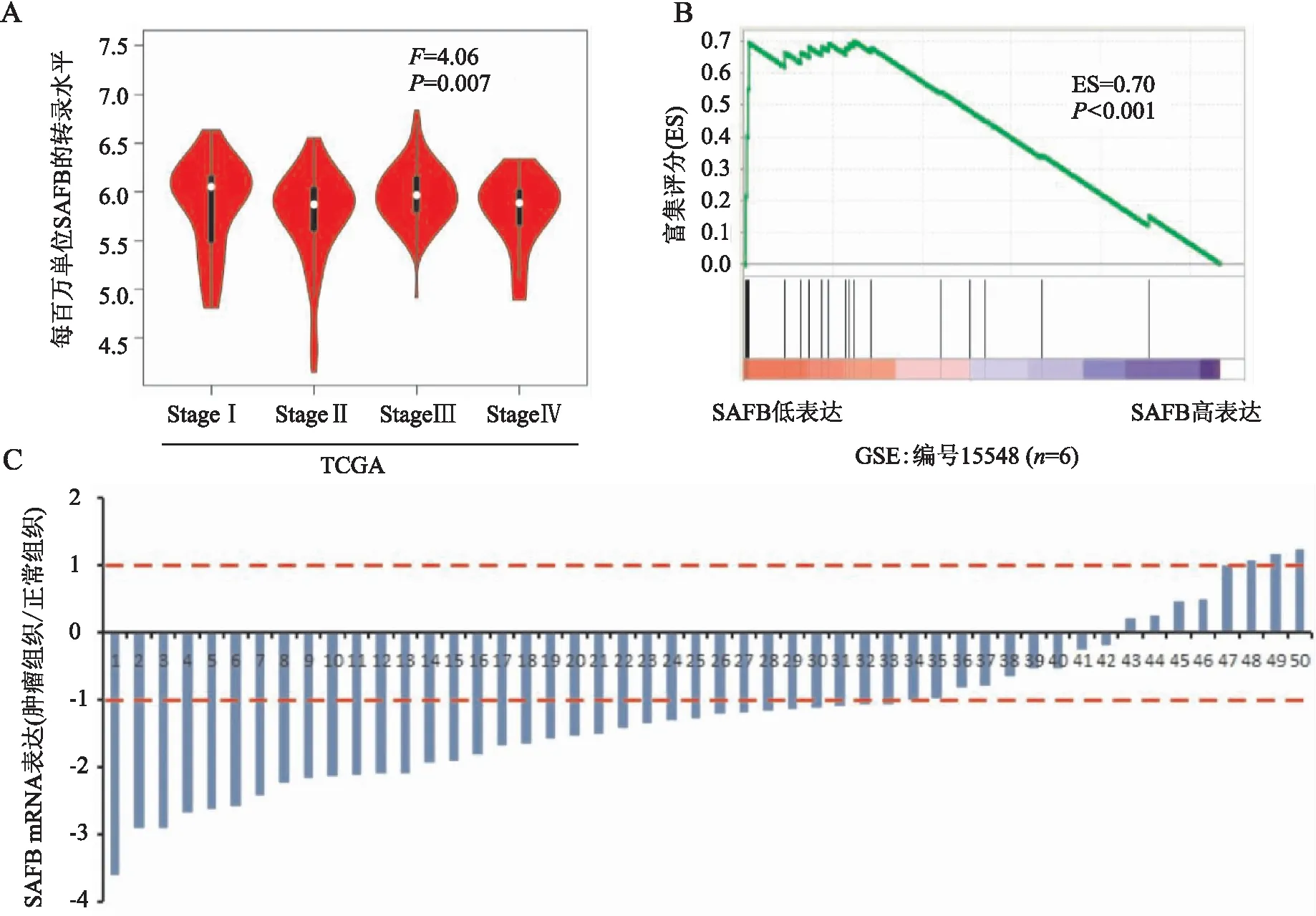
图1 SAFB在结直肠癌组织和癌旁正常黏膜组织中的表达水平:A.TCGA数据库中SAFB表达与结直肠癌临床分期的关系;B.GSEA分析SAFB表达下调后结直肠癌相关基因富集情况;C.RT-PCR定量分析结直肠癌组织和癌旁正常黏膜组织中SAFB mRNA的表达
2.2 不同分期结直肠癌组织和癌旁正常黏膜组织中SAFB的表达免疫组化检测结果显示,SAFB表达主要定位于细胞核,呈棕红色或黄褐色。SAFB蛋白在结直肠癌组织中的表达水平明显低于癌旁正常黏膜组织,并且随着Dukes分期的升高,SAFB的表达水平明显下降(表1,图2)。
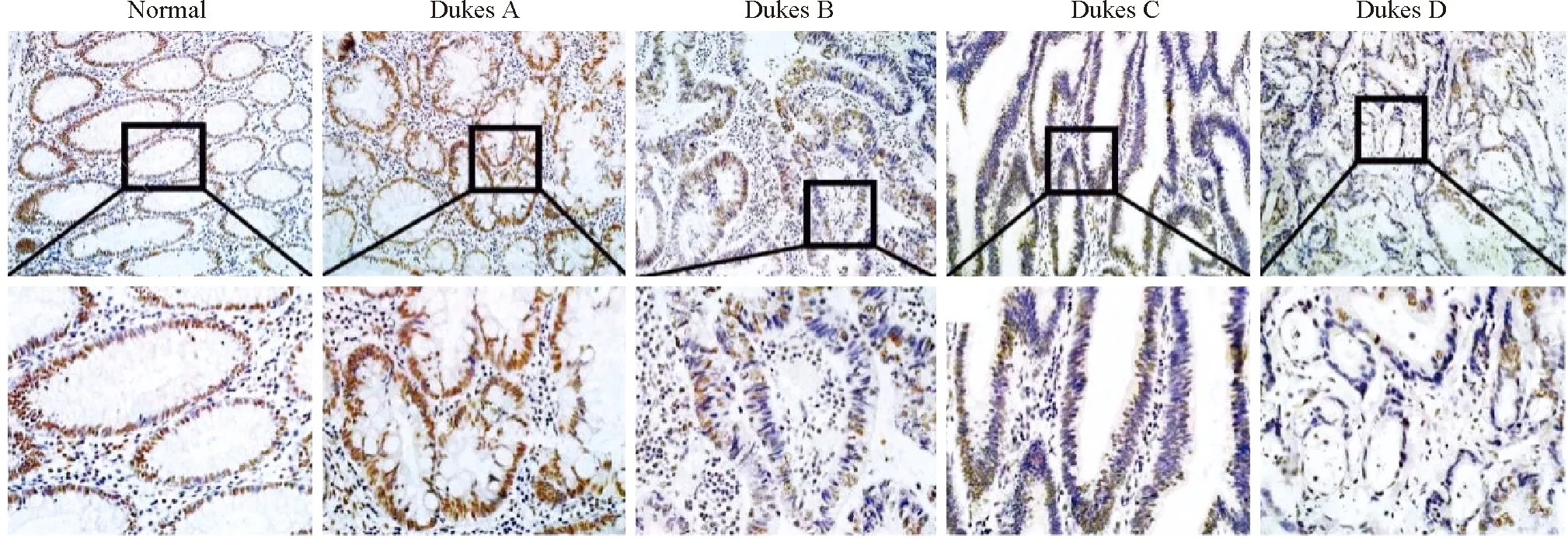
图2 不同分期结直肠癌组织和癌旁正常黏膜组织中SAFB的表达,SP法
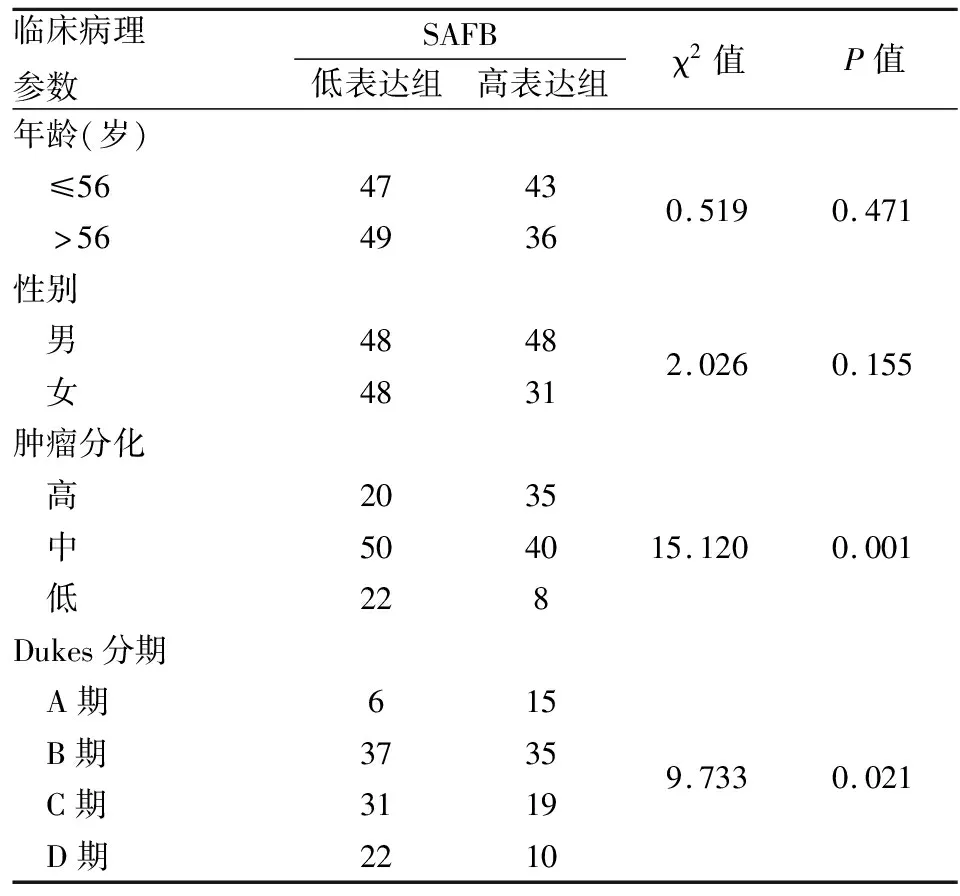
表1 SAFB表达与结直肠癌临床病理特征的关系
2.3 体内、体外过表达SAFB对结直肠癌细胞增殖能力的影响MTT实验、平板克隆实验表明,SAFB过表达可抑制HCT116和SW620细胞的增殖能力(图3)。裸鼠皮下成瘤实验结果显示,SAFB过表达明显抑制肿瘤细胞的生长速度(P<0.01,图4A、B);免疫组化结果显示,SAFB过表达组肿瘤细胞的Ki-67增殖指数明显低于对照组(图4C)。流式细胞检测结果显示,SAFB过表达促进肿瘤细胞的凋亡(图5)。以上体内、体外实验结果证明,SAFB通过促进细胞的凋亡抑制肿瘤的生长和增殖。
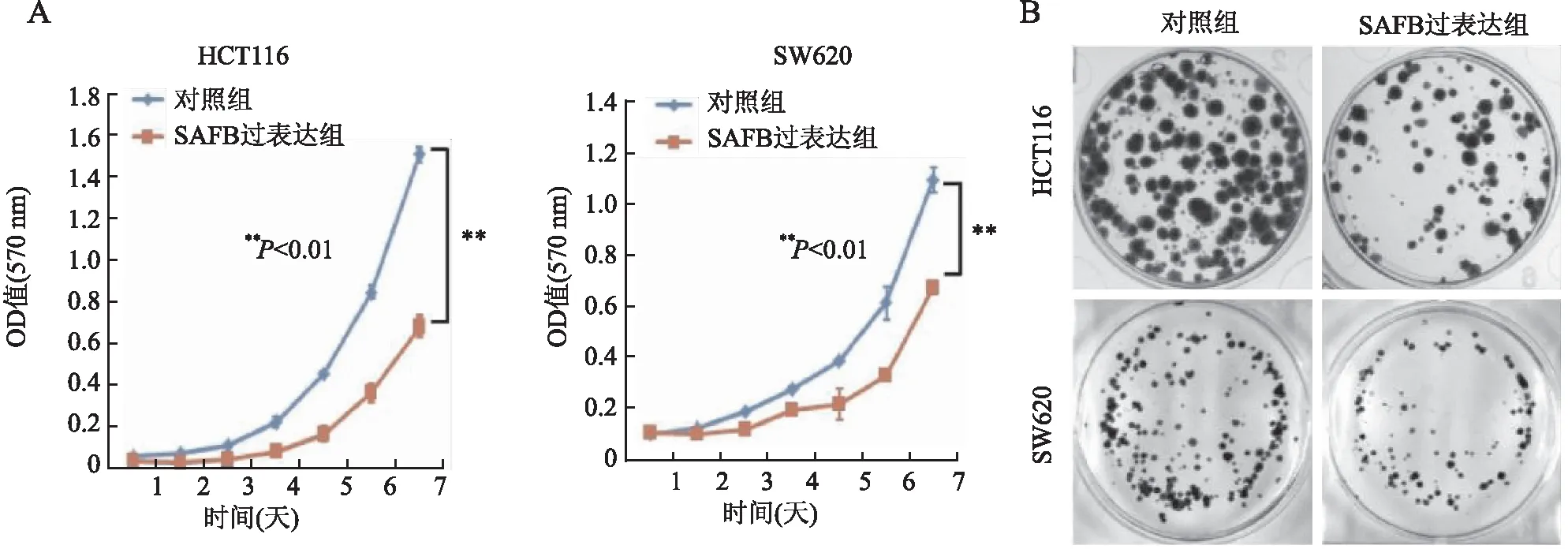
图3 过表达SAFB对体外结直肠癌细胞增殖能力的影响:A.MTT实验;B.平板克隆形成实验

图4 过表达SAFB对体内结直肠癌细胞增殖能力的影响:A.裸鼠皮下瘤;B.皮下瘤增殖速度;C.皮下瘤HE染色与Ki-67增殖指数
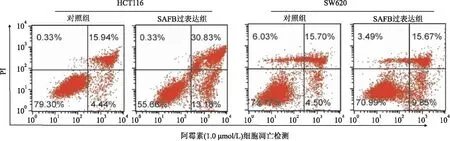
图5 过表达SAFB对细胞凋亡的影响
2.4 体内外干扰SAFB表达对结直肠细胞增殖的影响MTT实验、平板克隆及裸鼠皮下成瘤实验均显示,干扰内源性SAFB表达促进肿瘤细胞的增殖能力(图6、7)。流式细胞检测结果显示,SAFB过表达促进肿瘤细胞的凋亡(图8)。以上体内外实验结果证明,SAFB低表达通过抑制细胞的凋亡促进肿瘤的生长和增殖。

图6 干扰SAFB表达对体外结直肠癌细胞增殖能力的影响:A.MTT实验;B.平板克隆形成实验
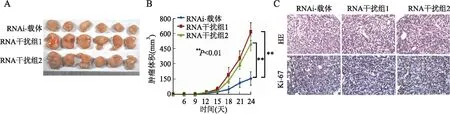
图7 干扰SAFB表达对体内结直肠癌细胞增殖能力的影响:A.裸鼠皮下成瘤大体图;B.皮下瘤增殖速度;C.皮下瘤HE染色与Ki-67增殖指数
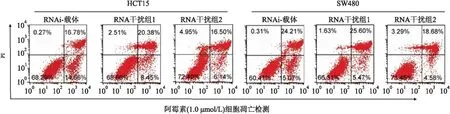
图8 干扰SAFB表达对细胞凋亡的影响
2.5 公共数据库分析SAFB相关信号通路GSEA分析结果显示,在SAFB低表达组中均出现Wnt信号通路相关基因的显著富集(图9)。

图9 GSEA分析SAFB表达下调后相关基因富集情况
2.6 SAFB下调对Wnt信号通路的影响双荧光素酶报告基因实验结果显示,与对照组相比,干扰SAFB表达后Wnt荧光素酶活性升高(P<0.001,图10A)。Western blot结果显示,干扰SAFB表达后,Wnt信号通路下游关键基因Cyclin D1、non-p-β-catenin和LEF1表达明显上调,而p21、p27表达明显下调。相反,过表达SAFB后Cyclin D1、non-p-β-catenin和LEF1表达明显下调,p21、p27表达明显上调(图10B)。免疫荧光染色结果显示,干扰SW480细胞中SAFB表达后,β-catenin入核明显增加(图10C)。以上实验结果证明,SAFB下调后可激活Wnt信号通路。

图10 SAFB表达下调对Wnt信号通路的影响:A.双荧光素酶报告基因实验;B.Western blot法分析Wnt信号通路下游相关基因表达;C.免疫荧光显示β-catenin入核情况
3 讨论
结直肠癌的发生与演进是一个多因素、多步骤的复杂网络调控系统,其常常伴有癌基因的激活、抑癌基因的失活、凋亡调节基因和DNA修复基因的改变等。SAFB是一种在人体组织中广泛表达的核蛋白家族成员,作为一种核基质结合因子,通过N端DNA结合域(SAP/SAF-BOX)和C-端的转录抑制结构直接或者间接与基因启动子相结合,抑制相关基因转录[4]。目前已知SAFB相关的生物学功能主要有:Xist调控的X染色体失活(Xist是X染色体失活的重要lncRNA)、细胞凋亡、DNA损伤反应、细胞应激反应、细胞增殖、RNA转录和加工[4,6-7]等。有研究表明,SAFB的基因改变与乳腺癌、前列腺癌等恶性肿瘤的发生、演进及预后密切相关。SAFB通过抑制雌激素受体α(estrogen receptor alpha, ERα)和雄激素受体(androgen receptor, AR)的表达和活性,对乳腺癌和前列腺癌的发生、发展起重要的抑制作用[8-9]。
本课题组前期实验结果显示,SAFB可以通过直接靶向TAK1抑制NF-κB信号通路的活性,从而抑制结直肠癌的侵袭和转移,同时,实验也发现,SAFB高表达后不仅抑制肿瘤的侵袭能力,同时也显著抑制肿瘤的生长[5]。SAFB抑制肿瘤生长的具体机制、是否与NF-κB信号通路相关及是否有其他相关的分子机制参与的问题,需要我们开展后续的研究深入探究。
通过公共数据库预测并进一步扩大样本量检测,实验发现SAFB在结直肠癌中的表达显著低于正常黏膜组织,且表达水平与肿瘤分期和分化等临床病理特征密切相关,说明其很可能是结直肠癌发生与演进的重要预后标志物。此外,大量的体内外实验证实,SAFB可以明显抑制肿瘤的增殖能力,促进其凋亡,但具体机制仍需深入探究。
Wnt/β-catenin信号能够控制发育、维持干性以及通过调节细胞增殖与分化决定影响成体组织的稳态平衡,该信号通路发生失调与多种肿瘤密切相关[10-11]。90%以上的结直肠癌患者携带Wnt信号途径的体细胞突变,如APC肿瘤抑制基因失活等[12],导致Wnt信号通路的持续性激活。本课题组通过前期生物信息学预测结合双荧光素酶报告基因实验和Wnt信号通路关键蛋白的表达等证实SAFB下调激活Wnt信号通路。免疫荧光检测结果显示SAFB下调可以促进β-catenin入核,表明SAFB低表达可以通过增强Wnt通路活性影响结直肠癌的发生、发展。结合本组前期实验结果,作者认为在结直肠癌中SAFB低表达可以显著影响NF-κB及Wnt等重要肿瘤相关信号通路的活性,NF-κB及Wnt信号通路也可能通过“交叉对话”的方式共同影响肿瘤发生与演进。同时,鉴于SAFB的重要功能,我们可以尝试通过改变细胞内SAFB表达水平或结合相应受体来调控相关信号通路,最终达到肿瘤控制与治疗的目的。
长期以来,抑制RAS的膜结合被认为是一种合理的抗癌治疗方法,因此可以通过应用法尼基转移酶抑制剂进行抗癌治疗。最近有研究表明,SAFB通过控制FNTA(由两种异戊二烯基转移酶共享的亚基)表达促进RAS膜结合。沉默SAFB来降低FNTA的水平,从而使KRAS和NRAS突变细胞对FTI抑制剂更敏感[13],这为我们的研究工作提供了新的思路,当结直肠癌中SAFB表达降低时,应用FTI进行抗癌治疗有望显著提高治疗效果。最近,一项关于黑色素瘤的相关研究表明,肿瘤细胞通过分泌大量的β-catenin阻止T细胞浸润到肿瘤微环境中,从而减弱临床免疫治疗的效果[14]。在结直肠癌的联合免疫治疗中,我们可以尝试通过调节SAFB的表达来改善晚期结直肠癌患者的肿瘤免疫微环境,以期提高联合免疫治疗的效果。
综上所述,SAFB在结直肠癌组织中低表达,SAFB可能通过影响Wnt及NF-κB信号通路活性来影响结直肠癌细胞增殖与侵袭能力,这使得SAFB成为结直肠癌治疗研究中的新目标。深入认识SAFB在结直肠癌发生、发展中的作用,充分了解其作用机制,可以为结直肠癌早期诊断及治疗提供新思路。

