难治性胰腺癌原位疫苗模式治疗后完全缓解
——案例分享及文献复习
崔鹤清,孔炜伟,孔文韬,黎琪,同帆,沙慧子,钱晓萍,刘宝瑞,杜娟(.南京大学医学院附属鼓楼医院肿瘤中心暨南京大学临床肿瘤研究所,江苏 南京 20008;2.南京市胸科医院,南京医科大学附属脑科医院放疗科,江苏 南京 20029;3.南京大学医学院附属鼓楼医院a.彩超室;b病理科,江苏 南京 20008)
胰腺癌是一种常见的消化系统恶性肿瘤。据中国国家癌症中心2020年统计数据[1]显示,在中国,胰腺癌发病率居恶性肿瘤的第11位;病死率更高,排名第6位。有文献[2]预测,到2030年,胰腺癌的病死率将上升为全球恶性肿瘤的第二名。由于该病起病隐匿,大多数患者确诊时已是中晚期,80%的患者无法手术切除;即使做了根治性手术,患者术后5年生存率也不超过25%[3],且将近一半的患者术后1年就出现复发转移[4-5]。本文介绍的是我科收治的1例胰腺癌术后腹腔转移的患者的治疗过程,该患者在胰腺癌根治术后10个月(辅助化疗结束2个月)后出现腹腔转移,予白蛋白结合型紫杉醇+奥沙利铂化疗序贯腹腔淋巴结局部放疗后病情再次进展,腹腔转移病灶再次增大,遂采用原位疫苗模式治疗。腹腔转移病灶局部大剂量分割免疫增敏放疗+OK432瘤内注射+抗PD-1单抗静脉给药,后达到完全缓解,无进展生存期达到16个月。现将该患者的诊治经过分享供临床参考。
1 病例资料
患者,男,64岁,2018年5月14日因“上腹部隐痛2月,查腹部CT见胰头钩突处占位”至鼓楼医院普外科就诊。2018年5月22日在全身麻醉下行胰十二指肠切除术(包括受侵段肠系膜上静脉切除)+肠系膜上静脉重建。术中探查无腹腔播散,术后病理示:胰腺腺癌,中-低分化。肿块大小3 cm×2.5 cm×1.8 cm。癌组织穿透胆管壁,并累及胰腺周围脂肪组织和十二指肠壁浆膜层。脉管内见癌栓,神经见癌组织侵犯。癌组织紧靠标本钩突,标本胆总管切缘、胰腺断端切缘、胃切缘及小肠切缘均未见癌残留。胰周淋巴结11 枚、肠周淋巴结2 枚、胃周淋巴结3 枚均未见癌组织转移。免疫组化检查显示:癌细胞表达HER2(+),COX2(⧺),VEGF(-),VEGFR2(+),c-MET(⧺),EGFR(⧺),Ki67(60%+),P16(-),CD56(散在+),PD-L1(SP142,肿瘤细胞2%,间质细胞10%),PD-1(-);D2-40(脉管+)。临床分期为PT4N0M0Ⅲ期。术后恢复良好。
2018 年8 月9 日至2018 年12 月11 日,该患者在我科行吉西他滨+替吉奥3 周方案化疗6 周期,期间出现Ⅰ度皮疹和Ⅲ度骨髓抑制,对症治疗后好转。2019年1月11日复查CT未见复发转移,遂予口服替吉奥化疗2个周期。
2019 年3 月28 日,患者因无明显诱因下出现上腹部隐痛,无腹胀腹泻,无恶心呕吐,复查CT见腹膜后多发肿大淋巴结,较前片增大。PET/CT 提示腹腔及腹膜后多发大小不等结节、团块影,葡萄糖代谢显著增高,最大SUV 为5.8;腹膜(大网膜和肠系膜)小结节,葡萄糖代谢增高。血清CA125增高至104.6 U/ml。依据上述检查确诊患者出现腹腔转移,遂于2019年4月9日至2020年1月13日行白蛋白结合型紫杉醇+奥沙利铂双周方案化疗7 个周期,并于2019 年8 月底同步行腹膜后肿大淋巴结区域放疗:PGTV 为50 Gy/10f,PTV 为30 Gy/10f。放化疗期间无明显不良反应。期间多次复查CT 疗效评价均为疾病稳定(SD)。血清CA125逐渐下降至36.5 U/mL。
2020年2月25日,复查CT提示腹腔肝胃间隙内软组织病灶较前增大,最大径约42.33 mm(图1A),腹膜后病灶(原放疗区域)稳定,血清肿瘤标志物CA125再次升高至149.1 U/ml,2020年2月26日行彩超引导下腹腔内肝胃间隙占位穿刺活检术,穿刺病理显示:纤维结缔组织内见中-低分化腺癌浸润或转移,结合临床病史考虑胰腺癌浸润或转移(图2A)。病情评价为疾病进展(PD),后行肿瘤组织NGS,结果显示:肿瘤突变负荷为13 Muts/Mb,属于TMB-H;微卫星稳定(MSS),无错配修复缺陷;PD-L1蛋白表达阴性。
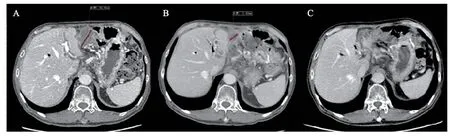
图1 原位疫苗模式治疗前、中、后患者腹腔肝胃间隙内软组织病灶的影像学变化
2020 年2 月25 日,开始皮下注射OK432 制剂0.2 KE/次,1次/周,共2次。2020年3月3日开始行腹腔病灶精准放疗,PTV为24 Gy/3f。放疗结束次日予彩超引导下腹腔内病灶瘤内注射OK432 制剂5 KE。治疗后患者出现血便、黑便2次,考虑应激反应,对症止血支持治疗后好转。2020 年3 月11 日静脉予抗PD-1单抗200 mg。
首次瘤内注射3周后行第2次彩超引导下腹腔内病灶瘤内注射OK432制剂5 KE,同时行腹腔病灶穿刺活检,病理结果显示:(穿刺组织)条索状纤维结缔组织内见少量异形细胞退变和多量坏死(约占90%)(图2B)。治疗过程顺利,次日静脉予抗PD-1单抗200 mg。

图2 原位疫苗模式治疗前、后患者腹腔肝胃间隙内软组织病灶的病理改变
6 周后复查CT,腹腔病灶最大径由治疗前的44.31 mm缩小到21.43 mm(图1B),客观疗效评价为PR。遂予第3 次彩超引导下腹腔内病灶瘤内注射OK432 制剂5 KE,过程顺利,次日静脉予抗PD-1 单抗200 mg。
9 周后,患者来院拟再次行局部治疗,但彩超检查示腹腔病灶已消失,复查CT亦示腹腔病灶完全消失(图1C),血清CA125亦降至正常范围(治疗期间的血清水平CA125变化见图3)。客观疗效评价达完全缓解(CR)。后续仅予静脉抗PD-1单抗维持治疗,血清CA125持续稳定在正常范围,多次复查CT示病情稳定无复发转移。直至2021年6月25日复查PET-CT示腹腔淋巴结较前增大,评价病情进展。患者无进展生存时间达到了16个月。

图3 治疗期间患者血清CA125变化趋势
2 讨论
目前,手术是公认的根治胰胰腺癌的唯一手段,能否R0切除[6]直接决定了患者的预后。全身化疗是晚期胰腺癌患者的主要治疗方法。对于体质状态尚可的患者,目前NCCN 推荐的一线标准治疗方案是FOLFIRINOX(氟尿嘧啶+亚叶酸钙+奥沙利铂+伊立替康)方案或者AG(白蛋白紫杉醇+吉西他滨)[7-8]方案。一线化疗失败后,二线治疗方案的选择不多,而三线治疗没有标准方案。本例患者一线化疗采用的是吉西他滨+替吉奥方案,病情进展后二线治疗采用的是白蛋白紫杉醇+奥沙利铂方案序贯局部放疗,无进展生存期维持了近10个月后病情再次进展。三线治疗前行肿瘤组织NGS测序发现患者系TMB-H,提示免疫治疗可能获益。已有研究[9-10]表明,具有较高肿瘤突变负荷的肿瘤患者接受放疗可以释放更多的新抗原,从而增强全身性免疫效应。因此三线治疗尝试使用了局部大剂量分割免疫增敏放疗联合免疫治疗的“原位疫苗”模式,最终使腹腔转移病灶达到了CR。
“原位疫苗”是指通过物理的方法(如放疗、冷冻消融、射频消融等)将肿瘤组织破坏,使大量抗原从肿瘤细胞这个巨大的“抗原库”中释放出来,联合局部使用免疫佐剂加强DC的抗原提呈,可以促进机体产生肿瘤特异性T细胞,从而诱发系统性抗肿瘤免疫应答。放疗不仅可以引起肿瘤组织DNA结构的机械损伤,还能诱导多种细胞因子和趋化因子的释放,导致炎症反应并改变肿瘤间质的微环境[11]。但单独放疗并不足以改变肿瘤内部免疫抑制微环境所占据的主导地位,难以引发全身性抗肿瘤免疫效应。因此,需要考虑与免疫检查点抑制剂以及其他的免疫佐剂等联合使用,以实现抗肿瘤[12]作用。HAMMERICH等[13]设计了一种结合Flt3L、放射治疗和TLR3激动剂的原位疫苗疗法,临床前研究证实局部放射治疗联合局部注射细胞因子,可以有效递呈抗原、发挥抗肿瘤免疫效应;并且治疗后的肿瘤细胞以及瘤内DC表面PD-L1分子的表达均上调。他们对11名晚期惰性非霍奇金淋巴瘤患者采用了此原位疫苗疗法,发现其与PD-1 单抗有协同抗肿瘤作用。YASMINKARIM 等[14]使用单剂量立体定向放疗(stereotactic body radiation therapy,SBRT)促进肿瘤细胞死亡、释放抗原,联合CD40激动剂瘤内注射活化局部抗原提呈细胞,在小鼠胰腺癌模型中获得了良好的抗肿瘤作用,同时观察到了对侧未治疗部位的肿瘤消退,并且产生了免疫记忆效应。
胰腺癌属于放疗抵抗型的肿瘤,单纯放疗的疗效并不好。组织学上来看,胰腺癌多为导管细胞腺癌,对放疗不敏感;解剖学上看,胰腺位于腹膜后,周围有对放疗耐受剂量低的胃、肠管等器官环绕,使得胰腺能接受的放疗剂量受到限制,因此局控率不理想。随着三维适形放疗、调强放疗、TOMO等先进放疗技术的应用,采用大分割治疗、靶区内部加量的放疗模式后,肿瘤的局控率和患者的生存率均有所提高[15-16]。近年来,人们逐渐认识到放疗与免疫可以产生协同抗肿瘤作用,并对合适的放疗剂量及分次进行了研究。有Meta 分析[17]表明,远位效应与放疗的生物等效剂量有关。BED为60 Gy时,远位效应的发生率可达50%。有研究[18]证实,单次剂量12 Gy 的放疗与免疫治疗结合使用,并不会灭活靶区内免疫效应细胞(T 细胞和NK 细胞),不会对远位效应产生负面影响。在一项基于鼠肺癌模型的研究中[19],采用10 Gy×5次的放疗方案比采用2 Gy×12次方案能产生更强的远位效应。在一项鼠黑色素瘤模型研究[20]中发现,7.5 Gy/次的放射剂量可产生最佳的肿瘤控制和抗肿瘤免疫反应。上述研究都表明,与传统放疗的常规分割照射相比,较高的分割剂量或消融水平的剂量更有利于增强抗肿瘤免疫反应。本例患者三线治疗时采用了原位疫苗模式对腹腔病灶进行大剂量分割免疫增敏放疗24 Gy/3F联合OK432瘤内注射及抗PD-1单抗全身免疫治疗,获得了非常好的效果。
本研究中采用OK432 作为免疫佐剂行瘤内注射。OK432 由溶血性链球菌A 菌株制备成,可以通过激活免疫系统产生抗肿瘤作用。YUKIO KAGEYAMA 等[21]在恶性腹腔积液的免疫治疗研究中发现,提前(第1 天、第7 天)皮下注射小剂量的OK432,随后再(第9 天)腹腔内注射OK432,比单独腹腔内注射OK432 控制恶性腹腔积液的疗效更好。因此,在本例患者的治疗中采用了先皮下注射小剂量的OK432 制剂两次使机体产生预激反应,随后再瘤内注射5.0 KE的OK432制剂以触发机体免疫效应的给药方式,与大剂量分割放疗和静脉PD-1 单抗配合以起到协同增效的作用。
综上所述,由于胰腺癌的特性,单独放疗或免疫治疗往往无法使胰腺癌患者获益。此例难治性胰腺癌患者基因检测结果提示肿瘤突变负荷高,预计免疫治疗有效,因此采用了“原位疫苗”治疗模式。腹腔转移病灶通过SBRT 大剂量分割免疫增敏放疗联合瘤内注射OK432 及静脉抗PD-1 单抗的治疗获得了CR,无进展生存时间明显延长。这为晚期难治性胰腺癌患者及其他难治性恶性肿瘤患者的治疗提供了新思路。本课题组将继续跟踪此例患者的后续随访,并计划对更多合适的难治性胰腺癌患者进行此项治疗,进一步验证该模式的治疗效果和安全性。