炎症标志物对晚期非小细胞肺癌抗PD-1治疗的疗效及安全性的预测作用
何帆,柴荣,周慈航,赵家义,高雪峰,韩一平,(海军军医大学第一附属医院.呼吸与危重症医学科;.全科医学,上海 200433)
全球最新肿瘤流行病学报告显示,肺癌是全球发病率第二、病死率第一的癌种,在我国,肺癌的发病率与病死率均居各癌种榜首[1]。既往Ⅳ期非小细胞肺癌(NSCLC)的5年OS率为1%~8%,免疫检查点抑制剂(ICI)的应用将其提高到16%[2]。ICI可重塑免疫系统的肿瘤杀伤功能,改变了NSCLC的治疗模式,提高了NSCLC 治疗的有效率,显著延长了应答持续时间,该方案已成为驱动基因阴性NSCLC 患者的标准治疗方案。但并非所有患者都能从中获益,NSCLC 对ICI 的应答率仅约20%~50%,且药物的免疫相关不良反应(irAE)也需要关注[3]。鉴于肿瘤-免疫系统相互作用的复杂性,动态变化的肿瘤免疫微环境(TME)以及潜在的irAE风险,探寻预测标志物、筛选免疫治疗获益人群尤为重要。因检测抗体的多样性、肿瘤的异质性、标本获取相对困难等,检测PDL1 的应用价值有限。肿瘤突变负荷(tumor mutation burden,TMB)的检测成本较高,尚无标准界值,也限制了其预测治疗效果的精确性。
肿瘤免疫反应是一个多步骤过程,涉及多个细胞亚群和多种细胞因子,在不同时间和部位发挥作用。已发现中性粒细胞-淋巴细胞比率(neutrophil-tolymphocyte ratio,NLR)和乳酸脱氢酶(LDH)与接受ICI 治疗的NSCLC 患者的生存和预后相关[4-5];血清IL-8 水平的升高是接受抗PD-1 治疗的黑色素瘤和NSCLC患者预后不良的危险因素[6]。此外,炎性标志物与irAE 的发生也显著相关。TARHINI 等[7]研究发现,IL-17 基线水平高,则ICI 引发Ⅲ级免疫相关结肠炎风险增加。为进一步探索炎症标志物在晚期NSCLC 患者抗PD-1 治疗疗效及安全性中的预测作用,本研究通过监测血清炎症标志物的动态变化,旨在预测晚期NSCLC 患者抗PD-1 治疗的疗效及发生irAE风险,筛选抗PD-1治疗最佳患病人群,以指导临床决策,从而提高疗效和改善患者预后。
1 资料与方法
1.1 研究对象
收集2018 年1 月至2020 年12 月在海军军医大学第一附属医院接受抗PD-1治疗的所有无法手术的局部晚期或晚期(ⅢB-Ⅳ期)肺癌患者信息。纳入标准:(1)经组织学或细胞学明确诊断为NSCLC;(2)按国际肺癌TNM分期第8版标准为ⅢB-Ⅳ期;(3)有完整的可查的临床、检验及随访资料;(4)单独或联合使用抗PD-1 治疗。排除标准:(1)患有间质性肺病、慢性炎症性疾病、自身免疫性疾病;(2)合并其他恶性肿瘤;(3)临床资料不完整。
本研究共收集254例接受抗PD-1治疗的肺癌患者,对其中222例符合纳排标准患者数据进行研究分析,随访时间截至2021 年7 月31 日。所有患者均签署知情同意书,本研究方案和流程由长海医院伦理委员会审核批准。
1.2 样本资料的采集及患者炎症指标的测定
从电子住院病案系统中提取患者的一般资料和临床病理特征、检验及治疗记录,收集所有患者在首次抗PD-1治疗前1周内的外周血全血细胞计数及其相关比值和LDH、CRP、IL 等炎症指标作为基线,收集当患者抗PD-1 治疗后首次PR 时、首次PD 时及首次发生irAE 时的炎症指标。部分炎症指标比值计算公式:NLR=ANC/ALC;MLR=AMC/ALC;PLR=PLT/ALC;ANC、AMC、ALC和PLT分别是绝对中性粒细胞、单核细胞、淋巴细胞和血小板的计数。其他临床资料包括:性别、年龄、吸烟史(吸烟状态:终生吸烟<100 支定义为非吸烟者)、肿瘤病理类型、临床分期、PS评分、基因突变状态、PD-L1表达水平、治疗状态、irAE 发生种类与分级、无进展生存期(PFS)和总生存期(OS)。
1.3 临床疗效及irAE的评价方法
抗PD-1 治疗方案包括帕博利珠单抗注射液(pembrolizumab,每3周静脉注射200 mg)、纳武单抗注射液(nivolumab,每2周静脉注射3 mg/kg)、信迪利单抗注射液(sintilimab,每3 周静脉注射200 mg)、卡瑞利珠单抗注射液(camrelizumab,每3 周静脉注射200 mg)、特瑞普利单抗注射液(toripalimab,每2周静脉注射3 mg/kg)、替雷利珠单抗注射液(tislelizumab,每3周静脉注射200 mg),因所有病例为回顾性资料,并非所有患者按照药物标准剂量治疗。部分患者联合治疗方案,联合化疗(培美曲塞、卡铂、长春瑞滨、吉西他滨、紫杉醇、多西他赛等),或联合放疗(外放射、粒子植入等),或联合抗血管药物(贝伐珠单抗、安罗替尼等)。患者每6~8 周行胸部CT 检查评估肺内肿瘤情况,根据实体瘤疗效评价标准(RECIST1.1版本),分为疾病进展(PD)、疾病稳定(SD)、部分缓解(PR)和完全缓解(CR)。PFS定义为从首次抗PD-1治疗到(因任何原因)PD或死亡的时间,OS定义为从首次抗PD-1治疗到患者因任何原因死亡或最后一次随访的时间。从首次抗PD-1 治疗开始到结束,根据美国国家癌症研究所颁发的不良事件通用术语标准4.0版(CTCAE 4.0)对irAE进行分级,并记录其种类、分级及随访情况。
1.4 统计学处理
应用受试者工作特征曲线(ROC)计算炎症标志物的最佳截断值并将其分为高和低水平两组,以Log-Rank 检验和Kaplan-Meier 法分析患者临床病理特征及各炎症标志物水平与患者预后的关系,单因素和多因素Cox 回归分析估算PFS 和OS 的风险比。以Fisher 精确检验分析各炎症标志物基线水平高和低两组与irAE的相关性。以Wilcoxon秩和检验比较治疗前(基线)与首次PR、PD时及发生irAE时各炎症标志物水平的差异。所有数据统计分析均使用统计学软件R 4.0.3 版本,P<0.05 或P<0.01(双侧)定义为差异有统计学意义。
2 结果
2.1 患者的一般资料和临床病理特征
本研究共纳入222 例晚期NSCLC 患者,中位年龄为64(39~87)岁,其中77.9%为男性,既往或现在吸烟者占63.5%。肺腺癌为110 例(49.6%),肺鳞癌为98 例(44.1%),其他类型 的NSCLC 为14 例(6.3%)。超过3/4的患者处于Ⅳ期,其中远处转移部位超过2 处的患者54 例。26 例(11.7%)驱动基因阳性的患者接受了抗PD-1 治疗,只有少数患者(9.5%)PD-L1 高表达。100 例患者接受抗PD-1 治疗作为一线治疗,149名患者接受抗PD-1联合化疗、或放疗、或抗血管药物治疗,70 例患者出现不同程度的irAE。截止2021-07-31,中位PFS 为8.7(0.2~36.6)个月,中位OS为14.2(0.2~42.6)个月,具体见表1。

表1 患者的一般资料和临床病理特征(N=222)
2.2 炎症标志物对患者PFS和OS的预测作用
2.2.1 炎症标志物基线水平的最佳截断值 根据患者的生存状态绘制基线炎症指标ROC曲线(图1),通过约登指数(Youden index)确定NLR、PLR、MLR,LDH,CRP,IL-6、IL-8、IL-10和TNF-α的最佳截断值,分别为3.48、165.57、0.50、210.50 U/L,10.75 mg/L,6.28、118.00、8.67 和11.35 pg/mL。依据各最佳截断值,将炎症标志物相应患者均分为高和低水平两组。
2.2.2 多项标志物基线水平与患者PFS和OS有关联单因素分析结果(表2)显示,病理类型、转移部位数、免疫治疗线数、治疗方案,以及多项标志物NLR、PLR、MLR、LDH、CRP和IL-6基线水平与PFS和OS显著关联(P<0.05或P<0.01);IL-8和TNF-α基线水平与PFS显著关联(P<0.05或P<0.01),而与OS无关联;患者性别、年龄、吸烟史、分期、驱动基因突变、PD-L1表达、irAEs以及IL-10基线水平与PFS和OS均无关联。结果说明,NSCLC中其他病理类型、转移部位≥2、抗PD-1单药、二线及以上治疗等特征会影响患者的PFS和OS,尤其是多项标志物NLR、PLR、MLR、LDH、CRP、IL-6、IL-8和TNF-α的基线水平高预示着患者预后差。多因素分析结果(表3)显示,NSCLC的病理类型和HLR、PLR、LDH等表达线水平是影响患者PSF的危险因素,而HLR、PLR、LDH标志物的基线水平是影响患者OS的危险因素。

表3 临床病理特征和炎症指标与PFS和OS关系的多因素分析
2.3 炎症标志物对疗效PR和PD的预测意义
2.3.1 首次PR 时多个炎症标志物水平明显降低Wilcoxon 秩和检验分析结果(图2)显示,与基线水平相比,首次PR时NLR、LDH、CRP和IL-6水平均显著降低(P<0.05 或P<0.01)。结果表明,炎症标志物NLR、LDH、CRP和IL-6水平随病情好转而下降。

图2 患者首次PR时炎症标志物变化的箱线图
2.3.2 PD时多个炎症标志物水平明显升高 Wilcoxon秩和检验分析结果(图3)显示,与基线水平相比,PD时LDH、CRP、IL-6和TNF-α水平均显著升高(P<0.05或P<0.01)。结果表明,炎症标志物LDH、CRP、IL-6和TNF-α水平随病情进展而升高。
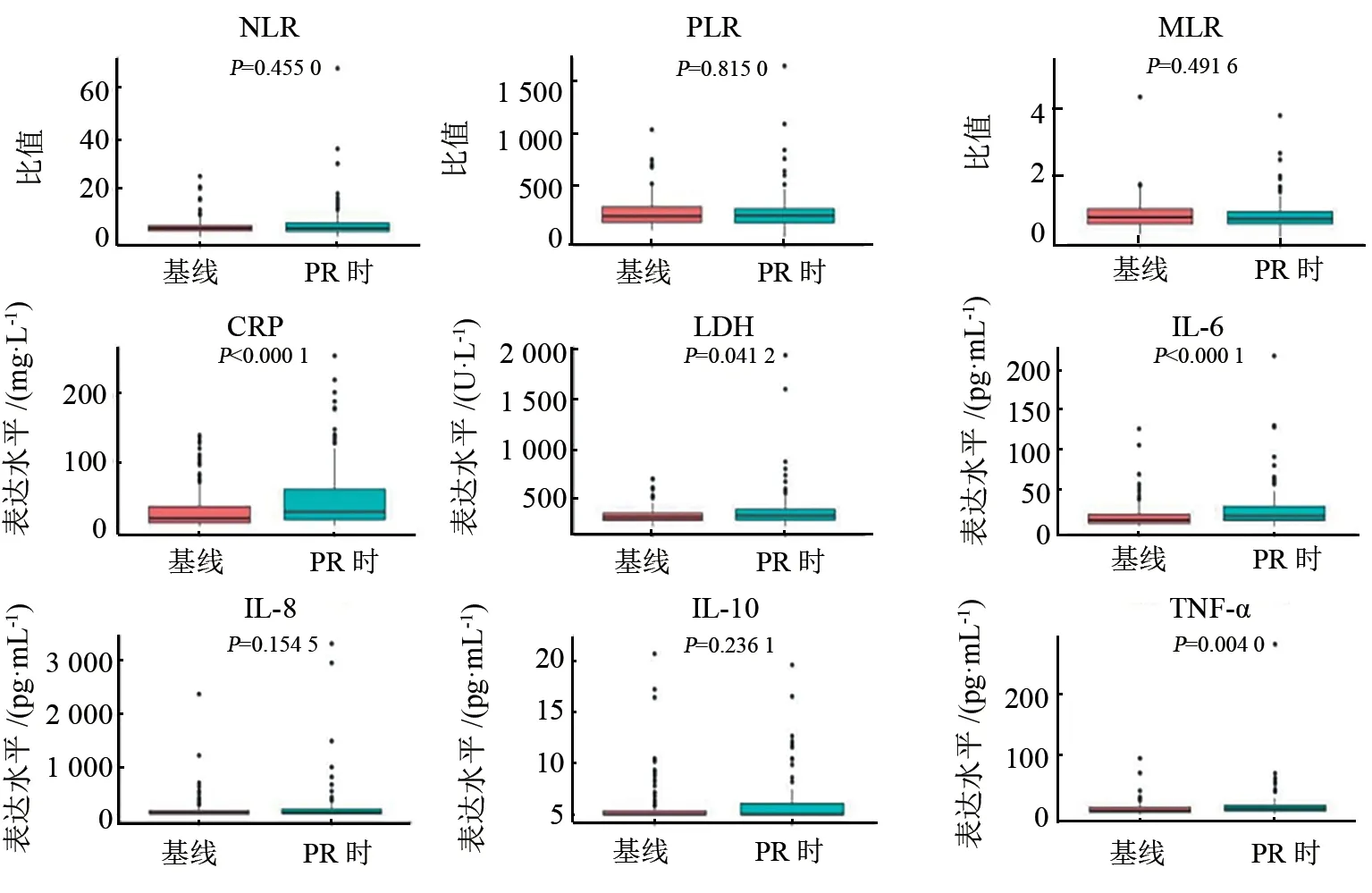
图3 患者PD时炎症标志物变化的箱线图
2.4 炎症标志物对irAE的发生有一定的警示作用
2.4.1 抗PD-1治疗晚期NSCLC时irAE的总体情况 纳入数据分析的222 例患者中,所有等级irAE总发生率为31.53%(70/222),最多见的为免疫相关性皮炎[9.46%(21/222)]、免疫相关性肺炎[9.01%(20/222)]、免疫相关性胃肠炎[3.60%(8/222)]、免疫相关性甲状腺功能减退症[3.15%(7/222)]。发生Ⅲ级及以上irAE的患者13例(5.86%),包括Ⅲ级免疫相关性剥脱性皮炎6例(2.70%)、Ⅲ级免疫相关性肺炎5例(2.25%)和Ⅲ级免疫相关性结肠炎2例(0.90%)。因严重irAE而停药的患者为33例(14.86%)。大多数的irAE经停药、激素及相应对症治疗后好转;有2例(0.90%)Ⅲ级免疫相关性肺炎患者经激素及对症治疗后未好转,加之本身病情较重而死亡。详情见表4。

表4 晚期NSCLC抗PD-1治疗时发生irAE的统计(n)
2.4.2 炎症标志物基线水平的高低与irAE无明显关联 依据ROC最佳截断值将炎症指标分为高和低两组,Fisher 精确检验分析各炎症标志物高和低两组与irAE 的关系,结果(表5)显示,NLR、PLR、MLR、LDH、CRP、IL-6、IL-8、IL-10 和TNF-α 基线水平与irAE 均无明显关联。结果表明,炎症标志物基线水平的高低对irAE的发生无明显影响。

表5 炎症标志物基线水平高低与irAE的关系(n)
2.4.3 发生irAE 时多个炎症标志物水平明显升高 Wilcoxon秩和检验分析结果(图4)显示,与基线水平相比,发生irAE 时LDH、CRP、IL-6、IL-10 和TNF-α水平显著升高(P<0.05或P<0.01)。结果表明,炎症标志物LDH、CRP、IL-6、IL-10 和TNF-α 水平的升高对irAE的发生有警示意义。
3 讨论
ICI 是一种有别于传统抗肿瘤药物的新型治疗,通过调节人体自身免疫改变肿瘤微环境,进而刺激免疫细胞攻击杀伤肿瘤细胞,开启了晚期NSCLC 患者新的管理模式。但有限的应答率及潜在的irAE,迫切需要预测标志物用以筛选抗PD-1治疗最佳患病人群。免疫系统和炎症因子在肿瘤的发生、发展和转移中发挥重要作用。NLR、LDH、IL-6 等作为炎症和肿瘤免疫反应的指标,与NSCLC 免疫治疗预后密切相关。一项Meta 分析包含16 项研究1 700例接受PD-1/PD-L1抑制剂治疗的NSCLC患者,综合结果显示,高NLR 与较短的OS(HR=2.07,P<0.001)和PFS(HR=1.59,P<0.001)显著相关[4]。PLR、LDH升高与PD-1/PD-L1 抑制剂治疗的NSCLC 患者较差的OS 和PFS 相关[5,8],术前MLR 水平是早期NSCLC 患者复发的最佳预测因素[9]。KEEGAN 等[10]报道IL-6水平降低与PD-1 抑制剂治疗47 例NSCLC 患者PFS 改善相关(11vs4个月,P=0.04)。CRP也被发现与nivolumab 治疗的NSCLC 患者预后相关[11]。本研究进一步证实NLR、MLR、PLR、LDH、CRP和IL-6基线水平升高与患者的PFS 和OS 显著缩短有关,且多因素分析结果显示,基线升高的PLR、MLR 和LDH是PFS 和OS 的独立危险因素。此外,NLR、LDH、CRP 和IL-6 水平在患者首次获得PR 时显著降低,LDH、CRP、IL-6 和TNF-α 水平在出现PD 时显著升高。
分析可能的原因:(1)中性粒细胞一方面通过分泌VEGF、IL-6、IL-8等趋化因子和细胞因子直接作用于肿瘤细胞或间接作用于TME 的其他成分,在肿瘤的发生、发展和转移中发挥重要作用[12];另一方面通过抑制淋巴细胞的免疫活性,特别是活化的CD8+T细胞,来抑制抗肿瘤免疫反应[13];淋巴细胞的激活和肿瘤内浸润被认为是抗肿瘤免疫反应发生的必要条件[14],淋巴细胞减少反映了受损的细胞影响了免疫反应。(2)单核细胞刺激癌细胞迁移,抑制抗肿瘤免疫[15]。(3)聚集的血小板通过包裹循环肿瘤细胞来增强肿瘤细胞逃避宿主免疫攻击的能力[16]。(4)LDH 是糖酵解过程中必不可少的酶,催化丙酮酸生成乳酸。高LDH水平可能导致乳酸的产生和细胞外环境的酸化,进而抑制树突状细胞和活化T 细胞释放细胞因子,抑制抗肿瘤免疫反应[17]。(5)IL-6一方面通过诱导调节性T细胞、消耗淋巴细胞等机制发挥免疫抑制作用[18];另一方面通过增加髓源性抑制细胞的募集调节局部TME,从而使癌细胞逃避免疫系统[19]。综上可见,炎症标志物水平升高可使抗肿瘤免疫系统受损,导致NSCLC患者对抗PD-1治疗的反应不佳。
除了炎症标志物,临床病理特征在免疫治疗中也存在一定预测价值。既往报道多器官转移可能是影响肿瘤治疗效果的一个负面因素,一项Meta 分析显示,伴有多器官转移的NSCLC 患者在接受ICI 治疗后出现超进展(hyperprogressive disease,HPD)的风险较高,且与OS较差显著相关[20]。有研究[21]表明,与肺腺癌和鳞癌相比,肺腺鳞癌5 年生存率较低。RUIZ-PATIÑO 等[22]发现免疫治疗作为一线治疗较后线治疗的总体应答率更高。一项Meta 分析表明,与帕博利珠单抗单药治疗相比,联合治疗与改善ORR和PFS 相关[23]。本研究通过分析临床特征与抗PD-1治疗患者预后,结果证实伴有多器官转移、包括肺腺鳞癌的其他类型NSCLC、免疫单药和二线及以上治疗与PFS 和OS 显著缩短相关;此外结果还与CheckMate-057 的亚组分析结果一致,EGFR 突变与抗PD-1治疗的预后无明显相关性[24]。但另一项Meta分析发现,EGFR 突变是二线使用ICI 治疗患者预后不良的危险因素[25],驱动基因阳性患者TKI耐药后的免疫治疗仍需进一步探讨。
ICI 的广泛应用所带来的irAE 已成为临床日益关注的问题。本研究结果显示所有等级irAE发生率为31.53%,最常见于皮炎、肺炎、结肠炎和甲状腺功能减退,irAE的致死率为0.9%,多见发生于免疫相关性肺炎。一项个案报道[26]提示NSCLC患者抗PD-L1治疗后IL-6 和CRP 的升高与irAE 的发生相关。COSTANTINI 等[27]对35 例接受抗PD-1 治疗的晚期NSCLC 患者的血浆进行了多重ELISA 筛查,结果显示高水平的TNF-α 与高级别irAE 相关(P=0.036)。PHILLIPS 等[28]评估了285 例ICI 治疗的实体瘤患者皮肤相关irAE 发生情况,结果发现Ⅲ级及以上irAE与IL-10 增加相关(OR=23.8,95%CI2.1~262.5)。本研究进一步证实了irAE发生时的CRP、IL-6、IL-10和TNF-α 水平较基线显著升高,分析原因可能为:(1)CRP 水平的升高与CD8+T 细胞和Treg 细胞的浸润呈正相关[29],而高度激活的效应T细胞可激活全身炎症反应,从而导致irAE;(2)IL-6在固有免疫和适应性免疫中发挥积极作用,如Th细胞的激活、Treg细胞的抑制、B 细胞的分化等[30],而这些免疫系统的过度活跃与irAE密切相关。综上可见,ICI治疗引起过度免疫风暴,炎症细胞因子分泌增加,这些细胞因子不仅具有较强的促炎活性,还参与了各种自身免疫性疾病的炎症反应。
本研究通过动态监测血清炎症标志物的变化,探索其与晚期NSCLC 患者抗PD-1 治疗疗效及irAE发生的关系,以筛选抗PD-1治疗最佳患病人群,尽早识别并动态监测irAE 的发生发展。在临床实践中,晚期NSCLC患者开始或退出抗PD-1治疗时,临床医师应结合血清炎症标志物的动态变化,在平衡irAE风险与临床获益的基础上制定晚期NSCLC患者个体化治疗的管理决策。本研究作为单中心回顾性研究有一定的局限性,尚需后续前瞻性大样本试验进一步验证。