肿瘤代谢在胶质瘤诊治中的研究进展
李国强综述;张祎年审阅(兰州大学第二医院神经外科,甘肃 兰州 730030)
胶质瘤起源于神经胶质干细胞或祖细胞,是中枢神经系统最常见的致死性原发性肿瘤,占所有脑原发性肿瘤的28%,并占所有脑恶性肿瘤的80%。WHO 依其恶性程度将其分为Ⅰ~Ⅳ级[1]。恶性胶质瘤是以弥漫浸润性、高度侵袭性为特征的一类预后较差的肿瘤。WHO Ⅳ级的胶质母细胞瘤(glioblastoma multiforme,GBM),一经诊断,即使经过手术全切除、术后放、化疗及免疫治疗等手段,其生存期仍不到20 个月[2]。作为难治性肿瘤之一,近20 年来关于胶质母细胞瘤的治疗无突破性进展,患者预后无明显改善[3]。这与肿瘤细胞的无限增殖能力、抵抗细胞死亡、诱导血管生成、激活组织浸润和转移以及回避生长抑制等密切相关[4]。而葡萄糖、氨基酸、核酸以及脂质等代谢物的重编程是肿瘤细胞发生此类变化的重要组成部分[5]。肿瘤发生依赖于细胞代谢的重编程,作为致癌突变的直接和间接后果。癌细胞代谢的一个共同特征是能够使细胞从经常缺乏营养的环境中获取必要的营养,并利用这些营养来维持活力。伴随癌症相关代谢重编程的细胞内外代谢物的改变,对基因表达、细胞分化和肿瘤微环境具有深远的影响,这些改变包括葡萄糖和氨基酸的摄取失调[6-7],糖酵解/三羧酸循环中间体的合成和NADPH 产生[8],氮需求的增加[9],代谢物驱动的基因突变[10],以及与微环境代谢之间的相互作用[11]。目前,随着“精准医疗”研究热度不断升温,代谢组学迅速扩充了精准医疗的范围,推进了胶质瘤代谢研究的发展,对肿瘤的诊断、分级、治疗和预后产生了重要的影响。因此,从肿瘤代谢角度出发,深入研究其调控机制,对胶质瘤的诊断、治疗具有重要意义。
1 肿瘤代谢与胶质瘤的发生发展
代谢在生命活动及疾病发生发展中有特别重要的作用。20 世纪20 年代末,德国生物化学家Otto Warburg 课题组提出瓦博格效应开启了从代谢角度研究肿瘤发生发展的时代。与正常组织相比,肿瘤组织存在明显的代谢异常,包括糖代谢、氨基酸代谢、核苷酸代谢、脂质代谢等[12]。正是这些重要代谢途径的异常激活和重新编程,赋予癌细胞无限增殖潜能和恶性生物学特征。
1.1 IDH突变
异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)参与多个生理过程,与细胞代谢、表观遗传调节、氧化还原和DNA修复密切相关[13]。在细胞质代谢或三羧酸循环中,IDH家族催化异柠檬酸转化为α-酮戊二酸(α-ketoglutaric acid,α-KG),同时将烟酰胺腺嘌呤二核苷磷酸(NADP+)转化为还原NADPH。编码IDH两种亚型(IDH1 和IDH2)的体细胞基因在多种癌症中存在突变,包括神经胶质瘤、急性髓细胞性白血病、胆管癌和软骨肉瘤[14-15]。在胶质瘤中,IDH突变首先在低级别胶质瘤及复发性胶质瘤中被发现[16],由IDH1 的第132 位氨基酸从精氨酸替换为组氨酸(R132H)和IDH2的第172位从精氨酸替换为赖氨酸(R172K)引起的,这种突变显著改变了胶质瘤中IDH的酶活性,导致蛋白质由α-KG转化为2-羟基戊二酸(2-hydroxyglutarate,2-HG),2-HG 的两个异构体与α-KG结构类似,可竞争性地抑制α-KG依赖的双加氧酶家族[17],如5-甲基胞嘧啶,从而改变细胞表观遗传状态,影响细胞正常生物学行为[18-19]。2HG还能降低缺氧诱导因子的表达水平,促进肿瘤的增殖和生长[20]。因此,IDH基因突变状态成为弥漫性胶质瘤最重要的特征之一[21],此外其突变状态也影响胶质瘤患者的治疗及预后,在多种治疗方式,包括常规放疗,替莫唑胺、丙卡巴肼、洛莫司汀和长春新碱单药或多药联合化疗,IDH突变胶质瘤患者的无进展生存率显著高于IDH 野生型的患者,且不受肿瘤分级影响[22]。虽然IDH突变和2HG积累导致细胞癌变的确切机制尚不清楚,但已有研究表明其潜在机制包括抑制缺氧相关的脯氨酸羟化酶,抑制DNA去甲基酶,抑制组蛋白去甲基酶,以及谷氨酸代谢的改变。
尽管对IDH 突变的致癌机制了解甚少,但以IDH1或IDH2酶为靶点的抑制剂已经展开研发,以期抑制2HG 的累积,逆转肿瘤的进展。小分子药物筛选中,抑制IDH1 的G5198 在细胞模型和IDH1 突变异种移植模型中显示出抑制胶质瘤细胞生长的能力。目前,几种IDH 靶向药物:包括针对IDH1 突变的AG-120和IDH305,针对IDH2突变的AG-221以及AG-881 正处于临床试验早期,希望可以给胶质瘤的治疗和改善其预后带来新的措施[23]。从免疫学的角度来看,IDH1(R132H)突变是免疫疗法的潜在靶标,它是一种潜在的具有肿瘤特异性的新抗原,SCHUMACHER[24]等证明,IDH1(R132H)包含适合突变特异性疫苗接种的免疫原性表位。突变区域产生的肽段可以诱导产生特异性CD4(+)TH1免疫反应。因此,特异性突变抗IDH1(R132H)疫苗可能成为一种新的可行的IDH1突变肿瘤的治疗策略[25]。
综上所述,IDH突变作为一种重要的代谢生物学标记,对胶质瘤的分类分级、指导临床治疗、预测肿瘤预后及研究胶质瘤的发病机制和研发治疗药物具有重要意义。如何从IDH突变深入了解肿瘤代谢重编程与细胞恶性生物学行为之间的关系,是目前靶向IDH 研发肿瘤药物治疗的关键问题,探究IDH 突变的详细机制,有望为胶质瘤的治疗提供新的药物靶标。
1.2 糖酵解及乳酸代谢
能量代谢重编程是肿瘤的十大特征之一。肿瘤的多种恶性生物学特性也依赖于能量代谢。在癌症中,糖酵解驱动酶是近年来肿瘤学研究的热点之一。在正常组织中,糖酵解己糖激酶(hexokinase,HK)是糖酵解过程中第一个限速酶,葡萄糖在转运蛋白作用下进入细胞后,可被HK 磷酸化生成葡萄糖-6-磷酸。HK 存在1、2 两种分子亚型,HK1 主要存在于正常脑组织和低级别神经胶质瘤中,在胶质母细胞瘤中,HK2 显著高表达,可促进肿瘤细胞的生长,增强对化疗药物的耐药性,抑制HK2 表达可恢复氧化性葡萄糖代谢,促使能量进入三羧酸循环,并增强细胞对死亡诱导物(如辐射和替莫唑胺)的敏感性[26-27]。磷酸果糖激酶(phosphofructokinase,PFK)是第二个限速酶,参与葡萄糖氧化过程中最重要的限速反应,PFK主要有三种形式:PFKP(主要存在于血小板中)、PFKM(主要存在于肌肉中)和PFKL(主要存在于肝脏中)。PFKP 是胶质母细胞瘤中主要的PFK 异构体,其表达与总PFK活性相关,AKT信号通路的激活可通过S386的磷酸化阻止PFKP泛素化,导致胶质母细胞瘤中PFKP上调,使肿瘤细胞能量代谢进行重编程[28-29]。ZHOU等[30]研究发现,在胶质瘤干细胞中,线粒体膜蛋白电压依赖性阴离子通道2(voltagedependent anion-selective channel2,VDAC2)在线粒体上偶联了糖酵解限速酶PFKP,PFK 抑制剂克霉唑影响VDAC2 对糖酵解重编程和GSC 表型的转化。
目前,对胶质瘤糖酵解的研究已经非常深入,胶质瘤细胞内明显存在葡萄糖代谢异常,使得瘤周环境中乳酸大量堆积,引起肿瘤微环境呈现缺氧、低PH、营养物质缺乏等特点,对胶质瘤细胞的多种生物学行为产生巨大影响,基于胶质瘤的能量代谢特点,生酮饮食(高脂肪、低碳水化合物和低蛋白质),热量限制和禁食所引起的代谢改变,特别是血糖降低和血酮增加,可提高恶性神经胶质瘤动物模型的存活率,并能增强化疗和放疗的抗肿瘤作用[31],或可成为胶质瘤治疗的新策略。
1.3 脂肪酸氧化
脂质合成也是肿瘤代谢异常的重要指标。LIN等[32]发现,从神经胶质瘤组织分离并在无血清条件下培养的原代细胞其生长能力主要依赖脂肪酸氧化(fatty acid oxidation,FAO),抑制FAO 可降低胶质瘤原代细胞的增殖能力,并延长小鼠模型的生存期。JURASZEK 等[33]发现,一种有机阳离子SLC22A5 在胶质瘤细胞中表达上调,并且在不同细胞中表达存在差异。通过对不同SLC22A5表达水平的胶质瘤细胞(U87-MG、LN229、T98G)进行研究,发现FAO 速率与肉碱转运存在相关性。化疗药物(如长春瑞滨和长春新碱)可通过抑制肉碱转运减缓FAO速率,使胶质瘤细胞存活率降低、细胞凋亡率升高。这些观察结果表明,胶质瘤细胞的存活在很大程度上依赖于FAO 的活性。在胶质瘤小鼠模型中,FAO 抑制剂依托莫司在减缓肿瘤生长和延长生存期方面显示出良好的效果[32],这为以脂肪酸代谢为靶点的胶质瘤临床治疗提供了初步依据。此外,有研究发现,神经干细胞促增殖因子酰基辅酶A 结合蛋白在GBM 中高表达,并通过控制长链脂肪酰基-COA 进入线粒体,促进FAO 在GBM 中的表达,从而支持肿瘤的生长,降低动物存活率[34],为有效的抗GBM 增殖代谢管理提供了潜在的治疗策略。
1.4 氨基酸代谢
氨基酸是细胞内部仅次于葡萄糖的重要能量和营养来源,而且也是连接糖、脂质以及核苷酸的中间物质。谷氨酸是被机体摄取最多的氨基酸,参与一系列的生物反应包括能量生成、大分子物质合成以及信号转导,在癌症发生发展中的地位可能仅次于葡萄糖[35]。MCBRAYER等[36]发现,IDH1突变引起的(R)-2HG 累积可能有效抑制了转氨酶BCAT1 和BCAT2,从而降低了谷氨酸水平,并增加了谷胱甘肽的生物合成,影响肿瘤细胞的生存。谷氨酰胺的生理作用是平衡组织对碳、氮的比例,促进谷氨酸进入TCA循环。但在GBM细胞中发现,由谷氨酰胺衍生的谷氨酸超过50%被分泌到细胞外,而不是进入TCA循环[37],抑制谷氨酰胺酶可使IDH突变型胶质瘤细胞在体外对氧化应激和辐射敏感性增强,延长胶质瘤荷瘤小鼠的生存时间。此外,氨基酸还可以通过刺激一系列信号从而激活mTOR,以确保蛋白、核酸以及脂质的合成,使用蛋白组学研究证明mTORC2 使胱氨酸-谷氨酸逆转运蛋白(xCT)N 末端的丝氨酸发生磷酸化,从而抑制xCT 活性。减少mTORC2 表达,或通过药物抑制哺乳动物的mTOR激酶,可促进谷氨酸分泌和胱氨酸吸收,从而将生长因子受体信号传导与氨基酸的吸收利用联系起来,改变肿瘤增殖能力[38],证明了mTORC2 是癌症中氨基酸代谢的关键调控因子。
氨基酸代谢异常可引起肿瘤微环境的变异,氨基酸转运蛋白1(LAT1)在血脑屏障和神经胶质瘤细胞中显著过表达,导致快速且充分的氨基酸转运,引起细胞内外环境之间5'-三磷酸腺苷(ATP)和谷胱甘肽(GSH)水平产生巨大差异[39]。同时,氨基酸代谢可以影响局部免疫逃逸,使用谷氨酰胺拮抗剂JHU083 在荷瘤小鼠中阻滞谷氨酰胺的表达,可以延缓肿瘤生长,改变肿瘤微环境,并促进持久性的高活性抗肿瘤T细胞的产生[40],癌细胞和效应T细胞在提供能量的代谢途径中存在的差异,可能作为癌症的“代谢检查点(metabolic checkpoint)”,在研发新的治疗措施。
2 肿瘤代谢的临床应用
肿瘤代谢生物标志物已广泛应用于胶质瘤临床诊治(表1),并在胶质瘤分类(世卫组织,2016 年、2020 年)和治疗决策中发挥核心作用。代谢标志物已经在胶质瘤分子分型、术前、术中诊断及术后疗效预测等方面展开广泛应用,利用胶质瘤的代谢改变进行诊断成像和治疗已经对患者的预后产生了影响。随着肿瘤代谢研究的进一步深入,探寻关键的“代谢检查点”,研发多种靶向肿瘤代谢的药物,基于代谢重编程的肿瘤治疗策略,可能改善胶质瘤诊疗的有效性,为胶质瘤的治疗开辟新的方向。
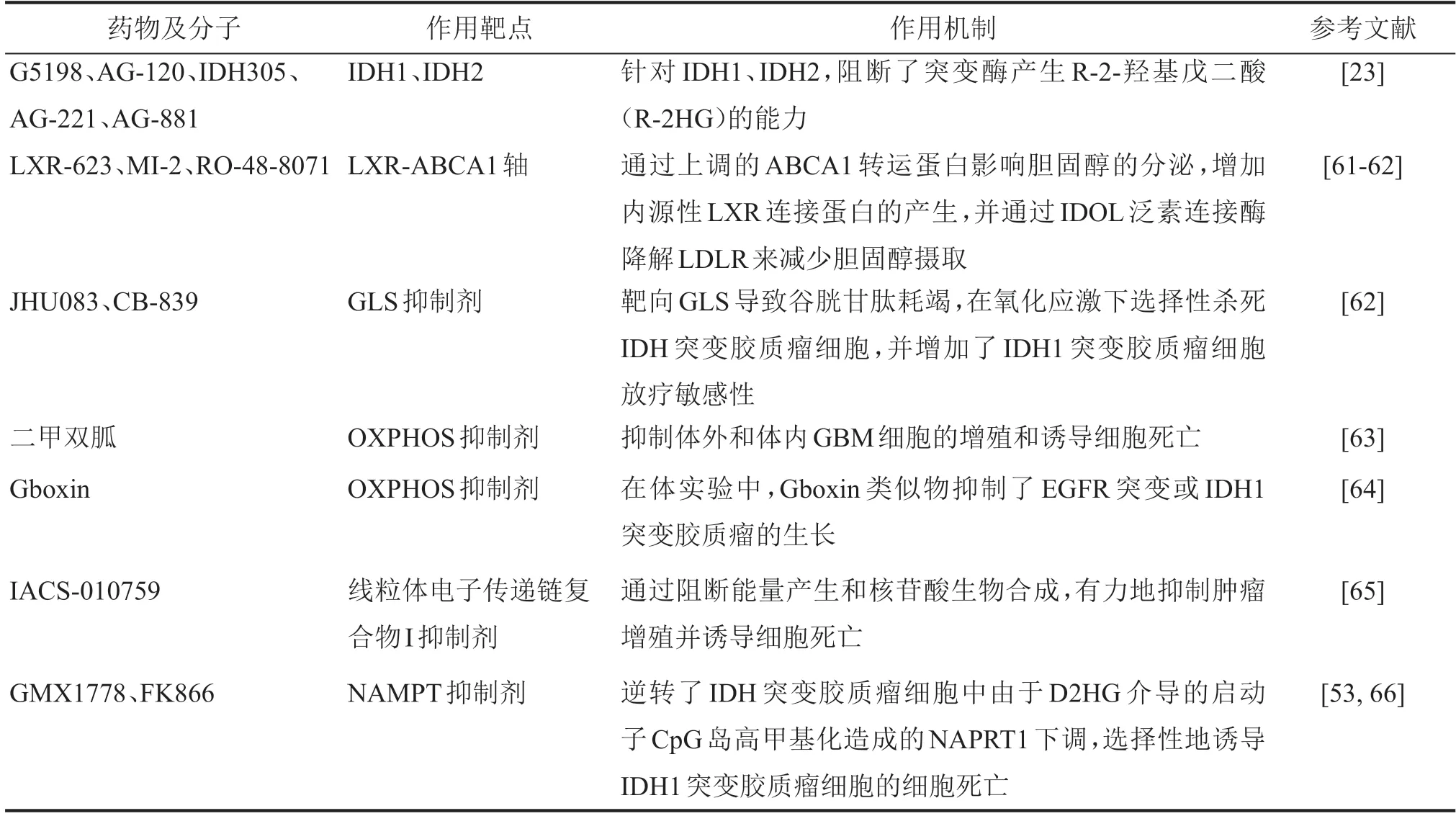
表1 胶质瘤代谢相关药物及其作用机制
2.1 代谢成像
目前,磁共振成像和计算机断层扫描等非侵入性成像技术在胶质瘤临床诊断中具有重要的作用,可以为临床决策提供必要信息。代谢成像有助于在胶质瘤复发阶段识别疾病的假性进展,18F-氟脱氧葡萄糖(18F-fluorodeoxyglucose,18F-FDG)是一种葡萄糖的正电子发射示踪剂类似物,常用于癌症患者的正电子发射型计算机断层显像(positron emission computed tomography,PET)成像。然而,大脑没有多余能量储备,完全依靠血流来供应葡萄糖的特征使18F-FDG PET不能有效区分胶质瘤和正常脑细胞[41]。有研究[42]表明,在实验性神经胶质瘤模型中,与周围脑组织相比,肿瘤组织具有更好的摄取谷氨酰胺类似物放射性示踪剂18F-谷氨酰胺的能力,因此基于氨基酸类似物的PET 成像模式可能代替葡萄糖成像,成为胶质瘤成像的新型手段。此外,在IDH1 和IDH2 突变的胶质瘤肿瘤中,高浓度的2-HG 是区分IDH 突变型和野生型胶质瘤的重要特征。通过磁共振频谱成像,检测颅内2-HG 水平,可以无创地推断胶质瘤的IDH状态。此外,最近的一项研究表明,磁共振频谱成像可通过检测谷氨酸的水平及其来源,监测原位IDH1突变胶质瘤对替莫唑胺治疗的反应,改善IDH 突变的胶质瘤患者的治疗策略[43]。在术前影像学检查中,可通过卷积神经网络[44]和FDG-PET[45]确定胶质瘤的IDH基因型、预测患者预后、评估癌细胞浸润区域,便于规划手术切除及放射治疗面积。有人提出,ATP结合转运蛋白6的表达增加可能导致胶质瘤细胞中原卟啉IX(protoporphyrin IX,PpIX)的积累[46]。虽然PpIX积累的确切机制以及赋予神经胶质瘤细胞代谢优势的详细机制仍有待阐明。但PpIX的荧光发射特性已在临床上用于可视化肿瘤边缘并帮助手术切除[47]。中国华山医院张杰[48]等发现,术中利用3D磁共振频谱成像可有效协助确定代谢边界,保证肿瘤的全切除,华玮等[49]根据2HG 弥散性差的特点,在术中利用质谱检测快速判定IDH基因型,预测手术疗效,有效推动了代谢物快速检测在胶质瘤手术术中诊断的临床应用。
2.2 靶向治疗
靶向IDH1 突变的抑制剂已被批准使用于治疗急性髓系细胞白血病、软骨肉瘤和胆管癌,而在IDH1/2 突变的胶质瘤中其临床疗效尚未得到证实。研究发现,R132H-IDH1抑制剂AGI-5198可以以剂量依赖性方式阻断突变酶产生R-2HG 的能力[23],但用于胶质瘤治疗时,却产生了与放疗之间的矛盾作用,逆转辐射对肿瘤细胞的杀伤作用[50]。新一代IDH1抑制剂AG-120 和AG-881 正在进行Ⅰ期临床试验,在低级别胶质瘤患者中取得了令人鼓舞的结果,特别是,AG-120 似乎对疾病早期阶段的神经胶质瘤更有效[51-52]。在针对2-HG 的研究[53]中发现,2-HG 的表观遗传效应导致编码烟酸磷酸核糖基转移酶的启动子甲基化,使IDH突变细胞对NAD+消耗极为敏感。同时,局部靶向NAD+补救途径可以改变肿瘤免疫微环境并增强GBM的免疫治疗,实现代谢治疗与免疫治疗的完美结合[54]。此外,在胶质瘤临床前模型中,PARP1(poly ADP-ribose polymerase 1)与电离辐射相结合时,辐射可以显著增强PARP1的治疗作用,加速DNA单、双键的恢复,且该治疗作用在低级别胶质瘤中更为显著[55]。
2.3 饮食干预
基于对肿瘤代谢的理解,人们对癌症治疗中饮食干预的研究越来越多,饮食干预的主要目的是剥夺癌细胞生存或增殖所必需的营养和代谢物,适当调整总热量及某种营养素,从而实现抑制肿瘤生长的目的[56]。生酮饮食(ketogenic diet,KD)是一种由低碳水化合物、足够蛋白质及高脂肪组成的饮食方案,模拟机体长时间禁食相关的代谢变化,并用于诱导高水平的β-羟基丁酸、乙酰乙酸和丙酮,同时减少血液中的葡萄糖含量[57]。大量研究已经评估了生酮饮食在胶质瘤的临床前模型的抗癌作用,发现生酮饮食与放射治疗相结合,可减缓脑肿瘤的生长并延长患者的生存期[58]。目前,生酮饮食对胶质瘤治疗的疗效和作用机制仍不确定,可能不仅与血糖降低有关,而且肿瘤微环境中炎症反应的激活具有重要作用[59-60]。此外,生酮饮食的降血糖作用可以通过糖皮质激素负反馈引起血糖升高,这对胶质瘤患者的生存不利[60]。目前,对于饮食干预的研究具有极大的局限性,因为细胞培养基不能正确反映癌细胞在体内的真实环境;其次,饮食干预不可能仅仅局限于肿瘤本身,还可能对机体产生其他影响,例如降低免疫反应,改变全身能量稳态,加速恶病质的进程。因此,需要深入了解饮食与癌症、微环境和全身代谢之间复杂的相互作用,才能使饮食干预最大限度地发挥治疗效果。
3 结论与展望
肿瘤细胞的代谢异常是由于细胞基因改变引起的表观遗传的变化,贯穿于肿瘤发生发展的全过程,代谢重编程导致多种产物的累积、缺失,不仅影响肿瘤细胞本身的变化,加速了肿瘤细胞的发生发展,而且对肿瘤微环境产生巨大影响,抑制了正常机体的免疫排斥反应。目前,肿瘤代谢的研究再起波澜,REINFELD 等[67]研究分析了肿瘤微环境中使用营养物质的偏好性,发现喜欢摄取葡萄糖的是髓系细胞,而癌细胞偏向于摄取谷氨酰胺。研究发现,癌细胞能够通过摄取和代谢谷氨酰胺,显著地抑制葡萄糖代谢和免疫细胞的肿瘤浸润。这一发现是对固有认知的颠覆,说明了代谢的错综复杂。因此深入探索肿瘤代谢重编程的机制,了解其复杂的信号调控网络,干预肿瘤细胞代谢异常的环节,调控异常的肿瘤细胞代谢,可能是胶质瘤预防、诊断、治疗及防复发转移的新方向。
寻找新型代谢检查点,探索抗肿瘤的新药靶标,纠正肿瘤细胞的异常代谢,可能阻止正常细胞向恶性转化的进程,减缓肿瘤无限裂变的速率,加快肿瘤细胞凋亡,希望有效改善临床肿瘤疗效,提高患者的生存质量。但目前相关的研究和报道仍较少,肿瘤代谢与胶质瘤之间的机制尚不明确,阐明肿瘤细胞代谢异常与肿瘤发生发展的关系、并以此为基础研发更为有效的肿瘤治疗方法和抗肿瘤药物仍任重而道远。