CyHV-2毒株CNDF-TB2015保存条件与增殖特征研究
文/朱悦 蔺凌云 潘晓艺 巩金鹏 姚嘉赟 沈锦玉
鲤疱疹病毒II型(Cyprinid herpesvirus 2,CyHV-2)是危害鲤科鱼类的主要病原之一,主要宿主是金鱼()、鲫鱼()及其普通变种,2016年被列入《国家水生动物疫病监测计划》。
CyHV-2最早于1992年在日本观赏金鱼中发现,是第二个从鲤科鱼类分离出来的疱疹病毒,因此被命名为鲤疱疹病毒II型。随后在中国台湾、澳大利亚、美国、英国的养殖金鱼中相继发现。2011年,匈牙利首次在养殖的银鲫体内检测到CyHV-2,随后,CyHV-2感染银鲫的报道逐渐增多,Wang等在2012年首次报道了CyHV-2感染我国内地异育银鲫。此病原引发的病情进展迅速,死亡率高达90%~100%,给鲫鱼养殖造成了重大损失。
病毒的细胞培养分离技术是世界动物卫生组织(OIE)推荐的检测鱼类病毒的首选方法。然而,CyHV-2在现有鱼类常用细胞系中难以进行传代,胖头鲤细胞(fathead minnow cells,FHM)、草鱼肾细胞(grass carp kidney,CIK)、草鱼卵巢细胞(grass carp ovary,CO)、鲤鱼上皮瘤细胞(epithelioma popuasum cuprini,EPC)均对CyHV-2不敏感,仅锦鲤鳍细胞(koi fin 1,KF-1)能产生致细胞病变效应(CPE),但病毒在KF-1细胞中传至第3代~5代后,致细胞病变效应消失且病毒核酸PCR检测也呈阴性。2013年Ito等采用金鱼鳍细胞系(goldfish fin,GFF)和standard Ryukin Takafumi(SRTF)细胞系成功实现了对CyHV-2进行持续传代,浸泡感染结果发现25℃条件下致死率显著高于20℃水温,并且肾脏是该病毒的最主要复制组织。而魏钰娟等建立的异育银鲫脊髓组织细胞系(Spinal cord tissue cell lines of,CSC),也实现了对CyHV-2持续传代,并且传代毒呈现高病毒滴度。
虽然经过国内外学者的努力,实现了CyHV-2的细胞传代,但对该病毒的增殖特征和不同保存条件下活力的衰减报道较少。因此,本研究将针对CyHV-2毒株CNDF-TB2015的培养条件及其在细胞系CSC和鲫鱼体内的增殖特征与病毒的保存条件进行研究,为CyHV-2的生物学特性提供研究基础数据。
一、材料与方法
(一)实验材料
实验用异育银鲫(体重约150g/尾)来自浙江省淡水水产研究所试验基地,经检测CyHV-2阴性;异育银鲫脊髓组织细胞系CSC、CyHV-2-毒株CNDF-TB2015毒株由本实验室保存。
另备有L-15培养基、青霉素/链霉素、磷酸缓冲盐溶液(PBS)、胰蛋白酶-EDTA、胎牛血清、DNA核酸提取试剂、Taq DNA聚合酶、dNTPs、T载体、T25细胞培养瓶、移液管等。
(二)培养条件的优化
1.吸附时长对病毒培养的影响
将浓度为10TCID/mL的细胞培养病毒液按0.5mL/瓶的量分别接种12瓶T25细胞瓶的CSC细胞中,置于24℃孵育不同时间,按不同孵育时间(20min、40min、60min和80min)分4组,每组3瓶。孵育完成后进行细胞观察,去除病毒液后加入维持液放置于培养箱,24℃培养,每日观察细胞病变情况。
2.温度对病毒培养的影响
将接种病毒后的CSC细胞,分别放置于16℃、24℃和30℃条件下进行培养,定期进行细胞病变观察。
(三)不同保存温度条件下病毒活力测定
将浓度为10TCID/mL的新鲜CNDF-TB2015病毒液分别保存于4℃、-20℃、-80℃及液氮(-196℃)中,每隔一周将保存的病毒液重新感染CSC细胞,每日显微镜观察细胞病变情况。
(四)在CSC细胞中的增殖特征
将浓度10TCID/mL的CNDFTB2015毒株接种至状态良好的CSC细胞中,在第6h、9h、12h、24h、48h、60h、72h、96h、120h和142h进行细胞样品的收集,并在各时间点进行细胞病变观察。对采集的样品按Reed-Muench法测定TCID,并采用DNA提取试剂盒提取细胞培养物冻融液DNA,采用TaqMan-qPCR法,以含靶标片段的质粒为标准品,进行病毒拷贝数的测定。
(五)在鱼体内的增殖特征
对健康鲫鱼采用浓度为10TCID/mL的病毒液进行腹腔注射攻毒,攻毒剂量0.2mL/尾,设三个攻毒组(12尾/组),同时设立三个对照平行组(12尾/组)注射相同体积的生理盐水,于24℃循环水中养殖。攻毒前和攻毒后7d内每天取脾、肾组织,并提取总DNA,采用qPCR法检测组织中的病毒含量变化。
二、结果
(一)病毒培养条件
CyHV-2在24℃下孵育20min、40min后病变情况基本一致,第4d开始病变,细胞脱落,出现空斑,第7d病变80%。病毒孵育60min后就出现少量细胞脱落的现象,而病毒孵育80min后细胞全部脱落。因此,CyHV-2的孵育时长宜控制在20min~40min,利于细胞病变的观察。
加入维持液后,各培养温度下3d内细胞均无脱落现象,观察至第7d,16℃下细胞未出现病变,24℃下细胞出现变圆、脱落、融合、裂解并形成空斑等病变,病变区占总面积达80%左右,而30℃时第7d病变面积达50%左右。不同温度下病毒感染第7d细胞病变如图1所示,根据不同温度下细胞病变情况,说明CyHV-2病毒的最佳培养温度为24℃。

图1 病毒感染第7a细胞病变a:16℃;b:24℃;c:30℃
(二)病毒的保存温度
将不同温度下保存不同时间的CNDF-TB2015病毒培养液(10TCID/mL)接种CSC细胞,出现病变的时间和病变程度呈现差异(见表1)。病毒液在4℃和-80℃保存21d内、液氮(-196℃)中保存168d内,接种CSC细胞后8d内都可以出现80%以上的病变,而在-20℃保存7d的病毒液,接种CSC细胞后未出现细胞病变;在-80℃条件下随着保存时间的增加,病毒毒力逐渐减弱;但在液氮中保存的病毒毒力168d内基本不变。

表1 保存温度对病毒毒力的影响
(三)CyHV-2在CSC细胞中的增殖特征
由图2可以看出,相比正常CSC细胞,该病毒感染CSC细胞24h后,部分细胞聚集,48h后小部分细胞脱落出现空斑,72h后细胞持续聚集,空斑增多,96h后细胞空斑变大,细胞碎片增多,初步形成网状,120h后细胞聚集融合脱落,网状面积扩大。

图2 病毒感染细胞后病变情况
对各时间点收集的病毒液进行滴度测定,由图3可见,CNDF-TB2015毒株感染CSC细胞后,6h病毒已开始复制,但感染滴度较低;9h~12h病毒滴度缓慢增加;12h~24h病毒进入对数增长期,滴度急剧上升;24h后病毒增殖速度减缓,至96h病毒滴度达到最高值10TCID/mL;96h~120h病毒增殖进入平台期,病毒滴度维持在较高水平;142h时病毒液的感染滴度开始下降。
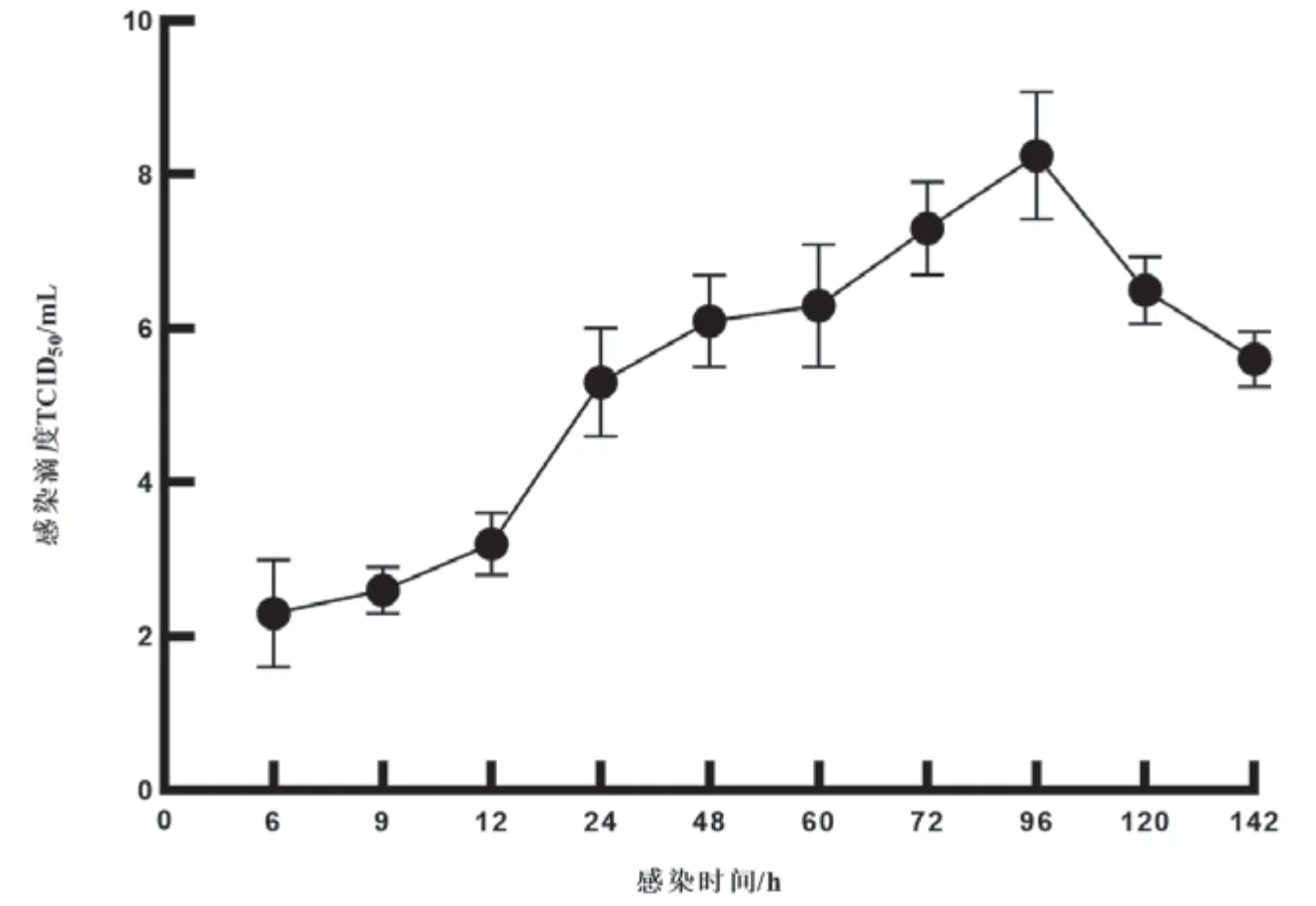
图3 病毒增殖曲线

同时测得各时间点的病毒拷贝数,由图4可知,6h~12h病毒复制水平较低;12h~24h病毒拷贝数急剧增长;24h~48h缓慢上升,48h~72h又表现出明显上升;96h时到达峰值,病毒拷贝数达7.5×10copies/μg;此后病毒拷贝数随时间增加逐渐下降。由此可见,CNDF-TB2015毒株的拷贝数与其滴度的变化趋势基本一致。

图4 病毒载量随时间变化的曲线
(四)CyHV-2在鱼体内的增殖情况
CNDF-TB2015毒株感染鲫鱼后,每隔24h取3尾鱼的脾、肾组织,提取DNA并用qPCR检测其病毒拷贝数,测得脾脏和肾脏组织中病毒载量变化见图5。感染后第3d,病毒在鱼体内迅速增殖,病毒载量较高,维持在3×10copies/μg~1.8×10copies/μg,且脾脏组织中的病毒载量高于肾脏组织。脾、肾组织的病毒载量分别于第2d和第3d达到最高值,分别为1.8×10copies/μg、4.4×10copies/μg,此后均逐渐下降,第7d病毒载量分别降至9.2×10copies/μg、2.2×10copies/μg。试验期间,感染鱼未发生死亡,在第3d开始部分试验鱼出现胸鳍出血症状,已进行采样检测。

图5 脾脏、肾脏中病毒含量的变化
三、讨论
(一)病毒培养条件
体外培养条件极大地影响病毒,对病毒培养条件的优化及对病变特性的了解,将有助于提高病毒分离的成功率和病毒的产量,对鲫鱼疱疹病毒病的诊断、流行病学调查和CyHV-2细胞灭活疫苗制备具有重要意义。
本研究将CyHV-2毒株CNDFTB2015接种异育银鲫脊髓组织细胞系(CSC),观察了在不同孵育时间和培养温度下,CSC细胞的病变发生情况,确定了该毒株的适宜培养条件即孵育时间为20min~40min,培养温度为24℃。该毒株培养7d后,16℃无病变,24℃病变80%以上,30℃病变率约50%,这与已报道的CyHV-2的体外培养温度基本一致。Shibata等利用RyuF-2细胞系培养CyHV-2,发现30℃和32℃条件下,病毒滴度明显低于20℃和25℃,且25℃条件下,病毒滴度最高且增长最快,但培养温度为34℃或更高时,病毒不能增殖。Ma等建立的异育银鲫脑组织细胞系GiCB和Lu建立的异育银鲫尾鳍细胞系GiCF,均实现了CyHV-2的传代培养,培养温度分别为28℃和25℃。可见,CyHV-2在体外的培养温度与鲫鱼造血器官坏死病的流行温度基本相符,该病在20℃~25℃最为严重,超过30℃或低于10℃,该病较少发生。另外,本研究中病毒吸附时间超过60min,出现了细胞脱落的现象,这可能与病变细胞裂解液中存在细胞毒性物质有关。
(二)病毒保存条件
保存温度和时间是影响病毒感染力的重要因素,本文将收获的同批次病毒液进行分装后,储存于不同温度条件下,定时复苏,观察试验样本感染后的细胞病变情况。结果表明,该病毒在-196℃下(即液氮中)保存效果最好;-80℃下保存时间超过21d,CPE的出现时间发生延迟;4℃仅适用于病毒的短期保存,且存放时间不得超过21d;-20℃条件下,病毒的感染力下降最快,保存7d后对CSC细胞丧失感染力,可能该温度下病毒囊膜蛋白结构不稳定,导致病毒囊膜破裂缺失,最终造成病毒不能通过膜内吞或融合的方式感染细胞。Shibata等的研究亦表明,CyHV-2病毒液在4℃和-80℃条件下保存,7d内病毒的感染力保持相对稳定,而-25℃条件下,7d内病毒滴度急剧下降。其它具囊膜的病毒也有类似特征,如国内学者对不同保存温度下伪狂犬病毒病毒液的滴度进行比较,发现-20℃保存的病毒滴度下降最快,-70℃及-80℃下,30d内伪狂犬病毒的滴度相对稳定,短期内4℃的保存效果好于-20℃。李莹莹等将含CCB细胞的KHV病毒液在不同温度条件下保存90d后,测定病毒滴度,结果显示4℃及-20℃保存的病毒感染力分别下降61%和50%,而于-80℃及液氮中保存的病毒感染力仅下降7%。一般情况下,保存温度越低,病毒的滴度变化越小,但随着保存时间的延长,病毒滴度伴随发生不同程度的下降。明确保存条件对CyHV-2感染力的具体影响,将对CyHV-2的研究工作具有指导意义。
(三)病毒增殖特征
本文分别基于TCID和拷贝数绘制了CNDF-TB2015毒株在CSC细胞上的增殖曲线,两条增殖曲线变化趋势基本一致。该毒株感染CSC细胞后12h内为病毒缓慢增长期,12h~96h为对数增长期,96h~120h为平台期,120h后开始衰亡。对病毒在宿主细胞内的增殖情况和病毒感染动力学的了解,可为病毒培养的最佳收获时间提供依据。
TCID体现的是具有感染活力的病毒粒子数量,而荧光定量PCR法结果反映的是病毒基因组的拷贝数,这其中就包含一些未完成包装的病毒。在细胞感染后期,特别是120h后,病毒拷贝数下降速率与TCID基本一致,但TCID下降幅度更大,这也与具囊膜病毒稳定性低、DNA不易降解的情况一致。
Wu等和Ito等的研究均表明,脾和肾脏是CyHV-2感染和复制的主要靶器官,因此本研究选择脾和肾脏组织进行病毒在宿主体内增殖规律的研究材料。水温(25±1)℃,采用亚致死剂量(0.1LD,数据未发表)CNDF-TB2015毒株进行感染试验,此时CyHV-2在鱼体内为急性感染类型,前4d病毒复制水平较高,脾、肾组织中的病毒载量急剧增加。4d后,病毒开始被激活的宿主免疫系统清除,载量迅速降低,检测结束时(第7d),鱼体中的病毒载量相比最高值,下降了4个数量级。潜伏感染是疱疹病毒的一个显著特征,CyHV-2的潜伏感染也已被证实。本感染条件下,CyHV-2在鱼体内经历了急性感染期,病毒含量急剧上升后迅速下降,7d后病毒是否继续降低,直至被完全清除,亦或在鱼体中转为潜伏感染,仍有待进一步研究。
四、结论
本研究利用CSC细胞培养CyHV-2毒株CNDF-TB2015,优化了该毒株的培养条件,确定了病毒吸附最佳时长为20min~40min,病毒培养最适宜温度为24℃。测定了不同保存条件下,CNDF-TB2015病毒液的感染力变化情况,并对该毒株在体外组织细胞和鱼体内的增殖特征进行了研究,结果表明,在4℃保存21d和-80℃保存168d,病毒还保存较高毒力,长期需保存于液氮中,病毒不适合保存在-20℃。这为CyHV-2的分离培养、保存及细胞灭活疫苗的制备提供科学依据,对CyHV-2生物学特性、致病机理的研究和鲫鱼造血器官坏死病的防治具有参考价值。

