SIRT1在代谢相关脂肪性肝病中的作用及其运动的改善效应
贾蒙蒙,陈海春,张赐东
(1.运动与健康福建省高校重点实验室,福建师范大学体育与科学学院,福建 福州 350117;2.龙岩学院体育与健康学院,福建 龙岩 364012)
非酒精性脂肪肝(nonalcoholic fatty liver,NAFLD)是最常见的慢性肝病,在当今肥胖大流行的背景下,其发病率在全球范围内持续飙升[1].NAFLD是一个广义的术语,用于涵盖不同严重程度的 “疾病进展谱”,从肝脏甘油三酯(triglyceride,TG)过多积累的肝脏脂肪变性,再到非酒精性脂肪肝炎(nonalcoholic steatohepatitis,NASH)、肝脏纤维化、肝硬化和肝癌[2].传统意义上,“NAFLD”这个“名称”更侧重于“酒精”,可能忽视了“代谢相关危险因素”,因此不少专家认为“NAFLD”这个名称并不是一个合适的“术语”[3].为了应对这种情况,2020年初,以澳大利亚悉尼大学Jacob George教授牵头的国际专家小组提出将“NAFLD”重新命名为“代谢相关脂肪性肝病”(metabolic associated fatty liver disease,MAFLD),目前已达成国际共识[4-5].相对于“NAFLD”“MAFLD” 的诊断更注重于代谢紊乱, 要求在原有诊断脂肪肝的基础上(肝脏活检、血液生物标志物、影像学检查),需要同时存在超重/肥胖、2型糖尿病、代谢功能障碍3项中的1项.
一般情况下,高热量饮食和久坐的生活方式是MAFLD 的重要诱导因素.MAFLD是代谢综合征的肝脏表现,改变生活方式可消除肝脏脂肪变性、NASH以及改善肝脏纤维化[6].目前,并没有规范的药物可以阻止脂肪变性向 NASH 的进展.运动被认为是防治MAFLD最经济、安全、有效的策略,事实上,许多临床试验已经证明了运动的功效[7-9].运动改善 MAFLD的分子机制仍有待确定,但可以确定的是运动可以增加机体的能量消耗,并激活与能量代谢相关的信号通路.SIRT1是一种能量感受器,将环境、营养信号与代谢稳态联系起来,参与调节代谢和压力相关的生理反应[10-11].运动可以激活这个能量感受器,通过去乙酰化一些转录因子和调节蛋白来抑制脂肪性肝病的进展.因此本文从运动和SIRT1入手,阐述运动以及SIRT1在调节肝脏脂质代谢、氧化应激(oxidative stress,OS)和炎症等方面的生物学作用,并深入讨论运动和SIRT1作为治疗MAFLD的分子机制,为运动防治MAFLD提供充足的理论依据.
1 SIRT1概述
沉默信息调节因子2(silent information regulator 2,Sir2)是在酵母中发现的一种组蛋白去乙酰化酶(histone deacetylase,HDAC),Sir2相关酶(sirtuins,Sirt)是Sir2的哺乳动物同源物.因其能够增加酵母、苍蝇、蠕虫和老鼠的寿命而备受全世界的关注.Sirt隶属Ⅲ类HDAC家族,与Ⅰ类和Ⅱ类去乙酰酶不同,这类HDAC的特点是酶的催化活性依赖于烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+),并受NAD+/NADH的动态变化调节[12].在哺乳动物中共发现7种 Sirtuins直系同源物,其中SIRT1、SIRT6 和 SIRT7 主要位于细胞核中,SIRT2主要存在于胞质溶胶中,SIRT3、SIRT4、SIRT5 存在于线粒体中,它们可以使多种底物去乙酰化,在细胞代谢中发挥重要作用[13-14].在Sirt家族中,SIRT1是最受关注的一个,在接下来的段落里我们主要关注SIRT1.
在人类中,编码SIRT1的基因位于染色体10q22.1,长约33 kb,翻译后的蛋白质分子质量大小约为60 ku,共由500个氨基酸残基组成[15].SIRT1拥有高度保守的NAD+结合域和催化功能域,在分子水平上,SIRT1的主要功能是修饰蛋白质的赖氨酸残基.并在多种组织/器官中表达,连接哺乳动物体内和外部环境,确保代谢活动的动态平衡.SIRT1的酶促反应消耗NAD+,催化底物的乙酰基(一般是赖氨酸残基)被转移到裂解的NAD+上,释放烟酰胺(nicotinamide,NAM)、O-乙酰-ADP-核糖(O-acety1-ADP-ribose,O-AADPR)、去乙酰基底物.SIRT1俨然已经演化为细胞的一个“能量传感器”,通过NAD+感受细胞 “能量状态”和“氧化还原状态”的变化,见图1.
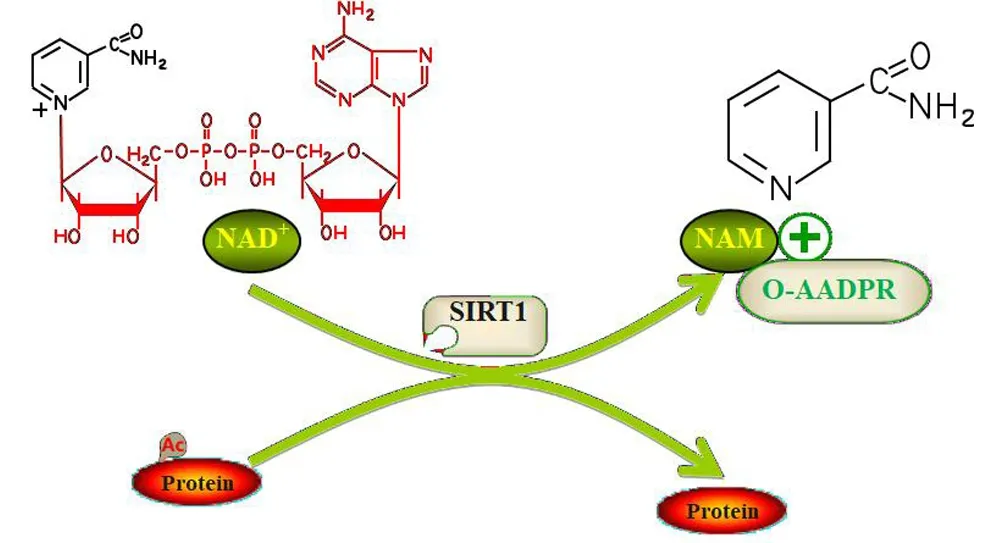
图1 SIRT1去乙酰化酶促反应过程Fig.1 Enzymatic reaction process of SIRT1 deacetylation
研究显示,SIRT1不仅可以去乙酰化组蛋白,还可以去乙酰化很多重要的转录因子和调节蛋白,这种效应导致细胞内蛋白质活性和可用水平的改变,从而调控多种生物学过程[16-17].除此之外,SIRT1自身也受到饮食和环境压力的调节.SIRT1的活性可受NAD+、NADH和一些NAD+的代谢物以及NAD+补救途径中的中间产物如烟碱,烟酸等的调节, 其中尤以局部微环境NAD+水平的变化影响最为显著.研究显示,哺乳动物烟碱磷酸核糖转移酶(nicotinamide phosphoribosyltransferase,NAMPT)和烟碱/烟酸单核苷酸腺嘌呤转移酶 (nicotinamide mononucleotide adenylyltransferase,NMNAT)催化NAD+的合成途径对SIRT1起主要调节作用[16].进一步研究表明NAD+/NADH的比值对SIRT1的激活起作用,不是由于NAD+的增加,而是由于NADH的减少.
综上所述,SIRT1是一种能量感受器,将环境、营养信号与细胞代谢稳态联系起来,参与调节代谢和压力相关的生理反应.大量证据表明,SIRT1不仅是重要的细胞能量传感器,而且还可以保护细胞免受代谢压力的影响.SIRT1的药理激活可防止脂肪肝所有阶段的发展,包括发病、进展和并发症.因此,SIRT1在脂肪肝和其他代谢疾病所涉及的能量代谢途径中扮演着重要且有益的角色.
2 SIRT1在代谢相关脂肪性肝病中的作用
2.1 SIRT1下调SREBP-1c和ChREBP减少肝脏DNL
稳定同位素示踪剂研究表明,MAFLD患者的一个重要特征是无论是否禁食肝脏DNL均异常升高,且DNL与肝内TG水平独立相关[18].因此,无法调节的DNL是MAFLD患者肝脏脂质蓄积的主要特征.肝脏DNL 受胆固醇调节元件结合蛋白1c(sterol-regulatory element binding protein 1c,SREBP-1c)和碳水化合物响应元件结合蛋白(carbohydrate-responsive element-binding protein,ChREBP)等转录因子和下游靶基因,如脂肪酸合酶(fatty acid synthase,FAS)、乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)、硬脂酰辅酶A去饱和酶-1(stearoyl CoA desaturase-1,SCD1)的调控[19-21].胰岛素信号可诱导SREBP1c的激活,由PI3K/ AKT信号通路介导,并依赖于核受体肝X受体(liver X receptor,LXR);升高的葡萄糖则可以直接激活ChREBP.
在HFD诱导肥胖小鼠的肝脏中SREBP-1c乙酰化水平显著升高,腺病毒介导的SIRT1过表达可以减轻这种肝脏脂肪变性和SREBP-1c介导的脂肪生成信号[22].相关研究表明,p300/CBP乙酰化酶通过增加SREBP-1c上Lys289和Lys309的乙酰化来增加其转录活性,而SIRT1通过在同一位点通过去乙酰化来下调SREBP-1c的转录活性[23].同样,使用SIRT1药理激活剂(白藜芦醇和SRT1720)或增加NAD+前体烟酰胺核苷,也可以降低SREBP-1c和相关的肝脏脂肪生成基因表达谱,如FAS、SCD1和ACC1,从而保护肝脏免受HFD诱导的肝脏脂肪变性[24].ChREBP是另一个参与脂肪形成的脂质转录因子,它与SREBP-1c协同刺激TG的合成.高脂饮食可诱导肝脏ChREBP乙酰化增加, SIRT1表达和去乙酰化活性也同样降低.Wang等人[25]使用Cre-loxP 方法特异性敲除肝脏中SIRT1,结果发现ChREBP启动子上游组蛋白H3K9和组蛋白H4K16乙酰化水平升高,ChREBP表达增加,正常喂养条件下的小鼠也发展为脂肪肝.
因此,以上数据充分揭示了SIRT1在调节脂质生成转录因子(SREBP-1c和ChREBP)转录活性方面发挥着重要作用,SIRT1可能是通过组蛋白和转录因子的去乙酰化来控制肝脏的脂质平衡.
2.2 SIRT1上调ATGL和PPARα增加肝脏FAO
叉头盒转录因子O1(factor forkhead box O1,FoxO1)在调节细胞生长中发挥重要作用,是细胞稳态、代谢和应激反应的关键效应分子.FoxO1作为机体能量代谢的关键调节因子,在感受到能量不足时,一方面可以可被AMP活化蛋白激酶(AMP-activated protein kinase,AMPK)磷酸化激活,激活的 AMPK 直接磷酸化并调节FoxO1 的亚细胞定位,阻止FoxO1 进入细胞质,从而诱导ATGL 的上调,增加肝脏脂肪分解来减少脂肪沉积[26].另一方面FoxO1还可以被SIRT1去乙酰化激活,继而刺激脂肪甘油三酯脂肪酶(adipose tissue TG lipase,ATGL)并抑制G0/G1 转换基因 2(G0/G1 switch gene protein 2,G0S2)在肝脏的表达[27-28].现有研究表明,SIRT1与 AMPK在细胞能量匮乏状态下相互调控,SIRT1的去乙酰化增加了AMPK的磷酸化.肝脏中表达组成型活性 FoxO1(constitutively active FoxO1,CA-FoxO1)转基因小鼠中ATGL mRNA 和蛋白质水平增加, G0S2 表达降低;而在肝脏特异性 FoxO1敲除小鼠中,肝脏 ATGL 表达降低、G0S2 表达增加,表明 FoxO1可以调节ATGL 和 G0S2 表达[29].从以上结果可以看出,SIRT1/AMPK/FoxO1信号通路的激活诱导 ATGL蛋白表达并增强脂质水解,减少肝脏脂质积累.
过氧化物酶体增殖剂激活受体α(peroxisome proliferators-activated receptor α,PPARα)是一种配体激活性转录因子,其主要内源性配体是脂肪酸.除此之外,过氧化物酶体增殖物激活受体γ辅激活因子1α(peroxlsome proliferator activated receptor-γ coactlvator-1α,PGC-1α)也是PPARα启动转录的重要影响因素.当PPARα被激活时,其诱导线粒体基质中脂肪酸分解代谢相关基因的表达,例如肉碱棕榈酰转移酶I(carnitine palmitoyl-transferase 1,CPT1)、脂蛋白脂肪酶(lipoprotein lipase,LPL)、解耦联蛋白2(uncoupling protein 2,UCP2).研究显示,SIRT1主要通过去乙酰化PGC-1α来增加PPARα的转录活性,继而促进肝脏中脂肪酸的β氧化.特异性敲除SIRT1基因将会导致PPARα转录信号失活,同时发现 PGC-1α乙酰化增加、脂肪酸β氧化减少以及肝脏脂肪变性易感性增加[30].相反,通过腺病毒介导的SIRT1过表达降低了PgC-1α乙酰化、增加了PPARα转录信号、β氧化功能,从而减轻肝脏脂肪变性[31].
以上数据表明,脂肪酸β氧化是肝脏利用TG的主要途径, FoxO1和PPARα信号通路在调节这一过程中发挥重要作用.FoxO1和PPARα均是感受能量变化的转录因子,其活性受SIRT1的去乙酰化调控.
2.3 SIRT1下调NF-κB增加肝脏抗炎作用
肝脏脂肪变性是MAFLD的标志性特征,通常无症状且可逆转.然而当存在持续性炎症的情况下,肝脂肪变性可能发展为更严重的肝损伤.其特征为巨噬细胞浸润和高水平的促炎性细胞因子.转录因子核因子κB(nuclear factor-κB,NF-κB)在炎症过程中发挥着重要作用[32].典型的NF-κB以RelA/p65异源二聚体形式存在,细胞处于静息状态时,NF-κB与NF-κB抑制蛋白(inhibitory protein of NF-κB,IκB)结合成三聚体复合物定位于细胞质中,两者结合便掩盖了 NF-κB的核定位信号(处于失活状态)[33-34].一旦触发炎症反应,IκB就会被IκB激酶磷酸化,并靶向其泛素化和降解,IκB降解后,NF-κB能够从IκB释放并转移到细胞核中,激活促炎通路[35].
p300/CBP可以乙酰化RelA/p65并激活NF-κB转录.SIRT1 与 NF-κB 的 RelA/p65 亚基发生相互作用,并通过在Lys310处使 RelA/p65 去乙酰化来抑制其转录活性[36].越来越多的证据表明,SIRT1参与了与炎症相关MAFLD的发病机制.肝脏特异性敲除SIRT1或全身SIRT1杂合敲除可显著增加巨噬细胞的积累和浸润,并伴随着更高水平的巨噬细胞标记物在肝脏中的表达[37].SIRT1在转基因小鼠中的过表达显示出对高脂饮食诱导的脂肪肝的有益作用,并通过下调NF-κB活性来降低促炎性细胞因子(如IL-6和TNF-α)[38].SIRT1激动剂白藜芦醇或SRT1720[39]通过下调NF-κB转录活性和TNF-α的产生,在乙醇代谢物处理的巨噬细胞中也表现出抗炎作用.
这些数据表明,SIRT1是MAFLD中必不可少的抗炎调节剂,主要是通过使NF-κB去乙酰化并下调NF-κB转录活性,减少巨噬细胞浸润和促炎细胞因子的产生.
2.4 SIRT1上调FoxO1和 PGC-1α增加肝脏抗氧化作用
“多重打击理论”是解释MAFLD发病机制的公认理论, OS是该理论的基石,并在单纯性脂肪变性(non-alcoholic fatty liver,NAFL)向NASH的进展中起着关键作用.肝细胞中活性氧(reactive oxygen species,ROS)的积累导致参与MAFLD发展的多种途径受损,如脂质代谢、胰岛素信号传导、炎症和凋亡,因此OS被认为是最终导致肝细胞死亡的第三种损伤[40-41].OS的程度通常取决于ROS产生和抗氧化能力之间动态平衡.ROS诱导的过度OS可被几种抗氧化酶解毒,包括超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)和谷胱甘肽过氧化物酶(glutathione peroxidase,Gpx).越来越多的证据表明,SIRT1在应激反应中发挥着重要作用[42-43].研究显示,SIRT1通过调控参与氧化还原调控的转录因子, 继而激活抗氧化酶基因的转录来调节OS[44].
SIRT1 通过去乙酰化FoxO1和 PGC-1α以增加其抗氧化酶基因的转录活性,增加下游抗氧化基因锰超氧化物歧化酶(manganese superoxide dismutase,MnSOD)、血红素加氧酶-1 (heme oxygenase-1,HO-1)和CAT的表达[45-46].除了FoxO1,SIRT同样可以影响核因子 NF-E2 相关因子(nuclear factor-erythroid 2-related factor 2,NRF2).在高脂饮食诱导的MAFLD中,α-硫辛酸(SIRT1激活剂)可以去乙酰化并激活NRF2的转录活性,导致靶抗氧化基因(SOD、CAT、HO-1)的高表达,继而保护脂肪肝的肝脏OS[47].另外,辅酶 Q10(coenzyme Q10,Co Q10)可以显著增加糖尿病大鼠肝脏SIRT1和NRF2 基因的表达,同时增加了SOD、CAT的活性[48].除此之外,白藜芦醇(SIRT1特异性激活剂)治疗可降低大鼠 MAFLD 的严重程度,至少部分是由SOD、CAT和GPX抗氧化活性升高,脂质过氧化产物(lipid PerOxide,LPO)如丙二醛(malonaldehyde,MDA)和4-羟基壬烯酸(4-hydroxynonenal,4-HNE)降低介导的[49].SIRT1特异性基因调控,在OS中作用提供了更直接的支持.在SIRT1过表达的转基因小鼠中,SIRT1的这种有益作用至少归因于两种机制,刺激诱导抗氧化蛋白以及下调促炎细胞因子(如 TNF-α 和 IL-6)[50].相反,肝脏 SIRT1 缺失会显著增加肝脏以及多个其他组织中的 ROS 水平,从而导致严重的肝脏OS[51-52].以上数据支持SIRT1对肝脏OS和相关脂肪性肝疾病的有益影响.值得注意的是,SIRT1对OS的影响有很大一部分原因可能是肝脏DNL/FAO/炎症改善所间接诱导的,因此如何评价SIRT1直接调控脂肪肝抗氧化基因的证据仍需进一步研究.
综上所述,SIRT1可以去乙酰化多种转录因子和调节蛋白,在脂肪肝和其他代谢疾病所涉及的代谢途径中扮演重要角色.虽然SIRT1的功能和细节尚未完全阐明,但已经有足够多的证据表明,这种酶可感受营养的可用性,并将这一信息传递给控制能源物质利用和能量适应的蛋白,从而帮助建立合适的生理反应.
3 运动对SIRT1水平的调控及机制
3.1 肝脏的运动代谢
运动最直接影响的器官就是骨骼肌,每一次骨骼肌收缩都需要大量的ATP.在持续运动中,ATP的产生对骨骼肌来说是一个巨大的代谢挑战.运动会导致能量转换急速增加,尤其是骨骼肌和心肌,能量需求在骨骼肌中变化高达 100 倍,在心脏中变化也高达 10 倍[53].
除了 “骨骼肌”,运动对于全身器官来说都是一个重大挑战,特别是“肝脏”,因为它不仅负责向工作的肌肉提供能量供应,还负责此时全身的糖脂代谢的稳态.运动期间,肝脏暴露于门静脉中胰岛素和胰高血糖素浓度的改变.在啮齿类动物身上,一次急性运动肝脏的转录物是骨骼肌(比目鱼肌)转录物的3倍,肝脏基因的上调或下调更为明显[54].因此,运动后肝脏基因显著差异表达的一个解释是能量应激的诱导,非力竭性运动后,能量消耗主要发生在肝脏,而不是在工作肌肉中.
3.2 运动对SIRT1的影响
运动期间,能量需求急剧增加,为了维持代谢稳态,能量产生必须与能量需求相适应.ATP是人体可以直接利用的能量,其中线粒体电子传递链和细胞质的电子转移是ATP产生所必需的.NAD 是电子转移的关键因素,NAD 的还原和氧化形式的比率(NADH/NAD+)反映了机体氧化还原稳态,线粒体中的比率比胞质溶胶中的高约 100~1 000 倍[55].在肌膜中NAD+/NADH 比率的增加,导致 SIRT1 mRNA 和蛋白质水平的表达增强[56].综上所述,运动可以改变 NAD+/NADH 比率,并导致 SIRT1 的有效诱导也就不足为奇了.
3.2.1 运动对血液循环中SIRT1的影响
血液循环中的去乙酰化酶水平与不同器官功能障碍相关.值得注意的是,血液循环中SIRT1并不一定可以直接反映肝脏中SIRT1的功能,但血液循环中SIRT1可能反映外周血单核细胞(peripheral blood mononuclear cell,PBMC)的活性和表达[57].相关研究表明, PBMC与肝细胞具有相同的胚胎起源,因此它们也可以准确地代表肝细胞的变化[58].研究发现,由于体质量增加和代谢紊乱可导致血液SIRT1浓度的下降[59].Villanova 等人[60]的一项研究中,分别采集15名普通人群和的 15名意大利赛艇专业运动员的血液,并从血液样本中分离出PBMC,结果发现PBMC的去乙酰化酶活性从 18 岁到 40 岁逐渐增加,然后在接下来的 20 年持续减少,令人惊讶的是,专业运动员的体育锻炼可以上调SIRT1活性.现有证据表明Villanova 等人首次在人类中证明了SIRT1活性的年龄函数,并且这可以通过体育锻炼来改变.另外一项研究中,阻力和有氧训练相结合的 12 周锻炼计划确实提高了健康、老年、超重参与者血液中 SIRT1 的活性,从而导致能量代谢增强以适应增加的能量需求,并且这种增加可能会通过额外的饮食调整而增强[53].以上结果表明,运动确实可以增加不同人群SIRT1的表达水平和活性,然而这些研究多集中在血液层面.
3.2.2 运动对肝脏中SIRT1的影响
由于研究人类肝脏的局限性,动物模型常被用于阐明肝脏中信号转导途径、基因表达和蛋白质水平.Zou等人[10]测量了斑马鱼(人类和斑马鱼之间的肝细胞组成、功能、信号传导、损伤反应和调节肝病的细胞过程相似,斑马鱼已被用于探索肝病、肝癌和再生的研究,斑马鱼是研究NAFLD 机制的合适模型)肝脏中SIRT1的蛋白质水平,发现 HFD 斑马鱼降低了SIRT1的表达,游泳运动减弱了高脂肪饮食诱导的 SIRT1 通路的抑制.这些结果表明,游泳干预可以激活 SIRT1信号并减少高脂饮食引起的肝损伤.
在啮齿类动物中,8 周的有氧运动可以增强小鼠肝脏SIRT1的蛋白表达,通过抑制脂肪分解、增强肝脏中的线粒体生物合成和FAO化来降低由高脂肪饮食引起的 MAFLD,这些变化是 SIRT1 介导的细胞通路激活的结果,尤其是 AMPK 的诱导[61].另一项关于揭示有效能量供应所需的遗传机制研究中,高耐力小鼠模型的运动能力是对照小鼠的 3.8 倍,并且肝脏中SIRT1表达升高,结果表明,SIRT1作为一种遗传特征可能会推动肝脏代谢向更高的燃料产量方向发展,以提供在力竭运动期间所需的能量需求[62].也有报道称,在肝脏中 SIRT1 过表达的转基因小鼠模型中,增加的 SIRT1 并不能保证改善葡萄糖代谢和改善胰岛素敏感性[63].这表明运动介导的适应非常复杂,而不是只依赖于某一种蛋白质,SIRT1 的活性也不仅仅依赖于 NAD+水平.

注:“↑”表示升高; “↓”表示下调.图2 运动激活SIRT改善MAFLD的分子机制Fig.2 Molecular Mechanism of exercise activated SIRT improving MAFLD
大量研究显示,SIRT1是感受能量可用性和调节代谢的细胞传感器.运动导致的能量匮乏可增加代谢器官(骨骼肌、心脏、肝脏)NAD+水平,改变NAD+/NADH 比率,激活SIRT1;另外这还会增加AMP/ATP比率并激活AMPK,AMPK和SIRT1成相互促进作用[64-65].值得注意的是,运动介导的 SIRT1 活性增加是全身性的,在许多器官中都可以观察到,例如肌肉[66]、心脏[67]、大脑[68]. SIRT1是细胞能量代谢的重要调节剂,对糖酵解、氧化磷酸化和FAO有直接影响.因此,定期运动会导致全身适应,恢复代谢性疾病患者组织器官中(肝脏)SIRT1 的水平,使细胞代谢过程正常化,从而减轻这些疾病的严重程度.运动训练使肝脏脂质含量发生了重大变化,这表明肝脏代谢显著适应了规律的身体活动.
4 小结
运动是防治MAFLD的一种有效的非药物疗法(图2),其潜在机制与能量代谢传感器 SIRT密切相关.定期运动会导致全身适应,恢复MAFLD患者组织器官中SIRT1 的水平,既可以改善发病机制,又可以预防 MAFLD的发展.运动诱导的 SIRT1信号激活在肝脏脂质代谢中起着重要的调节作用,一方面通过控制依赖SREBP-1c/ChREBP的脂肪生成和FoxO1/PPARα的脂肪酸β氧化,抑制肝细胞脂质合成和增加肝细胞脂质利用;另一方通过调控NF-κB和PGC-1α/FoxO1/NRF2,增加肝细胞抗炎和抗氧化作用,保护细胞免受代谢压力面的影响.因此,定期运动可使细胞代谢过程正常化并减轻疾病的严重程度.本文总结了运动对MAFLD的改善效应和相关分子机制,将加深人们对 “运动是良药”的理解与认识,鼓励人们通过运动手段消除慢性病,为“迈向健康中国2030”打下坚实健康基础.

