盈江澳洲坚果黑果病病原鉴定及防治药剂室内筛选
蒋桂芝,王 康,李学斌,贺熙勇*
(1.云南省热带作物科学研究所,云南景洪 666100;2.云南迪思企业集团坚果有限公司,云南盈江 679300)
坚果纳入云南省高原特色农业规划和“十三五”木本油料发展规划中,盈江县成为云南澳洲坚果的产地之一[1]。澳洲坚果是外来引进物种,国内对澳洲坚果的研究起步晚,种植模式、栽培环境与原产地有较大差异。由于栽培环境、管理模式的不同,导致病虫害的发生情况与原产地也不尽相同。如近年来发生越来越严重的澳洲坚果黑果病(又称炭疽病),据云南盈江迪思企业集团坚果有限公司的产量损失统计:2019 年损失23 t,2020 年损失53 t,2021 年损失达113.5 t。
澳洲坚果黑果病常发生于每年雨季6—8 月,果实正处于养分积累期至成熟期,未成熟的果实感病后脱落,造成产量损失严重,并且黑果病发生严重的果园常发生叶枯病。澳洲坚果原产地澳大利亚有报道,引起果斑病的病原菌有炭疽菌Colletotrichum gloeosporioides、拟茎点霉Phomopsissp.、束梗尾孢菌Pseudocercospora、毛色二孢菌Lasiodiplodia theobromae等,Pseudocercospora通常在开花后4~5 个月引起病态早熟的果实脱落[2];由束梗孢菌Stilbella cinnabarina引起果壳斑点病可造成大量的熟前落果,该病发生在长期潮湿的季节[3];笔者曾报道国内由橡胶疫霉Phytophthora heveae引起的果腐病[4],以及在云南景洪引起澳洲坚果果实褐斑病发生的是Calonectria pentaseptata[5]。2019—2021 年,课题组在云南省盈江县进行调查、采样和鉴定,分析该病害发生的环境条件以及控制黑果病的技术措施,以明确黑果病的致病菌和防治的化学药剂,为云南澳洲坚果黑果病的大田防控提供依据。
1 材料和方法
1.1 材料
病原菌分离材料取自云南省盈江县迪思坚果公司莲花山基地(N24°46′37″,E97°55′35″,海拔956 m)、太平镇基地(N24°38′47 ″,E97°47′24 ″,海拔1 043 m)及云南源润坚果开发有限公司基地(N24°42′49 ″,E97°56′10 ″,海拔936 m)。
真菌菌丝DNA 快速抽提试剂盒、ITS1/ITS4、HIS3、β-tubulin 等PCR 扩增引物,由 生工生物工程(上海)技术服务有限公司提供。
试验接种材料为澳洲坚果未成熟果实,农业部景洪澳洲坚果种质资源圃提供。
参试药剂:(1)50%多菌灵WP(江苏蓝丰生物化工股份有限公司),(2)450 g/L 咪鲜胺EW(江苏辉丰农化股份有限公司),(3)200 g/L 氟唑菌酰羟胺SC(先正达南通作物保护有限公司),(4)250 g/L 嘧菌酯SC(先正达南通作物保护有限公司),(5)44%苯甲·百菌清SC(4%苯醚甲环唑,40%百菌清;先正达南通作物保护有限公司),(6)36%丙环·咪鲜胺SE(10%丙环唑,26%米鲜胺;浙江天丰生物科学有限公司),(7)60%唑醚·代森联WG(5%吡唑醚菌酯,55%代森联;巴斯夫植物保护(江苏)),(8)500 g/L 甲基硫菌灵SE(江苏龙灯化学有限公司),(9)325 g/L 苯甲·嘧菌酯SC(先正达南通作物保护有限公司),(10)40%吡唑醚菌酯·喹啉铜SC(10%吡唑醚菌酯,30%喹啉铜;江西中迅农化有限公司),(11)75%唑醚·甲硫灵WP(15%吡唑醚菌酯,65%甲基硫菌灵;江苏龙灯化学有限公司),(12)10%苯醚甲环唑WG(先正达南通作物保护有限公司),(13)75%肟菌·戊唑醇WG(25%肟菌酯,50%戊唑醇;拜耳作物科学中国有限公司),(14)20%噁霉·乙蒜素WP(5%噁霉灵,15%乙蒜素;南阳新卧龙生物化工有限公司)。
1.2 方法
1.2.1 病原菌分离
将病果用自来水清洗,晾干后用75%乙醇表面消毒处理30 s,剖开病果,选择病健交界组织,分别挑取大小2~3 mm×2~3 mm 的组织分别放置在PDA 平板上,在25℃、RH65%条件下培养5 d,将得到的菌落镜检、单孢分离,得到纯培养菌株用于致病性试验,并将菌株与病果上镜检结果进行比对。
1.2.2 致病性测定
将培养10 d 的测试菌株孢子制成浓度为1×103个/mL 的孢子悬浮液备用。在果园选取20 个正常未成熟带皮果,其中10 个喷孢子悬浮液1 mL/个,10 个作对照喷无菌水1 mL/个,处理后均分别放置于20~28℃、RH85%条件下的保湿缸中保湿。当接种带皮果出现与田间一致的感病症状后,再进行病原分离,得到与接种菌一致的菌,即确认为病原菌。
1.2.3 病原菌鉴定
(1)形态学鉴定
病果上霉状物镜检:用灭菌牙签挑取病果表层霉状物少许,放在载玻片上,加灭菌水,盖上玻片,在显微镜下观察霉状物的形态特征。
将纯培养病原菌在PDA 培养基上培养5~7 d,观察形态特征、产孢方式等,依据Crous[6]、庄文颖[7]等的方法进行鉴定。
(2)分子生物学鉴定
按照Fungal DNA Kitr 的提取步骤,提取菌丝的DNA 置 于4℃冰箱中备用。用ITS1/ITS4[8]、HIS3[9]、β-tubulin[10-12]等序列引物进行PCR 扩增,扩增产物送交生工生物工程(上海)技术服务有限公司完成测序。将获得的ITS、HIS3、TUB2 序列上传至GenBank 数据库,并与GenBank 数据库中有关序列进行同源性比较,应用MEGA 7.0 软件对拼接序列进行对比分析,构建rDNA-ITS-HIS-TUB序列多基因联合系统发育树,确定其分类学地位。
1.2.4 药剂毒力测试
各参试药剂的使用浓度选用药剂说明推荐使用浓度的中间浓度。各参试农药配制成含毒培养基,对照为空白(不加任何农药)。
2 结果与分析
2.1 病原菌的分离、致病性的测定
分离样本18 个,得到18 个菌落。经观察菌落和分生孢子形态初步鉴定,其中15 个菌落均为同一种真菌,分生孢子形态与病果上霉状物镜检结果一致。选取代表性菌落进行单孢分离,经过多次转移培养,获得了一些菌落和孢子完全一致的纯培养物,编号为OJ20190628。从PDA 上培养10 d 的纯培养物中获得孢子制备浓度为1×103的孢子悬浮液。
孢子悬浮液接种2 d 后,带皮果表面开始出现点状水渍斑,5 d 病斑已扩大变成黑色,病斑边缘呈水渍状,有的病斑上开始出现白色霉状物,病状与田间一致;对照无症状。从有症状的果实中重新分离到与接种一致的真菌,确认菌株OJ20190628 对澳洲坚果果实有致病性。
2.2 病原菌鉴定
2.2.1 形态学鉴定
病果上霉状物镜检:霉状物为菌丝体和分生孢子,分生孢子棒状,有5 个隔,大小66~72 μm×5.2~6.0 μm。
菌株OJ20190628 在PDA 上菌丝白色,老熟菌丝棕色至红棕色(图1,a)。在PDA 上产生大量分生孢子,分生孢子圆柱形(图1,b,c),长 61~81 μm,宽 4.3~6.3 μm,有5 个隔。厚垣孢子褐色或棕褐色,串生或聚生,近球形、椭圆形及长圆柱形(图1,d)。分生孢子梗有大型分生孢子梗和小型分生孢子梗,大型分生孢子梗由总梗、帚状可育分枝、伸延梗和顶生囊泡组成;分生孢子总梗有隔,长50~145 μm,宽5.6~9.0 μm;伸延梗有隔(图1,e),直或弯曲,长190~340 μm,宽3.1~5.5 μm,终止于棒状的囊泡;棒状的囊泡宽3.1~5.0 μm。帚状可育分枝常3 级分枝(图1,f),偶见4、5 级分枝,孢子梗长49~100 μm,宽6~9 μm;1 级分枝0~1 隔,长16~33 μm,宽3~6 μm;2 级分枝0~1 隔,长17~29 μm,宽4~6 μm;3 级分枝无隔,长14~22 μm,宽3~6 μm,每个末端分支产生1~3 瓶梗,瓶梗无隔,圆柱形至腊肠状,单生时倒梨形,长12~23 μm,宽 3~6 μm。基于这 些形态特征,OJ20190628 鉴定为丽赤壳菌属Calonectria pseudoreteaudii。

图1 OJ20190628菌株的形态特征
2.2.2 分子鉴定
从菌丝体中提取DNA 基因组,通过3 对引物对ITS1/ITS4、HIS3、β-tubulin 片段进行PCR 扩增、测序,分别获得521 bp ITS(MN906306)、450 bp HIS3(MT052331)、331 bp TUB2(MT052332)等 序列,在NCBI 网站上进行同源性比较,通过BLAST搜索核酸数据库显示,这些序列分别与已报道的Ca.pseudoreteaudii系列中的FAFU201101 菌株的ITS(JN794044)、HIS3(JN975409)和TUB2(JN975408)序列同一性分别为100%,100%和99.6%。通过MEGA7 软件构建病原菌OJ20190628 的rNDA-ITSHIS-TUB 多基因联合与近源物种的系统发育树,结果显示病原菌OJ20190628 与Ca.pseudoreteaudii位于同一分枝,支持率为100%(表1、图2)。
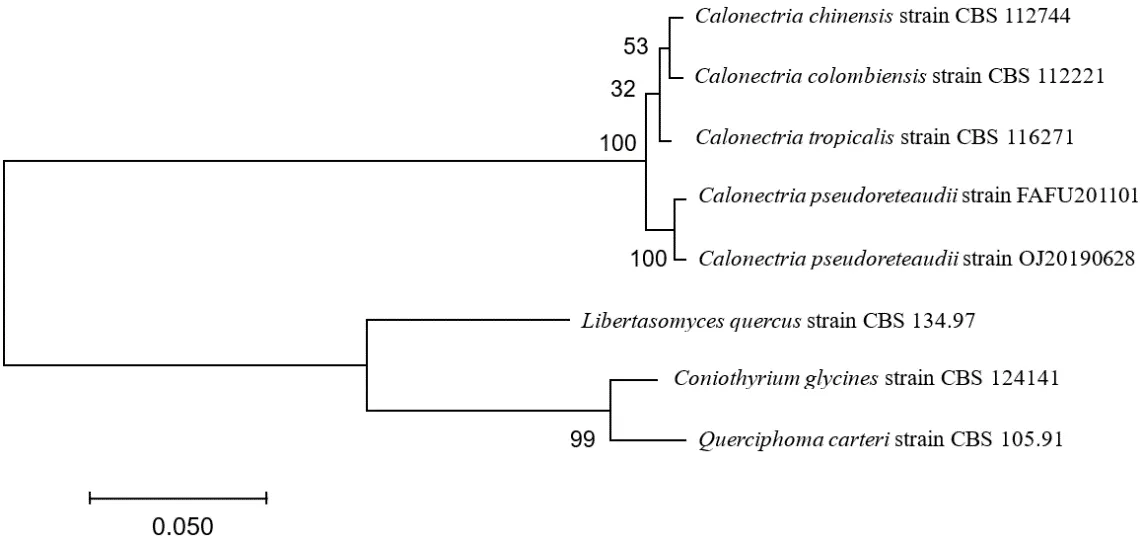
图2 OJ20190628基于rNDA-lTS-HlS 多基因联合与近源物种的系统发育树

表1 参考菌株名称、馆藏号和GenBank登录号
形态学和分子鉴定分析表 明病原 菌OJ20190628 是Ca.pseudoreteaudii。
2.3 药剂毒力测试
试验结果(表2)表明,参试的14 种药剂中有8 种药剂对病原菌菌丝的生长抑制率达50%以上,分别是唑醚·甲硫灵、多菌灵、甲基硫菌灵、丙环·咪鲜胺、氟唑菌酰羟胺、肟菌·戊唑醇、咪鲜胺、吡唑醚菌酯·喹啉铜,其中抑制率达75%以上有多菌灵、甲基硫菌灵、唑醚·甲硫灵、丙环·咪鲜胺、氟唑菌酰羟胺、肟菌·戊唑醇等6 种药剂防治黑果病;噁霉·乙蒜素、苯甲·百菌清、嘧菌酯、苯甲·嘧菌酯、苯醚甲环唑等6 种药剂的生长抑制率低于50%。

表2 不同药剂对病原菌菌丝生长的影响
3 讨论
由Calonectria pseudoreteaudii引起澳洲坚果果实黑斑病为首次报道。由Ca.pseudoreteaudii引起植物病害的报道不多见,目前已报道Ca.pseudoreteaudii是桉树焦枯病的病原菌之一[13-14]。丽赤壳属Calonectria无性型为帚梗柱孢霉属Cylindrocladium,但由Cylindrocladium引起植物病害的报道并不多见。在云南景洪引起澳洲坚果果实褐斑病发生的是Ca.Pentaseptata[15],在德宏引起黑果实病的是Ca.pseudoreteaudii,Ca.pentaseptata与Ca.pseudoreteaudii为同属不同种,或许是因为地域差异导致的种间差异,是否也表明在我国澳洲坚果种植区造成果实病害的Ca.pentaseptata与Ca.pseudoreteaudii这两种病原菌具有明显的区域性为害特征,即Ca.pentaseptata与Ca.pseudoreteaudii引起的果实病害为我国澳洲坚果种植区所特有的一种新病害。
在调查过程中还发现,这两种病原菌除引起澳洲坚果的果实感病外,还可引起叶斑、叶枯,严重的造成枝条回枯,说明这两种菌对澳洲坚果果树的危害不可忽视,或许还有一些潜在的危害可能尚未被发现,这两种菌有可能成为云南澳洲坚果栽培过程中重要的病原菌。
Ca.pseudoreteaudii产孢最适温度为25℃,孢子萌发最适温度为28℃,孢子萌发与相对湿度成正相关,黑暗有助于孢子萌发[16],这些特性与澳洲坚果黑果病发生的环境高度相吻合。澳洲坚果黑果病发生在高温、高湿的雨季,病害传播速度快,因而要控制黑果病的发生就必须改善果园的环境条件,即降低果园的湿度,增加果园的通风透光,进入发病期采用化学药剂控制。
4 结论
澳洲坚果黑果病主要发生在高温、高湿的雨季6—8 月,种植过密、荫蔽度较高的果园易发生黑果病流行,控制该病害发生流行应采用综合防治措施:第一建立病虫害监测;第二加强果园修剪、施肥等田间管理;第三预防为主,进入雨季出现第一次连续降雨后适时采用化学药剂防治,化学药剂防治推荐使用唑醚·甲硫灵、多菌灵、甲基硫菌灵、丙环·咪鲜胺等4 种常见药剂。

