酶法制备玉米慢消化淀粉的研究
李若敏, 张焕新, 郑 义, 盘赛昆, 江 娟
(江苏海洋大学食品科学与工程学院1,连云港 222005) (江苏农牧科技职业学院2,泰州 225300)
淀粉经淀粉酶、糊精酶、麦芽糖酶水解后形成可被人体吸收的葡萄糖,葡萄糖通过小肠黏膜进入血液,导致餐后血糖指数(GI)快速升高[1]。Englyst等[2]根据人体消化和释放葡萄糖的速率,将淀粉分为快消化淀粉(RDS,20 min内消化),慢消化淀粉(20~120 min内消化)和抗性淀粉(120 min仍未消化)。现代营养学研究表明,碳水化合物参与了生物合成反应以及多种生命现象和生理过程,它与人类肥胖、糖尿病和心、脑血管等疾病具有很大的相关性,基于碳水化合物对人体健康和慢性病的膳食营养干预已成为一个重要的研究前沿[3]。慢消化淀粉(SDS)具有缓慢释放葡萄糖并能被人体吸收的特性,在人体内产生较平缓的血糖应答,不会对血糖平衡系统造成大的压力,具有预防代谢性疾病的功能。
淀粉消化率受很多因素影响,如淀粉来源、颗粒大小、直链淀粉含量、晶型和相对结晶度、链长分布等因素[4]。为了改善天然淀粉易吸收的营养缺陷并扩大其应用范围,国内外大多数研究通过物理、化学或复合法[5]对淀粉进行改性,制备SDS,而采用酶法[6,7]制备SDS的研究相对较少。分支酶(Branching enzyme,BE,EC2.4.1.18)是一类多功能的淀粉酶,属于糖苷水解家族GH13或GH57,能催化链间支化、链内环化和链内支化三类反应,其机理是先水解供体淀粉链上的某一α-1,4糖苷键,产生具有带还原性端的链段,然后将该链段转移至受体糖链的葡萄糖单元C6的位置,形成α-1,6分支点,完成支化过程,因此可根据其来源和底物种类的不同,合成具有不同功能特性的改性淀粉[8]。本研究以玉米淀粉为原料,采用α-淀粉酶和Bacillusstearothermophilus来源的BE对其连续处理,不仅实验条件温和、成本低廉、产品安全性高、对环境污染少,而且可以获得高含量的SDS产品,为普通玉米淀粉深加工提供新的途径[9]。
1 材料与方法
1.1 主要材料试剂
天然玉米淀粉:市售;α-淀粉酶、Bacillusstearothermophilus来源的分支酶(200 U/g)、葡萄糖苷酶(1 200 U/g)、猪胰腺α-淀粉酶(80 U/g)、葡萄糖试剂盒;磷酸氢二钠、磷酸二氢钠、无水乙醇等均为分析纯。
1.2 主要仪器设备
T6型紫外可见分光光度计,85810R型高速冷冻离心机,Labconoo FreeZone 6L型台式冻干机。
1.3 方法
1.3.1 制备玉米慢消化淀粉(SDS)
称取玉米淀粉溶解于磷酸钠缓冲液(10 mol/L,pH 6.5)中,将其分别配制成质量分数为10、15、20、25、30%的淀粉浆溶液,90 ℃水浴振荡糊化,冷却至室温。添加200 U/g α-淀粉酶(以干淀粉质量计),50 ℃酶解4 h后沸水浴灭酶。取出后分别至于65、70、75、80、85 ℃保温,调节 pH 至7.0,分别添加100、200、300、400、500 U/g BE(以干淀粉质量记),酶解2、4、6、8、12 h,沸水浴灭酶。加入两倍体积的无水乙醇于4 ℃静置12 h,冷冻离心(8 000 r/min,25 min),沉淀复溶,-80 ℃储藏12 h,冷冻干燥72 h,过100 目筛[10]。
1.3.2 单因素实验设计
单因素实验主要研究酶作用时间、酶添加量、酶解温度和淀粉浆浓度4个因素对产物中SDS含量的影响。基本条件设定为:淀粉浆质量分数20%,α-淀粉酶添加量200 U/g,BE添加量300 U/g,α-淀粉酶酶解温度50 ℃,BE酶解温度75 ℃,α-淀粉酶解时间4 h,BE酶解时间6 h,进行醇沉,冷冻干燥,过100目筛。模拟体外消化,测定SDS含量。改变其中一个因素,其他因素保持不变,分别考察各因素对SDS含量的影响,每组处理重复3次。
1.3.3 响应面实验设计
根据单因素实验优化的结果,如表1所示,选取对SDS含量有影响的酶作用时间、酶添加量、酶解温度、淀粉浆质量分数为因素,采用Box-Benhnken中心组合设计实验,进行4因素3水平分析实验,确定最佳工艺参数,利用响应面实验设计进行实验优化[11]。
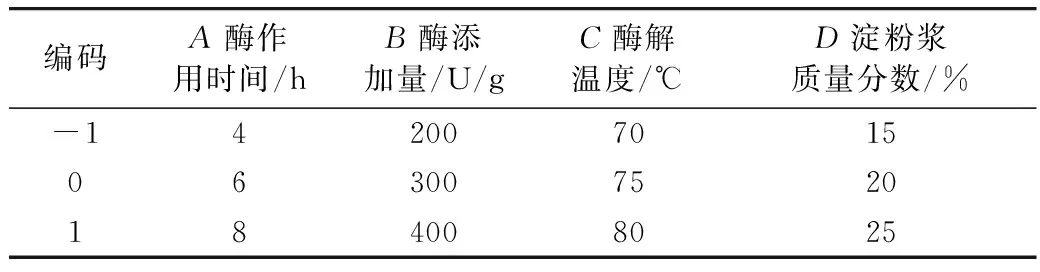
表1 Box-Benhnken实验设计的因素水平
1.3.4 SDS质量浓度测定
配制新鲜酶液:取1.8 mL A液(40 μL葡萄糖苷酶稀释至2.0 mL)、18 mL B液(4.0 g猪胰腺a-淀粉酶溶于26 mL,4 ℃搅拌溶解,离心取上清液)与1.2 mL去离子水混合均匀。
称取200 mg样品溶于15 mL磷酸盐缓冲液(200 mol/L,pH 5.2),37 ℃保温5 min加入5.0 mL新鲜酶液,37 ℃、200 r/min条件下反应,在20 min和120 min时各取出0.5 mL反应液加入4倍体积乙醇灭酶,水解产生的葡萄糖含量通过葡萄糖试剂盒测定[12]。
SDS=(G120-G20)×0.9
式中:G20和G120为淀粉水解20 min和120 min时释放葡萄糖的含量。
1.3.5 复合酶制备慢消化淀粉相关性能测定1.3.5.1 淀粉颗粒形貌观察
采用扫描电子显微镜进行颗粒形态的表征[13]。
1.3.5.2 链段分布测定
将淀粉样品溶解于NaAc-HAc缓冲液(100 mol/L,pH 4.5)中,配制成0.2 mg/mL乳液,并在沸水浴中充分糊化。40 ℃水浴中平衡温度,并添加3 μL异淀粉酶酶解24 h。沸水浴灭酶,冷却离心(8 000 r/min,10 min),上清液通过0.45 μm注射器滤膜,并利用HPAEC-PAD测定链长分布[14]。测试条件:色谱柱为CarboPacPA200;洗脱液A为250 mol/L NaOH溶液,洗脱液B为50 mol/L NaAc溶液和150 mol/L NaOH溶液的混合物(首先用液体A平衡色谱柱,然后使用液体B进行洗脱);流速0.5mL/min;测试温度25 ℃。
1.3.5.3 相对结晶度测定
将干燥的淀粉样品填充到压片机凹槽中并压实,以确保压制的淀粉片无裂纹且厚度轻薄均匀,然后将其放置在X射线衍射仪中以扫描和测量改性淀粉的相对结晶度[15]。测试条件:扫描范围为5°~35°,扫描速度为2°/min,电压电流分别为40 kV和40 mA。
1.3.5.4 溶解度和膨胀度测定
准确称取淀粉样品加去离子水配制成5%的淀粉浆,在95 ℃下加热搅拌30 min。冷却至室温5 000 r/min离心10 min,沉淀部分即为膨胀淀粉。将上清液分离干燥至恒重,即得水溶性淀粉[16]。根据公式计算淀粉溶解度和膨胀度:

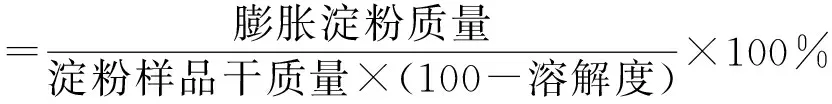
1.3.6 数据统计与分析
所有实验测定均重复3次。测定结果表示为平均值±标准差(SD)。使用SPSS statistics 23对实验数据进行方差分析确定差异显著性。图表使用Origin 2018和Excel进行绘制。
2 结果与分析
2.1 各因素对SDS含量的影响
酶作用时间对SDS含量的影响差异显著,对SDS含量影响如图1所示。经糊化的玉米淀粉含有较多长链结构,当酶解时间不足时,长直链淀粉在酶作用下并未完全被水解成短链,较多的长链淀粉分子冷却回生比较缓慢会直接影响SDS的形成[17]。酶解时间为6 h时,SDS质量分数最高,为36.75%。此时淀粉中葡聚糖长链已在反应中被BE完全水解,并通过糖基转移作用使淀粉分子具有更小的支链及更高的支化程度,阻碍支链淀粉在贮藏过程中分子重排,进而更好的抑制淀粉回生,促使SDS形成。但当酶解时间过长时,淀粉分子内生成了大量较短的链段,分子间剧烈活动使淀粉分子不易结晶,SDS形成受到抑制[18]。因此,合适的酶作用时间对SDS含量有很大的影响。因此,选取酶作用时间4、6、8 h进一步实验。
不同酶添加量对SDS含量存在一定影响,酶的用量影响淀粉的黏度大小。由图1可知,随着酶用量的增加,SDS含量也随之增加。当分支酶添加量为300 U/g(以干淀粉质量计)时,SDS质量分数最高,达到35.85%。但之后SDS含量随着酶添加量的增加逐渐降低,推测主要原因可能是因为BE属于糖基转移酶,它可以先水解供体淀粉链上的某一α-1,4-糖苷键,生成具有还原性末端的链段,继而将该链段通过转糖基作用转移至葡萄糖残基的第6位碳原子上,从而形成适当数量、含有较高分支短链比例的α-1,6-糖苷键,完成支化过程,并在冷藏回生过程中利用生成的氢键和低结晶度从而提高SDS含量[19,20]。而当酶浓度过高时,淀粉糊黏度过低,导致分子扩散性受到影响,生成无活性的中间产物,不利于淀粉回生后结晶,从而影响SDS的生成。此研究结果与赵凯等[21]利用酶脱支处理制备玉米缓慢消化淀粉中发现较高酶浓度会抑制SDS形成的结论一致。因此,选取分支酶的添加量200、300、400 U/g进一步实验。
由图1可知,随着酶作用温度的升高,反应体系达到适宜温度,SDS含量随着酶促反应速度的加快而逐渐增加。当BE在75 ℃下反应时SDS质量分数达到35.41%。继温度再升高,SDS含量有所减少。这可能是因为Bacillusstearothermophilus来源的酶热稳定性较高,但过高或过低的温度都会降低酶催化效率,影响酶对淀粉分子的水解作用[22]。当酶作用温度过高时,大部分酶被破坏,发生不可逆变性,导致酶失活不能水解淀粉分子,影响短链和结晶的形成,SDS含量降低[23]。因此,选取酶作用温度70、75、80 ℃进一步实验。
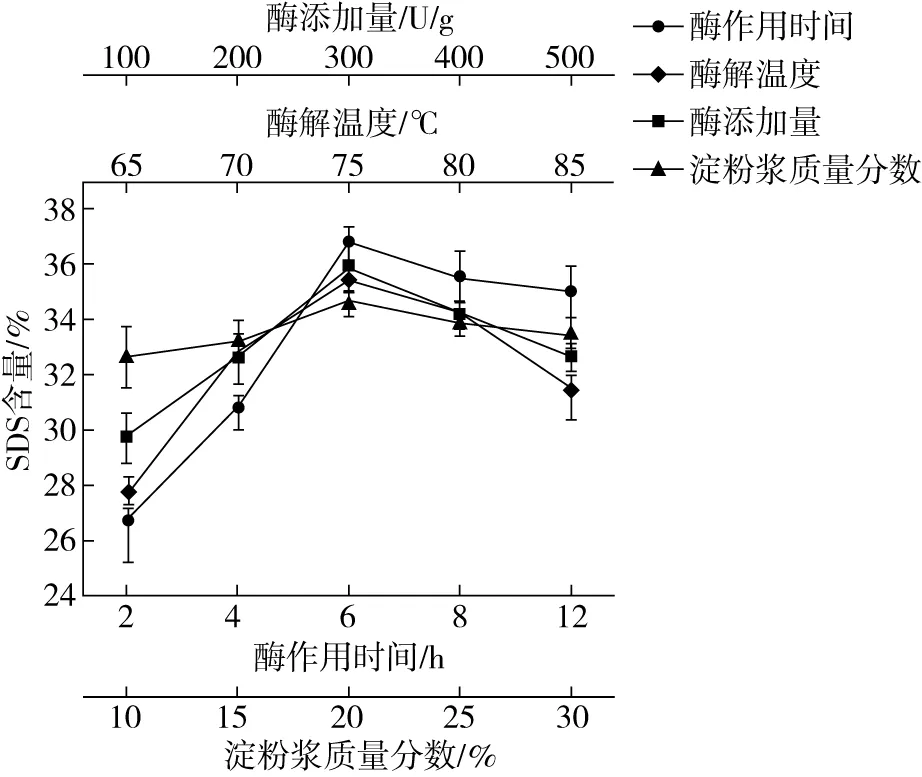
图1 各单因素对SDS含量的影响
淀粉浆质量分数对SDS含量影响如图1所示。当淀粉浆质量分数为20%时,SDS的质量分数最高,达到34.67%。但随着底物浓度逐渐增大,SDS含量反而随之降低,这可能是因为当底物浓度过大时,淀粉糊黏度增加,导致酶不能充分与淀粉分子接触,使酶的水解转苷作用不能完全发挥[24]。形成有序短链结构减少,促使淀粉冷藏回生时相对结晶度下降,SDS含量随之减少[25]。因此,选取淀粉浆质量分数15%、20%、25%进一步实验。但总体而言,淀粉浆质量分数对SDS含量影响不明显,各个底物浓度条件下,SDS含量差别不大。
2.2 响应面实验优化设计
2.2.1 模型的建立及显著性检验
选取酶作用时间、酶添加量、酶解温度、淀粉浆浓度4个单因素设计实验。根据单因素实验结果,采用Box-Benhnken中心组合实验,考察各个因素对SDS含量的影响,进行4因素3水平的响应面优化实验,实验方案及结果见表2。
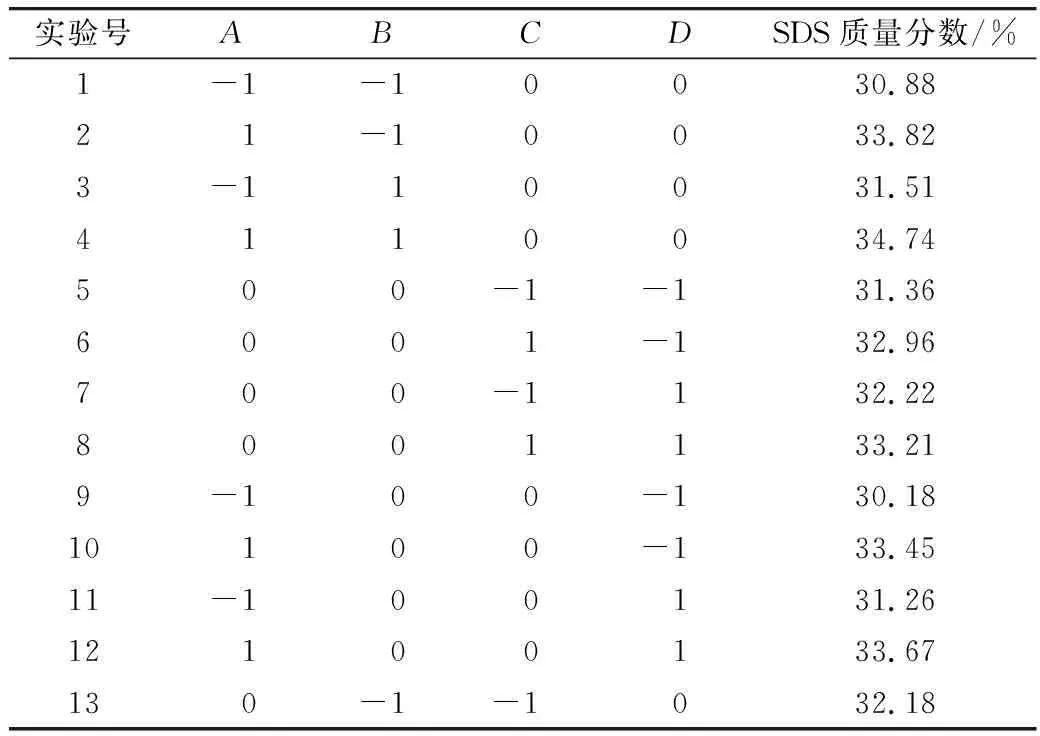
表2 响应面优化设计及结果
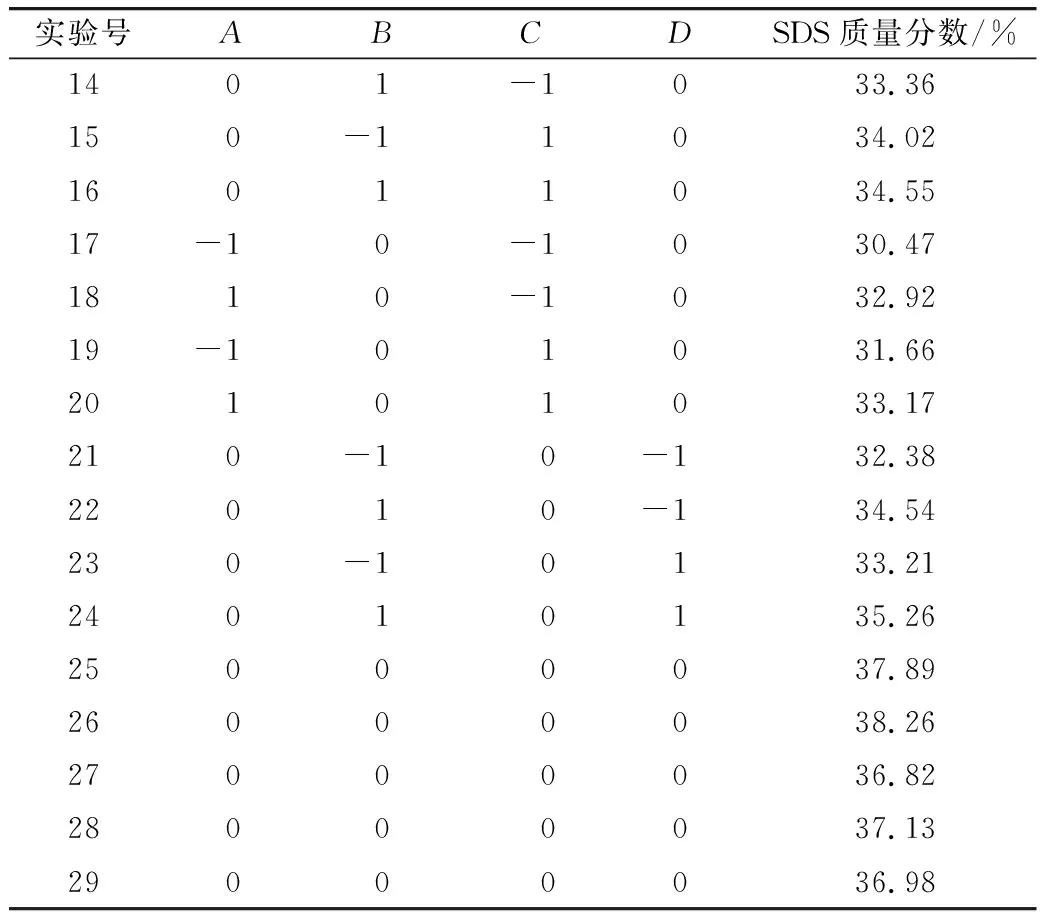
续表2
通过Design-Expert软件对表2中的数据进行多元回归拟合分析后,预测回归模型为:
Y=37.42+1.32A+0.62B+0.59C+0.33D+0.072AB-0.24AC-0.22AD-0.16BC-0.027BD-0.15CD-3.03A2-1.44B2-2.49C2-2.29D2
表3表明,模型的F值为1.25(>0.05)、P<0.000 1,结果表明所建立的回归方程模型极显著。预测值与真实值之间具有较好的相关性,这进一步表明该模型具有良好的拟合度和较小的实验误差。
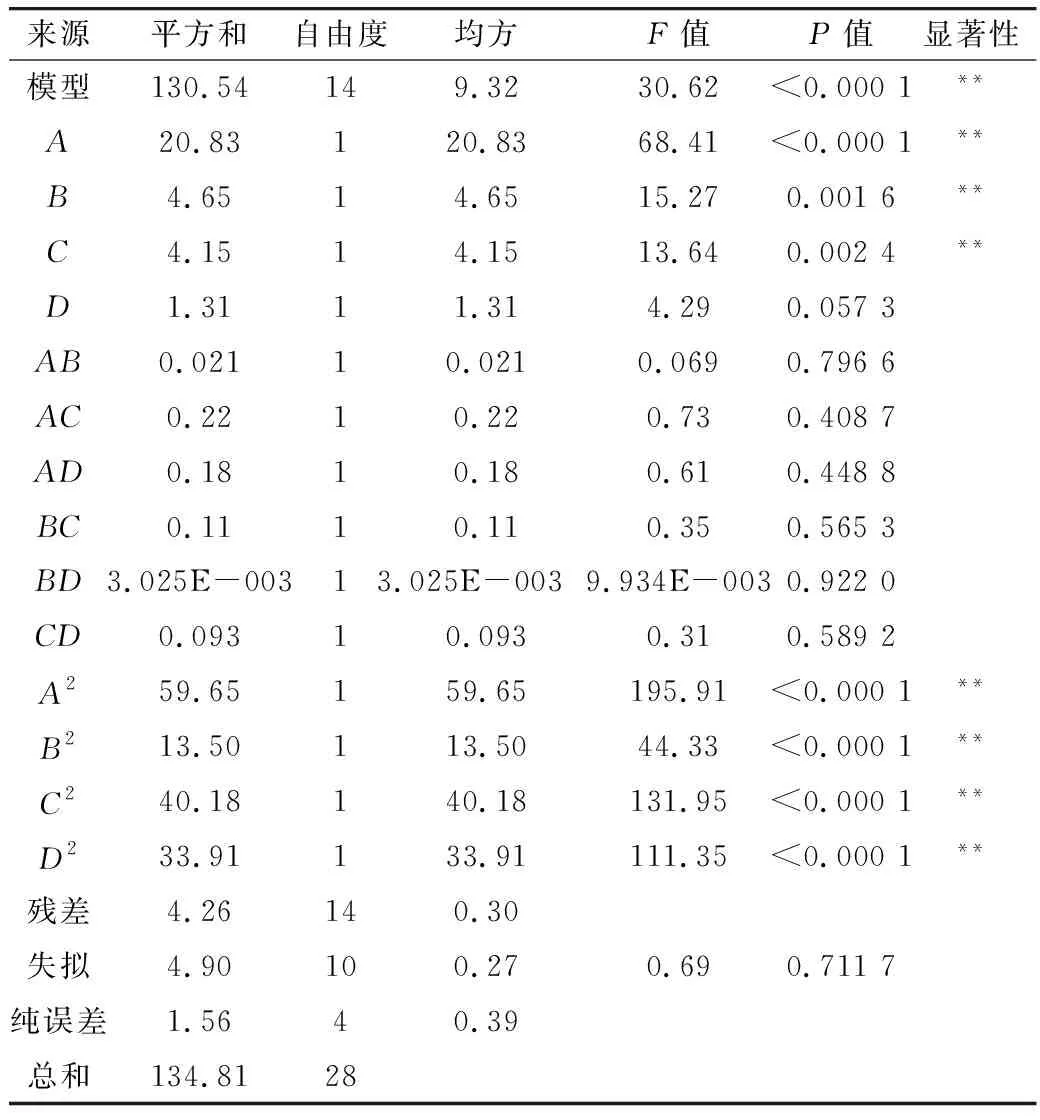
表3 方差分析
该回归方程可用于酶法制备慢消化玉米淀粉的过程进行初步分析和预测。二次回归方程中A、B、C、A2、B2、C2和D2对SDS含量的影响极显著(P<0.01),其他差异均无统计学意义(P>0.05)。因此,各测试因子对响应值的影响显示出二次抛物线关系。此外,在酶作用时间、酶添加量、酶解温度和淀粉浆浓度这4个关键因素中,对SDS含量的影响顺序为:酶作用时间(A)> 酶添加量(B)>酶解温度(C)>淀粉浆浓度(D)。拟合F值的缺失为0.69>0.05,P=0.711 7>0.05,表明未知干扰因素对测试结果的影响很小,模型拟合良好,测试误差小。该模型可用来显示每个因素和响应值之间的差异。
2.2.2 响应面分析
通过Design-Expert V8.0.6软件,对各种因素之间的相互作用进行响应面分析。随着A(酶作用时间)、B(酶添加量)、C(酶解温度)、D(淀粉浆浓度)的增加,SDS含量(响应值)均呈现先升高后降低的趋势。作用时间曲线和BE添加量曲线具有相对陡峭的斜率,因此其对SDS含量具有显着影响;淀粉浆浓度曲线和作用温度曲线比较平滑,响应值随该值变化不大,因此对SDS含量影响很小。同时,这4个因素之间存在一定的相互作用,但交互作用不显著(P>0.05);较高的SDS含量都出现在每个因素的中心附近,这表明在这种条件下制备的慢消化玉米淀粉的慢消化率可能最好。
2.2.3 验证实验
通过Design-Expert V8.0.6软件响应面优化实验,对各工艺参数进行优化分析后,SDS质量分数预测值为37.66%,其对应的因素为酶作用时间为6.5 h,需添加BE用量为320.0 U/g,酶反应温度为75.5 ℃,淀粉浆质量分数21.0%。在最佳工艺条件下设定最佳工艺参数,并进行3次平行实验,制备酶修饰的慢消化玉米淀粉,SDS质量分数分别为37.2%、36.9%、37.7%,平均值为(37.28±0.34)%,接近模型的预测值,表明使用Box-Benhnken中心组合获得的工艺参数和响应面分析准确可靠,具有一定的应用价值。
2.3 慢消化淀粉相关性能分析
2.3.1 颗粒形貌分析
利用扫描电镜观察淀粉颗粒大小及改性前后表观特征,将样品分别于2 000和5 000倍数下进行拍摄观察。如图2所示,天然玉米淀粉颗粒大多呈棱角圆滑的多面体结构,少许呈球形,表面凹凸不平状,部分有细孔[26]。糊化处理使淀粉内部结构发生变化,结晶区被破坏,已完全失去颗粒形态。如箭头所指处,酶解后出现分布致密规则的孔洞,深入的通向内部结构,部分还出现空壳现象。
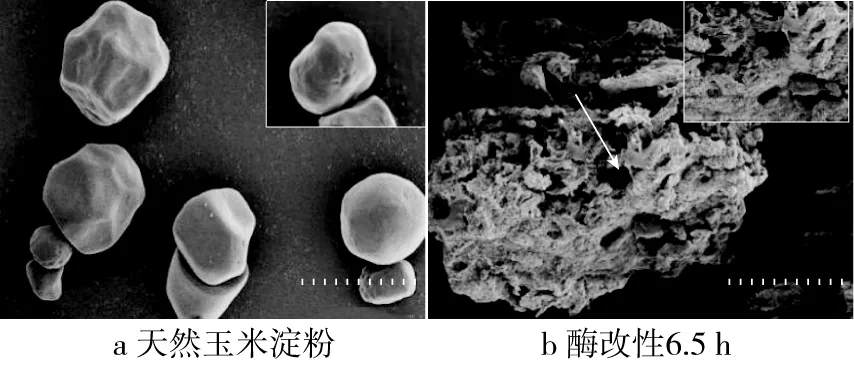
图2 天然玉米淀粉和酶改性6.5 h玉米淀粉的颗粒形貌
2.3.2 链段分布分析
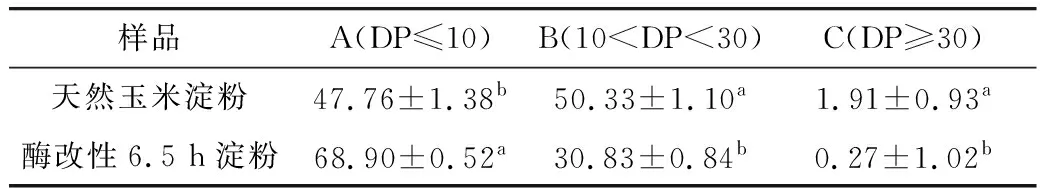
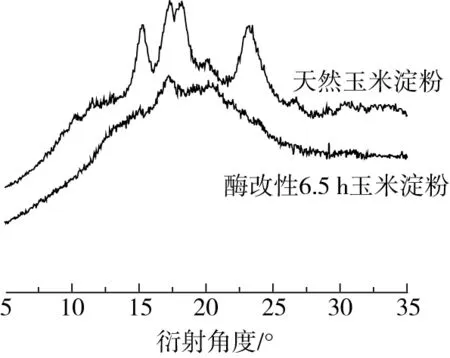
通过HPAEC-PAD对淀粉样品进行链长分布测定。对各峰进行积分处理,链段分布结果如图3所示。根据聚合度(DP)将不同长度的链段分为3个部分:A链(DP≤10),B链(10 表4 酶改性前后玉米淀粉链段分布变化 2.3.3 相对结晶度分析 天然玉米淀粉和酶改性淀粉的XRD衍射图谱如图4所示,天然玉米淀粉衍射角度2θ在15°、17.5°、19°和 23°出现了4个强度较高的特征衍射峰,这属于典型的A型晶体衍射图谱。经BE酶解6.5 h的淀粉样品,仅在17.5°和22°处有较强的衍射峰,属于标准B型晶体结构。X-衍射峰强度取决于淀粉内部双螺旋结构重排的情况以及分子链相互作用,因此酶改性淀粉衍射峰下降可能是因为酶对长链的水解转苷作用,使链段连接发生变化[28]。利用Jade 6.5软件对淀粉相对结晶度进行测定,结果显示,酶改性淀粉相对结晶度为27.11%,比天然淀粉减少了18.10%,这可能是因为脱支处理使淀粉微晶结构发生变化,长链有序结构减少,短支链结构增加,从而导致相对结晶度降低[29]。 图4 酶改性前后玉米淀粉XRD衍射图 2.3.4 溶解度与膨胀度分析 溶解度和溶胀度反映淀粉和水结合的程度,并且与淀粉的内部结构密切相关[30]。根据表5得出,天然玉米淀粉几乎不溶于水;经酶改性6.5 h的淀粉,溶解度达到29.12%,比天然玉米淀粉提高了20.50%。这可能是因为这种现象与酶水解后无定形区域的直链淀粉浸出有关,糊化破坏了淀粉结晶区域的双螺旋结构,并经酶修饰暴露了更多的氢键,亲水基团增加,水合性能增强,从而导致淀粉样品的溶解度增加。天然玉米淀粉的膨胀度为23.58%,酶改性6.5 h后的膨胀度为12.35%,降低了11.23%。 这归因于BE可以催化α-1,4-糖苷键断裂,增加分支点比例,使质点间结合能力增强从而降低膨胀速率。 表5 酶改性前后淀粉溶解度和膨胀度的变化 2.3.5 体外消化性能分析 根据淀粉的体内消化速率,可将淀粉分为快消化淀粉、慢消化淀粉、抗性淀粉。以天然玉米淀粉为底物进行酶法修饰,利用体外模拟消化对所得改性淀粉的消化性能进行分析。如表6所示,天然玉米淀粉含有较高的RDS,SDS质量分数仅有23.12%。随着酶作用时间的增加,RDS含量下降,SDS和RS含量有了显著提高。酶改性6.5 h,SDS和RS质量分数分别增加了14.01%和5.43%,可能是因为酶改性不仅增加淀粉短链数量、缩短链长,还增加短簇链段的分支度,降低淀粉多尺度结构,增加α-1,6-糖苷键比例,从而有助于慢消化性能的提高。 表6 酶改性前后淀粉消化性能的变化 根据中心组合设计原理,在单因素实验的基础上,设计4因素3水平的响应面优化实验,并以酶作用时间6.5 h、BE添加量为320 U/g、酶解温度为75.5 ℃、淀粉浆质量分数21%为条件,得到酶法改性玉米慢消化淀粉的最佳制备工艺条件。在此条件下制备的SDS的质量分数为37.28%,接近预测值37.66%。研究结果表明,SDS含量与淀粉精细结构密切相关。观察其微观结构,发现具有较高慢消化速率的淀粉颗粒表面在酶水解6.5 h后均出现致密规则的孔洞,这为酶水解提供了孔道结构。通过观察其精细结构,发现具有较高SDS含量的改性淀粉短链比例较高和相对结晶度较低,这表明酶的转糖基化可以使淀粉产生具有较高支链和短链的有序结构,促使消化性能降低,经酶改性后的玉米淀粉具有良好的溶解性和膨胀性。


3 结论

