细胞外囊泡装载多柔比星对人膀胱癌BIU-87 细胞增殖及凋亡的影响*
马燕凌,晏 菲,魏武杰,邓 洁,李 黎,刘 莉,孙建海
(江汉大学附属湖北省第三人民医院肿瘤科,湖北 武汉 430000)
膀胱癌(BC)是泌尿生殖系统常见恶性肿瘤,超70%的膀胱癌为非肌层浸润性膀胱癌(NMIBC)[1]。临床治疗NMIBC 常先行经尿道膀胱肿瘤切除术,然后以多柔比星行膀胱内化学药物治疗(简称化疗)。然而,随着NMIBC 分期和分级的增长,复发率超过50%[2]。膀胱内化疗与静脉内输注化疗药物一样,不能完全消除癌细胞,同时,由于其靶向性差、副作用多等缺点,限制了多柔比星的疗效[3]。近年来,细胞外囊泡(EVs)在肿瘤进展和治疗中的作用引起了广泛关注[4]。细胞能释放不同大小的微囊泡,在受到刺激后,细胞改变其骨架,导致胞质内容物被包裹在细胞膜中,形成囊泡,随后被释放到细胞外空间,通过在细胞间转移生物活性和功能活性蛋白及RNA 来介导细胞间通信[5]。载药囊泡是肿瘤细胞来源的EVs经过特殊处理,与常规化疗药物有机结合,形成以囊泡为载体的载药微颗粒,具有靶向性和特异性高及副作用小等特点[6]。同时,β −连环蛋白(β −catenin)/ Notch1 通路与膀胱癌、前列腺癌和乳腺癌的转移相关,对细胞的分化、增殖和凋亡有显著影响[7]。因此,本研究中探讨了EVs 装载多柔比星对人膀胱癌BIU −87 细胞增殖和凋亡的影响,及β −catenin/Notch1 通路在其中的作用,为膀胱癌的临床治疗提供新的理论依据。现报道如下。
1 材料与方法
1.1 仪器、试药与细胞
仪器:240i型CO2培养箱(美国Thermo Revco公司);Z36HK 型高速冷冻离心机(德国Hermle 公司);TE2000 −U + DXM1200 型倒置显微镜(日本Nikon 公司);BS −1096B 型酶标仪(南京德铁实验设备有限公司);Real −time PCR 扩增仪(美国ABI 公司);BD FACSCanto 型流式细胞仪和BD 垂直电泳仪(美国BD 公司);Tanon 1600型凝胶成像系统(上海天能科技有限公司)。
试药:多柔比星(齐鲁制药有限公司,批号为2020064);RPMI −1640 培养基、胎牛血清(FBS,浙江天杭生物科技有限公司);PKH67试剂盒(美国Sigma公司);四甲基偶氮唑盐(MTT,美国Amresco 公司);膜联蛋白(Annexin)V/碘化丙啶(PI)细胞凋亡检测试剂盒(美国BD 公司);Trizol(美国Invitrogen公司);cDNA反转录试剂盒和实时荧光聚合酶链式反应(RT −PCR)试剂盒(瑞士Roche 公司);RIPA 裂解液和Western blot 相关试剂(北京索莱宝生物技术公司);糖原合成酶激酶−3β(GSK −3β)、β −catenin、Notch1、β −actin抗体和HRP标记山羊抗鼠IgG二抗(上海碧云天生物技术有限公司)。
细胞:人膀胱癌BIU −87 细胞(中国科学院典型培养物保藏委员会细胞库)。
1.2 方法
1.2.1 细胞培养和EVs 提取
在37 ℃、5% CO2条件下用含10% FBS 的RPMI −1640 培养基培养BIU −87 细胞,隔天换液,当细胞处于对数生长期时进行后续试验。将60 mL 含2% FBS 的培养基离心(30 900 r/min)过夜,去除血清中的EVs,用此培养基培养BIU −87细胞(约5×107个),48 h内收集上清,1 200 r/ min 离心10 min,经0.45 μm 过滤器过滤;4 000 r / min 离心30 min,经0.22 μm 过滤器过滤;30 900 r/ min 离心70 min,将沉淀溶于磷酸盐缓冲液(PBS),即得EVs混悬液。
1.2.2 载药囊泡制备
取多柔比星30 μg,溶于1 mL EVs 混悬液中,在37 ℃恒温培养箱中孵育1 h,9 168 r/ min 离心10 min,经0.22 μm 过滤器过滤;30 900 r/ min 离心70 min,将沉淀溶于PBS,即得载药囊泡混悬液。
1.2.3 观察指标与检测
细胞摄取EVs情况:向EVs混悬液和载药囊泡混悬液中分别加入4 μL PKH67稀释液,混匀,静置3 min,用PBS终止染色,经0.22 μm过滤器过滤;30 900 r/min离心70 min,将沉淀溶于PBS,即得PKH67 标记的EVs 和PKH67 标记的载药囊泡。取对数生长期BIU −87 细胞,以5 × 103个/ 孔接种于96 孔板中(每孔200 μL),待细胞融合后分别加入PKH67标记的EVs和PKH67标记的载药囊泡,静置24 h,显微镜下观察细胞摄取情况。
细胞增殖率:采用MTT 法。实验分为空白对照组(不进行处理)、EVs 组(EVs 混悬液,100 个/ 细胞)、多柔比星组(0.3 μg 多柔比星)、载药囊泡组(载药囊泡混悬液,100个/细胞),以相应方法处理细胞,44 h后加入MTT(每孔50 μL),继续培养4 h,加入二甲基亚砜(每孔200 μL),缓慢振荡10 min,用酶标仪在490 nm 波长处检测各孔吸光度(OD)值,计算细胞增殖率。细胞增殖率=OD实验组/OD空白对照组。
细胞凋亡率:采用流式细胞法。按“细胞增殖率”项下分组及处理细胞,48 h后收获细胞,用预冷PBS洗涤,1 000 r/min离心10 min,弃上清,分别加入5 μL Annexin V −FITC 与PI,充分混匀后室温避光孵育20 min,以流式细胞仪检测细胞凋亡情况。
细胞中GSK −3β,β −catenin 和Notch1 mRNA 表达:采用RT −PCR法。按“细胞增殖率”项下分组及处理细胞,48 h 后收获细胞,加入Trizol 提取总RNA,反转录制备cDNA。反应条件为,95 ℃预变性4 min,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,40个循环;72 ℃延伸7 min。读取循环阈值(Ct值),以2-ΔΔCt表示GSK −3β,β −catenin 和Notch1 mRNA 的表达量(以β −actin 为内参)。
细胞中GSK −3β,β −catenin 和Notch1 蛋白表达:采用Western blot 法。按“细胞增殖率”项下分组及处理细胞,48 h 后收获细胞,各组分别加入100 μL RIPA 裂解液,进行电泳(每孔20 μg),转膜,加入GSK −3β(1∶200)、β −catenin(1∶400)和Notch1(1∶400)抗体孵育(4 ℃过夜);用HRP 标记山羊抗鼠IgG 二抗(1∶5 000)在室温下孵育30 min,显色、采集图像并分析(以β −actin 为内参)。
1.3 统计学处理
采用SPSS 23.0 统计学软件分析。计量资料以±s表示,行单因素方差分析,多重比较采用SNK −q检验。P <0.05为差异有统计学意义。

A.空白对照组 B.EVs组 C.多柔比星组 D.载药囊泡组图2 载药囊泡对BIU-87细胞增殖的影响A.Blank control group B.EVs group C.Doxorubicin group D.Drug −loaded vesicle groupFig.2 Effect of drug-loaded vesicles on the proliferation of BIU-87 cells
2 结果
2.1 BIU-87 细胞摄取EVs 情况
EVs 组和载药囊泡组BIU −87 细胞内PKH67 标记的团块状绿色荧光均匀,提示BIU −87细胞可摄取EVs和载药囊泡。详见图1。
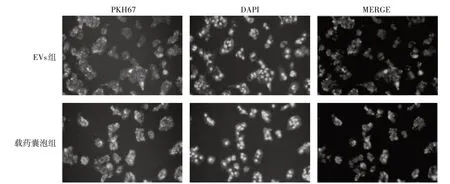
图1 BIU-87细胞摄取EVs和载药囊泡情况Fig.1 The uptake of EVs and drug - loaded vesicles by BIU-87 cells
2.2 细胞增殖率及凋亡率
与空白对照组比较,EVs组细胞增殖率及细胞凋亡率无显著差异(P>0.05);与空白对照组及EVs 组比较,多柔比星组和载药囊泡组细胞增殖率显著降低、细胞凋亡率显著升高,且载药囊泡组更优(P<0.05)。详见图2和表1。
表1 各组细胞增殖率和凋亡率比较(±s,%,n=3)Tab.1 Comparison of proliferation rate and apoptosis rate of BIU-87 cells in each group(±s,%,n=3)

表1 各组细胞增殖率和凋亡率比较(±s,%,n=3)Tab.1 Comparison of proliferation rate and apoptosis rate of BIU-87 cells in each group(±s,%,n=3)
注:与空白对照组比较,aP <0.05;与EVs组比较,bP <0.05;与多柔比星组比较,cP <0.05。表2及表3同。Note:Compared with those in the blank control group,aP <0.05;Compared with those in the EVs group,bP < 0.05;Compared with those in the doxorubicin group,cP <0.05(for Tab.1 −3).
组别空白对照组EVs组多柔比星组载药囊泡组细胞增殖率100.00±9.42 97.58±14.36 76.10±6.82ab 57.42±7.69abc细胞凋亡率1.84±0.27 2.29±0.49 5.78±0.82ab 9.30±0.75abc
2.3 GSK-3β,β-catenin 和Notch1 mRNA 表达水平
与空白对照组比较,EVs 组细胞中GSK −3β、β −catenin和Notch1 mRNA表达水平无显著差异(P>0.05);与空白对照组及EVs组比较,多柔比星组和载药囊泡组细胞中GSK −3β mRNA 表达水平显著升高、β −catenin和Notch1 mRNA 表达水平显著降低,且载药囊泡组更优(P<0.05)。详见表2。
表2 各组细胞中GSK-3β、β-catenin和Notch1 mRNA表达水平比较(±s,n=3)Tab.2 Comparison of GSK-3β,β-catenin and Notch1 mRNA expression levels in cells in each group(±s,n=3)

表2 各组细胞中GSK-3β、β-catenin和Notch1 mRNA表达水平比较(±s,n=3)Tab.2 Comparison of GSK-3β,β-catenin and Notch1 mRNA expression levels in cells in each group(±s,n=3)
组别空白对照组EVs组多柔比星组载药囊泡组GSK −3β 1.00±0.15 0.96±0.11 1.32±0.08ab 1.56±0.13abc β −catenin 1.00±0.07 1.04±0.13 0.87±0.09ab 0.72±0.10abc Notch1 1.00±0.14 0.98±0.07 0.85±0.11ab 0.70±0.10abc
2.4 GSK-3β,β-catenin 和Notch1 蛋白表达水平
与空白对照组比较,EVs 组细胞中GSK −3β、β −catenin和Notch1 蛋白表达水平无显著差异(P>0.05);与空白对照组及EVs组比较,多柔比星组和载药囊泡组细胞中GSK −3β 蛋白表达水平显著升高、β −catenin和Notch1 蛋白表达水平显著降低,且载药囊泡组更优(P<0.05)。详见表3。
表3 各组细胞中GSK-3β,β-catenin和Notch1蛋白表达水平比较(±s,n=3)Tab.3 Comparison of GSK-3β,β-catenin and Notch1 protein expression levels in cells in each group(±s,n=3)

表3 各组细胞中GSK-3β,β-catenin和Notch1蛋白表达水平比较(±s,n=3)Tab.3 Comparison of GSK-3β,β-catenin and Notch1 protein expression levels in cells in each group(±s,n=3)
组别空白对照组EVs组多柔比星组载药囊泡组GSK −3β 0.42±0.09 0.45±0.13 0.73±0.06ab 0.89±0.10abc β −catenin 0.38±0.05 0.38±0.06 0.25±0.04ab 0.13±0.03abc Notch1 0.49±0.06 0.46±0.07 0.30±0.05ab 0.08±0.03abc
3 讨论
NMIBC 具有易侵犯、易转移、易耐药和复发率高等特点,故急需新疗法来增强NMIBC 对膀胱内化疗的敏感性。EVs 是细胞释放的囊泡状结构,可被癌细胞有效吸收,使EVs 装载化疗药物作用于癌细胞成为可能[8]。研究表明,载药囊泡是以癌细胞来源的EVs作为化疗药物载体,携带化疗药物,可将药物输入癌细胞内,具有极强的癌细胞亲和力及较好的靶向性[9]。多柔比星是NMIBC 术后膀胱内化疗的首选药物,通过抑制DNA 拓扑异构酶Ⅱ活性,诱导癌细胞凋亡,但其在体内缺乏特异性且清除过快,降低了化疗有效性[10]。本研究中通过EVs 装载多柔比星给药,升高了BIU −87 细胞凋亡率,降低了其增殖率,提示载药囊泡可作为理想的敏化剂,增强化疗药物对膀胱癌细胞的杀伤力。同时,膀胱上皮属移行上皮,其结构中有一层圆顶状细胞的浅层,这一结构细胞排列在管腔表面,作为管腔和血流间不可穿透的屏障,可抑制载药囊泡进入更深的细胞层。然而,这种物理屏障可能由于其不规则的组织结构而在膀胱癌组织中被破坏,使载药囊泡进入膀胱癌细胞[11]。本研究中主要关注了载药囊泡对BIU −87细胞的作用,其对正常膀胱细胞的作用将在后续的研究中完善。
β −catenin/ Notch1 通路参与哺乳动物胚胎发育、器官发生、细胞凋亡及各种癌细胞迁移的调节[12]。与β −catenin/Notch1 通路中的正向调节因子β −catenin不同,GSK −3β 属负调控因子,GSK −3β 磷酸化β −catenin 的氨基端丝氨酸/苏氨酸,从而下调β −catenin在细胞质中的表达,阻断β −catenin/Notch1 通路的激活,减弱β −catenin/Notch1通路对凋亡的抑制,促进细胞凋亡[13]。作为β −catenin/Notch1 通路的下游信号因子,Notch1已被证明是BC的肿瘤促进因子,Notch1过表达促进了上皮间质转化的进程[14]。在鼻咽癌中,抑制Notch −1 可增加Kruppel 样因子4(KLF4)的表达,从而减少鼻咽癌细胞增殖和抑制肿瘤形成[15]。同时,转染Notch1 siRNA 的细胞增殖率明显低于转染Notch1 的细胞[16]。由于增殖与化疗抗性有关,开发针对抗增殖的调节剂,可获得新的化疗增敏剂[17−18]。本研究结果显示,载药囊泡抑制β −catenin/Notch1通路的作用明显强于单用多柔比星。因此,β −catenin/Notch1通路下调可能为抑制BC 细胞增殖提供了一个靶点,具有潜在的临床意义。
综上所述,EVs 装载多柔比星抑制BIU −87 细胞增殖和促进其凋亡的作用较单用多柔比星强,其机制可能与抑制β −catenin/Notch1信号通路有关。

