四氢姜黄素经PI3K/Akt信号通路对人血小板活化和聚集的调控作用
马永洁,李玮琪,张春梅,普 俊,牙甫礼,3,*
(1.大理大学公共卫生学院,云南 大理 671000;2.河口海关,云南 河口 661300;3.大理大学代谢性疾病转化医学研究院,云南 大理 671000)
心血管疾病已经成为全球范围内致死率最高的疾病。血小板作为动脉粥样硬化和血栓形成的关键细胞介质,在心血管疾病的进展中起着至关重要的作用。在某些病理情况下,如高脂血症、冠心病等,患者循环血液中的血小板可被凝血酶和二磷酸腺苷等可溶性激动剂激活,活化的血小板会释放一系列的内容物,进而参与促进动脉粥样硬化和血栓形成和发展。这些内容物主要分为3 类,包括α颗粒、致密颗粒和溶酶体颗粒。其中,血小板α颗粒的含量最为丰富,包括膜结合蛋白CD62P、CD40L等,以及可溶性蛋白如血小板因子-4(platelet factor-4,PF4)、趋化因子配体-5(chemokine ligand 5,CCL5)、-球蛋白等,这些炎症分子可促进血小板聚集,募集并活化白细胞。此外,ATP、二磷酸腺苷、钙离子和焦磷酸盐是致密颗粒的重要内容物,对于介导血小板-白细胞-内皮细胞间的炎症反应起重要作用。血小板溶酶体颗粒可通过膜蛋白(如CD63)和一些水解酶(如葡萄糖苷酶和半乳糖苷酶等)参与血小板的活化和聚集。大量的研究证实,控制血小板活化是抑制动脉粥样硬化和血栓形成、防治心血管疾病发生发展的有效策略之一。
膳食营养干预是预防心血管疾病发生发展的关键途径之一。姜黄素是一种天然活性多酚类化合物,主要来源于姜科植物根茎。研究表明,姜黄素具有抗氧化、抗炎、抗癌和保护心血管等多种生物学活性。然而,膳食补充姜黄素时,其生物利用度较低(通常小于1%),这是限制其临床应用的主要因素之一。研究表明,姜黄素经口摄入后,在肠道微生物的作用下迅速转化为各种代谢物,例如二氢姜黄素、四氢姜黄素(tetrahydrocurcumin,THC)、六氢姜黄素、八氢姜黄素等。其中,THC被认为是最重要、也是活性最高的肠道代谢物,由于具有较高的生物利用度和稳定性,THC可能有潜力开发成为预防或者治疗许多慢性疾病的重要物质。本课题组前期的动物实验也表明,膳食补充THC在缓解小鼠过敏性哮喘方面要优于姜黄素。在血小板功能的调控方面,Mayanglambam等研究发现,姜黄素在体外能抑制血小板的活化;本课题组前期的体外实验也表明姜黄素可抑制过氧化氢诱导的血小板凋亡。但是,THC对血小板活化和聚集的影响尚不清楚,本研究旨在探讨THC对人血小板活化和聚集的影响及其可能的分子机制。
1 材料与方法
1.1 材料与试剂
THC、凝血酶、Fluo-4/AM、荧光素酶试剂美国Sigma-Aldrich公司;FITC偶联的鼠抗人CD62P抗体、FITC偶联的鼠抗人CD63抗体、CCL5酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒 美国eBioscience公司;PF4商用ELISA试剂盒美国R&D Systems公司;细胞毒性检测试剂盒美国Roche公司;磷酸肌醇-3-激酶(phosphoinositide 3-kinase,PI3K)、一抗phospho-PI3K(Tyr)、phospho-Akt(Ser)、Akt、-actin、二抗羊抗兔美国Cell Signaling Technology公司;PI3K的激动剂740 Y-P 美国Selleck Chemical公司;琼脂糖凝胶CL-2B美国Sigma公司。
1.2 仪器与设备
低温冰箱 青岛海尔有限公司;CytoFlex流式细胞仪 美国Beckman Coulter公司;低温高速离心机德国Eppendorf公司;多功能酶标仪 德国BMG LABTECH公司;血小板聚集仪 北京泰利康信科技有限公司。
1.3 方法
1.3.1 研究对象的筛选
研究对象从大理大学校内招募,要求是年龄在25~40 岁之间的健康成人。如果志愿者现在或曾经患有心血管疾病、恶性肿瘤、免疫缺陷病等病史,或滥用药物、酗酒、吸烟半年以上,或在两周内服用过抗血小板的药物(如阿司匹林等),或补充维生素等膳食营养补充剂,则不被纳入作为本研究的研究对象。所有志愿者均自愿参与该项目,并均签署书面知情同意书。
1.3.2 健康人血样及纯化血小板的制备过程
在清晨空腹状态下,通过静脉穿刺的方法,抽取并制备枸橼酸钠抗凝全血,然后300×、22 ℃离心7 min,血液分3 层,从下往上依次为红细胞层、白细胞层和富血小板血浆层,为了避免吸到白细胞层,小心吸取并收集上层约2/3的富血小板血浆。将富血小板血浆慢慢滴入装有琼脂糖凝胶CL-2B的层析柱,可从富血小板血浆中分离得到纯度高(98%以上)、结构完整的纯化血小板(即血小板悬液),具体方法参照文献[10,22-23]。本研究完全按照《赫尔辛基宣言》相关准则进行,并已通过大理大学伦理委员会的批准。
1.3.3 血小板乳酸脱氢酶漏出率的测定
采用细胞毒性检测试剂盒测定血小板乳酸脱氢酶(lactate dehydrogenase,LDH)的漏出率,并以该指标来评价THC对血小板细胞毒性的影响。首先,取健康人纯化血小板与不同浓度的THC(0.1、0.5、1、5、10、20、40、80、160、320 μmol/L,溶剂为0.05%二甲基亚砜(dimethyl sulfoxide,DMSO)或溶剂对照(0.05%DMSO)预孵育40 min,然后离心(12 000×、5 min、22 ℃),用酶标仪测定上清液在490 nm波长处的吸光度()。同时,将10%的十二烷基硫酸钠(sodium dodecyl sulphate,SDS)作为阳性对照组,也与血小板共同孵育40 min,用来刺激血小板全部释放LDH,相同条件下测定490 nm波长处的吸光度()。血小板LDH漏出率按式(1)计算。

1.3.4 实验分组
本研究涉及的实验组别有:1)静息组:指不经任何处理的血小板悬液,既不经凝血酶激活,也不经DMSO处理;2)模型组:即溶剂对照组(血小板悬液中加入0.05% DMSO,下同);3)THC组:血小板悬液中分别加入0.5、1、10 μmol/L THC。除了静息组以外,模型组和THC组的血小板均经凝血酶诱导活化。
1.3.5 流式细胞术测定血小板表面CD62P和CD63的表达量
纯化血小板(5×10个/mL)与不同浓度的THC(0.5、1、10 μmol/L)或溶剂对照在室温下共同孵育40 min,用FITC偶联的鼠抗人CD62P抗体或CD63抗体标记血小板20 min,然后在1 mmol/L Ca存在的条件下,用凝血酶(酶活力不低于2 000 NIH Units/mg蛋白)激活血小板2 min,而静息组血小板无需凝血酶激活,然后用体积分数1%的多聚甲醛溶液固定,最后利用CytoFLEX流式细胞仪测定血小板表面CD62P和CD63的表达量。
1.3.6 血小板PF4和CCL5释放量的测定
用PF4和CCL5的商业ELISA试剂盒测定血小板PF4和CCL5的释放水平,具体方法参照制造商提供的说明书进行。纯化血小板(1×10个/mL)与不同浓度的THC(0.5、1、10 μmol/L)或溶剂对照预孵育40 min,然后在1 mmol/L Ca存在的条件下用0.5 U/mL的凝血酶激活血小板2 min。在12 000×、4 ℃的条件下离心5 min,收集上清液,用ELISA试剂盒的方法测定上清液中PF4和CCL5水平。当探讨PI3K/Akt信号通路在THC调控PF4和CCL5释放中的作用时,实验设置4个组,即静息组、模型组、THC(10 μmol/L)组以及THC+740 Y-P组,其中THC+740 Y-P组为THC(10 μmol/L)和PI3K的激动剂740 Y-P(25 µg/mL)与血小板共同孵育40 min,除了静息组外,各组血小板用凝血酶激活,然后分别检测这4个组中血小板PF4和CCL5的释放水平。
1.3.7 血小板ATP释放量和血小板最大聚集率的测定
将人纯化血小板(2.5×10个/mL)与不同浓度的THC(0.5、1、10 μmol/L)或溶剂对照预处理40 min,然后加入荧光素酶试剂与血小板共同孵育2 min,在1 mmol/L Ca存在的条件下用0.5 U/mL的凝血酶激活血小板,利用血小板聚集仪记录ATP释放量和血小板最大聚集率,THC组聚集抑制率按公式(2)计算,由自带软件生成THC组聚集抑制率(与模型组相比)随THC浓度变化的曲线并计算出血小板最大聚集的半数抑制率。具体方法参照文献[24]。探讨PI3K/Akt信号通路在THC调控血小板聚集中的作用时,实验设置5个组,即静息组、模型组、THC(10 μmol/L)组、740 Y-P组以及THC+740 Y-P组,其中740 Y-P组为血小板悬液用PI3K的激动剂740 Y-P(25 µg/mL)孵育40 min,THC+740 Y-P组为THC(10 μmol/L)和740 Y-P(25 µg/mL)一同与血小板共同孵育40 min,除了静息组外,各组血小板用凝血酶激活,然后检测血小板最大聚集率。

1.3.8 血小板胞内钙离子浓度的测定
将纯化血小板悬液与Fluo-4/AM(0.2 μg/mL)在37 ℃避光孵育30 min 后,离心(3 000×、5 min、37 ℃)沉淀血小板,洗涤后重悬血小板,调整血小板浓度至3×10个/mL,然后与不同浓度的THC在37 ℃避光孵育40 min,使用0.5 U/mL的凝血酶激活血小板2 min,然后利用酶标仪在激发波长为488 nm、发射波长为520 nm的条件下进行荧光强度的测定,并计算各组的荧光强度与静息组的荧光强度的比值(即Fluo-4荧光强度比值),以此表征血小板内钙离子浓度。
1.3.9 免疫印迹法检测蛋白表达
将人纯化血小板(2.5×10个/mL)与不同浓度的THC(0.5、1、10 μmol/L)或溶剂对照在体外共同孵育40 min,在1 mmol/L Ca存在的条件下用0.5 U/mL的凝血酶激活血小板5 min后,离心(12 000×、15 min、4 ℃),弃上清液,在冰上用细胞裂解液对血小板裂解30 min,然后离心(12 000×、15 min、4 ℃),收集上清液得到血小板蛋白,测定蛋白浓度后,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,检测血小板PI3K、Akt蛋白及其磷酸化表达水平。
1.4 数据统计与分析
实验结果用平均值±标准误表示,用SPSS 20.0统计软件通过单因素方差分析进行多组间比较,采用Newman-Keuls test法进行组间两两比较,双侧<0.05表示差异具有统计学意义;同时采用GraphPad Prism 5.0软件制图。所有实验的数据统计结果至少来自3个独立的志愿者样本。
2 结果与分析
2.1 THC对血小板细胞毒性的影响
如图1所示,与阳性对照组(10% SDS)相比,溶剂对照组(0.05% DMSO)以及不同浓度的THC(0.1~320 μmol/L)组中血小板的LDH漏出率高度显著降低(<0.001)。THC在0.1~80 μmol/L的浓度范围内LDH漏出率与溶剂对照组相比无显著差异(>0.05),因此可以认为,在这个浓度范围内,THC对健康人纯化血小板无明显的细胞毒性作用。但是160 μmol/L和320 μmol/L浓度的THC呈现显著的细胞毒性作用,因为其LDH漏出率与对照组相比显著或极显著升高(<0.05、<0.01)。另外,综合对比其他研究报道中所用THC浓度,最终选择0.5、1 μmol/L和10 μmol/L进行后续的实验。

图1 THC对血小板细胞毒性的影响Fig. 1 Cytotoxic effect of THC on platelets
2.2 THC对血小板CD62P的表达量以及PF4和CCL5释放量的影响
如图2A所示,流式细胞术结果表明,与模型组相比,1 μmol/L和10 μmol/L浓度的THC可分别显著(<0.05)和高度显著(<0.001)抑制凝血酶诱导的血小板表面CD62P的表达,低浓度(0.5 μmol/L)的THC并不能显著抑制CD62P的表达(>0.05)。如图2B、C所示,与模型组相比,凝血酶诱导的血小板PF4的释放水平也被1 μmol/L和10 μmol/L浓度的THC显著抑制(<0.05、<0.001);10 μmol/L浓度的THC可极显著抑制凝血酶诱导的血小板CCL5的分泌(<0.01)。以上实验说明中、高浓度THC可抑制凝血酶诱导的血小板α颗粒的释放。
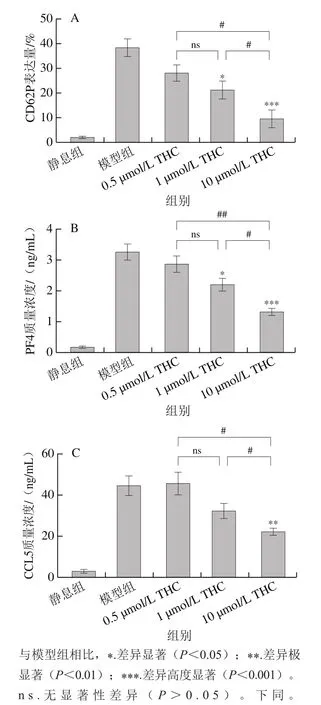
图2 THC对血小板表面CD62P表达量(A)以及PF4(B)和CCL5(C)释放的影响Fig. 2 Effect of THC on platelet surface expression of CD62P (A) and the release of PF4 (B) and CCL5 (C)
2.3 THC对血小板ATP释放量和胞内钙离子浓度的影响
如图3所示,与模型组相比,1 μmol/L和10 μmol/L浓度的THC可极显著降低凝血酶诱导的血小板ATP释放水平和胞内钙离子浓度(<0.01),但是0.5 μmol/L的THC并不能显著降低ATP释放量和胞内钙离子浓度(>0.05)。THC对ATP释放水平和胞内钙离子的抑制作用在1 μmol/L浓度组和10 μmol/L浓度组间无统计学差异(>0.05)。以上结果说明中、高浓度THC可抑制凝血酶诱导的血小板致密颗粒的释放。
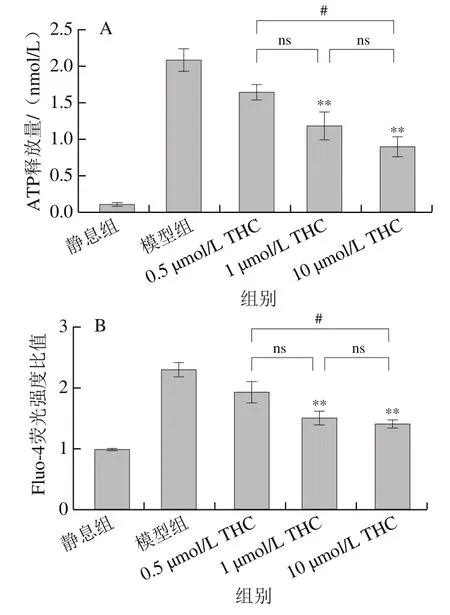
图3 THC对血小板ATP释放量(A)和胞内钙离子浓度(B)的影响Fig. 3 Effect of THC on platelet ATP release (A) and intracellular calcium concentrations (B)
2.4 THC对血小板CD63表达的影响
如图4所示,流式细胞术分析结果表明,凝血酶可明显促进血小板表面CD63的表达,10 μmol/L浓度的THC高度显著抑制血小板表面CD63的表达(<0.001),但是0.5 μmol/L和1 μmol/L浓度的THC并不能显著抑制CD63的表达(>0.05)。以上结果说明10 μmol/L THC可抑制凝血酶诱导的血小板溶酶体颗粒的释放。

图4 THC对血小板表面CD63表达的影响Fig. 4 Effect of THC on platelet surface expression of CD63
2.5 THC对血小板聚集的影响
如图5A所示,与模型组相比,1 μmol/L和10 μmol/L的THC均可高度显著降低凝血酶诱导的血小板最大聚集率(<0.001),而且两组的血小板最大聚集率之间无显著差异(>0.05)。0.5 μmol/L的THC对血小板最大聚集率与模型组相比无显著差异(>0.05)。THC在0.1~20 μmol/L浓度范围内对血小板最大聚集抑制率的影响见图5B,THC在0.5~10 μmol/L浓度范围内,血小板最大聚集抑制率随着浓度的增加而升高,THC抑制血小板最大聚集的半数抑制浓度为(0.74±0.03)μmol/L。
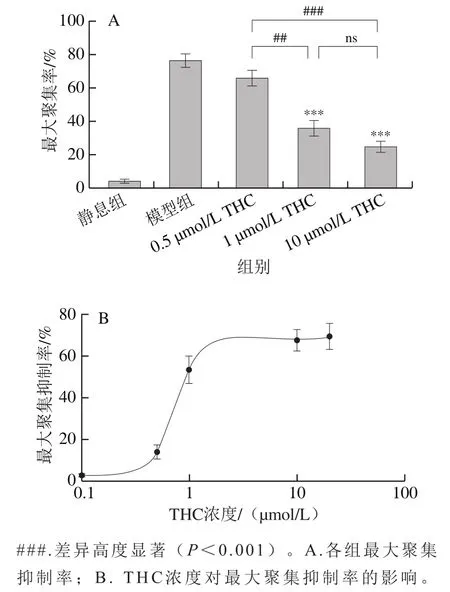
图5 THC对血小板聚集的影响Fig. 5 Effect of THC on platelet aggregation
2.6 THC对血小板PI3K/Akt信号通路活化的影响
如图6所示,凝血酶可明显促进血小板PI3K(Tyr)和Akt(Ser)发生磷酸化。与模型组相比,0.5、1 μmol/L和10 μmol/L的THC均可显著下调凝血酶诱导的血小板PI3K的磷酸化水平(<0.01、<0.001、<0.001),其中1 μmol/L和10 μmol/L THC两组间则无显著差异(>0.05)。与模型组相比,凝血酶诱导的血小板Akt磷酸化水平可被1 μmol/L和10 μmol/L的THC所抑制(<0.05、<0.001),而且两组之间无显著差异(>0.05)。以上结果说明THC可抑制凝血酶诱导的血小板PI3K/Akt信号通路的活化。
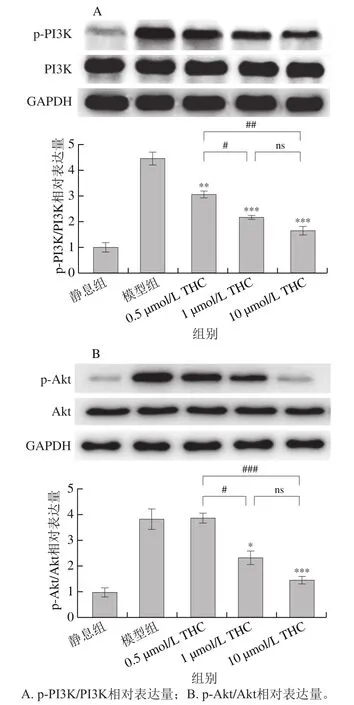
图6 THC对血小板PI3K/Akt信号通路活化的影响Fig. 6 Effect of THC on platelet PI3K/Akt signaling pathway
2.7 THC经PI3K/Akt信号通路对血小板活化和聚集的影响
如图7所示,PI3K的特异性激动剂740 Y-P可部分逆转THC对凝血酶诱导的血小板PF4和CCL5的释放和血小板聚集的抑制作用,因为THC+740 Y-P组相对于单独的THC(10 μmol/L)组血小板PF4和CCL5的释放水平以及血小板最大聚集率显著或极显著升高(<0.05、<0.01),但是相对于模型组显著降低(<0.05、<0.01)。说明THC对血小板活化和聚集的影响与其下调PI3K/Akt信号通路有关。


图7 THC经PI3K/Akt信号通路对血小板活化和聚集的影响Fig. 7 THC regulated platelet activation and aggregation through PI3K/Akt signaling pathway
3 讨 论
血小板异常活化和聚集可促进动脉粥样硬化和血栓形成,在心血管疾病的发生发展过程中发挥重要作用。膳食补充姜黄素可发挥抑制动脉粥样硬化形成和保护心血管疾病的作用,但是具体机制尚不清楚。本研究发现,姜黄素的主要肠道代谢物THC在体外可显著抑制凝血酶诱导的血小板活化和聚集,提示THC在抗血小板高反应性方面具有潜在的实用价值。
研究已经证实,心血管疾病患者循环血液中高浓度的凝血酶和二磷酸腺苷等可直接激活血小板,活化的血小板分泌大量的颗粒物质,内含有重要的炎症因子,这些因子是介导血小板-白细胞-内皮细胞间相互作用的关键介质。例如,活化的血小板表面可表达大量的CD62P,CD62P是α颗粒中最重要的分子之一,它可通过与白细胞和内皮细胞表面的P-选择素糖蛋白配体-1(P-selectin glycoprotein ligand-1,PSGL-1)相结合发挥直接与白细胞和内皮细胞相互黏附的作用,进而使白细胞和内皮细胞发生活化,并促进其凋亡,这对于血小板促进早期的动脉粥样硬化血栓形成极为关键。研究表明,血小板基因敲除小鼠的动脉粥样硬化和血栓形成量显著减少,这与基因敲除小鼠中血小板-白细胞-内皮细胞间的相互黏附受到抑制密切相关。另外,血小板分泌的PF4和CCL5可促进血小板活化和聚集,并能募集单核细胞到达损伤的血管内皮处,并促进内皮细胞活化和分化。Mayanglambam等通过体外研究发现,姜黄素可显著抑制胶原诱导的血小板表面CD62P的表达和血小板聚集反应,但是其肠道代谢物THC对血小板活化和聚集的影响尚鲜见报道。本研究结果表明,THC可显著抑制血小板活化,如抑制凝血酶诱导的血小板表面CD62P和CD63的表达,同时抑制血小板PF4、CCL5和ATP的释放。这些对于THC抑制动脉粥样硬化和血栓形成,以及防治心血管疾病发展可能具有重要意义,但是在体内实验中,THC对血小板活化和聚集、血小板-白细胞-内皮细胞间相互作用和动脉粥样硬化血栓形成的影响仍值得进一步探讨。
调控血小板活化和聚集的分子机制错综复杂,研究表明,PI3K/Akt信号通路在其中起重要作用。当血小板受到激动剂激活时,引起胞内钙离子浓度升高,进而促进下游PI3K/Akt信号通路的活化,从而进一步激活血小板整合素αIIbβ3的活化,引起血小板颗粒物的释放和血小板聚集增加。通过敲除血小板基因或者,则使血小板不能很好地发生活化和聚集。PI3K/Akt信号通路在THC抑制肿瘤细胞增殖和分化中起重要作用,但是其在THC调控血小板功能方面的机制尚不清楚。本研究发现THC可显著降低模型组胞内钙离子浓度,并下调PI3K和Akt的磷酸化水平,而且PI3K的特异性激动剂740 Y-P可部分逆转THC对血小板活化和聚集的抑制作用,证明THC抑制血小板活化和聚集与其下调PI3K/Akt信号通路有关,同时也说明其他信号通路也可能参与其中。之前的研究表明,姜黄素可通过糖蛋白VI(glycoprotein VI,GPVI)/脾源性酪氨酸蛋白激酶(spleen tyrosine kinase,Syk)/磷脂酶Cγ(phospholipase Cγ,PLCγ)信号通路抑制胶原诱导的血小板活化和聚集,而THC是否也对这条信号通路起调控作用需要今后的实验进一步证实。
本课题组之前的动物实验发现,每天以800 mg/kg饲料的剂量给小鼠膳食补充姜黄素和THC,喂养25 d后,姜黄素组和THC组小鼠血浆中THC的浓度分别为0.2 μmol/L和0.9 μmol/L,而且在这个剂量下,小鼠未观察到明显的毒副反应。本实验根据体外细胞毒性实验结果和之前的动物实验中小鼠血浆的THC浓度,选择的THC浓度范围为0.5~10.0 μmol/L,该浓度范围涵盖生理剂量和药理剂量,并且与其他报道的体外研究中所使用的THC浓度接近。日常生活中经常食用咖喱的人群中,姜黄素的日摄入量可达10 g,而THC作为姜黄素的主要肠道代谢物,其对人体的安全性可以确定。本研究发现THC可抑制血小板活化和聚集,在体内实验中,膳食补充THC是否影响凝血过程仍值得深入探讨;另外,THC是否有望开发成为安全的抗血小板药物也需更多的实验证实。目前国内外在THC量化生产方面进行了不断地探索,其体外合成途径主要有化学合成和生物合成。在化学合成方法中,主要是通过利用姜科植物姜黄根茎中分离出的姜黄素进行氢化而得到,或者采用新型催化剂在室温下直接将姜黄素还原为THC,此方法适用于工业化生产。在生物合成方法中,有酵母生物转化法和大肠杆菌合成法等。目前微生物转化法进行THC的生产已成为研究的热点,它可能成为今后提高THC工业化生产的重要途径。
本研究发现姜黄素的肠道代谢物THC能够显著抑制凝血酶诱导的人血小板活化和聚集,其机制可能与抑制PI3K/Akt信号通路有关。总之,本研究从营养膳食或从功能食品途径为姜黄素和THC防治心血管疾病提供了一定的理论依据。

