蛋黄亲脂抗氧化组分对脂质自动氧化抑制作用
齐海雯,都玉玉,张书尧,任戈一,冰玛拉措,王庆玲
石河子大学食品学院(石河子 832003)
鸡蛋作为一种质优价廉的高蛋白营养品,深受我国广大居民喜爱。但由于蛋黄中含有大量脂质,在贮藏过程中脂质容易发生水解及氧化[1],导致鸡蛋品质下降。脂质氧化分为酶促氧化、非酶及自由基介导的氧化和非酶及非自由基氧化,其中自由基参与的氧化与体内的氧化应激密切相关[2-3]。脂质自动氧化不仅产生有害物质还会累积自由基,促进氧化循环生成链式反应[4]。脂质氧化反应所产生的自由基具有强氧化性、活度高和稳定性差的特点,易与周围分子反应,对机体产生损伤[5-6]。相关研究表明一般诱导脂质氧化的自由基为羟自由基(·OH)和超氧阴离子自由基(O2
-·)[7]。
蛋黄由于含有内源抗氧化系统,会产生大量内源抗氧化物质[8],可抵抗自由基的攻击,降低对机体的损伤。鸡蛋中除卵黄高磷蛋白、卵转铁蛋白、游离芳香族氨基酸等,还有一些亲脂性抗氧化成分,如维生素E、类胡萝卜素、磷脂等。研究表明鸡蛋在常温状态下能储存较长时间,而蛋黄中的脂质氧化速率较慢,可能与蛋黄内源抗氧化体系有关[9]。
为探究蛋黄内源抗氧化物质对脂质氧化的抑制作用,试验以油酸/亚油酸为底物,分别建立羟自由基和超氧阴离子自由基自动氧化模拟体系,探究不同因素对脂质自动氧化的影响,明确蛋黄主要亲脂组分磷脂(PL)、蛋黄类胡萝卜素(Cars)及磷脂-类胡萝卜素乳液(PCE)对脂质氧化的抑制作用。
1 材料与方法
1.1 材料与试剂
新鲜鸡蛋(产蛋24 h内,购于石河子市宏鑫养殖场);正己烷、硫酸亚铁、过氧化氢、硫代巴比妥酸(国药集团化学试剂有限公司);亚油酸、油酸、过氧化氢异丙苯(上海麦克林生化科技有限公司)。
1.2 仪器与设备
Neofuge-15R酶标仪(美国伯爵仪器有限公司公司);Multifuge▪XIR高速冷冻离心机[赛默飞世尔科技(中国)有限公司];SH21-1恒温磁力搅拌器(上海梅颖浦仪器仪表制造有限公司);DK-8D恒温水浴锅(金坛市医疗仪器厂)。
1.3 试验方法
1.3.1 蛋黄磷脂(PL)的提取
参考Ali等[10]的方法。40 g蛋黄与120 mL乙醇涡旋混匀后低温离心,上清液移至烧杯。重复提取1次,合并上清液并回收溶剂。60 mL正己烷溶解浓缩物后加入120 mL -20 ℃丙酮,磁力搅拌至PL沉淀,低温丙酮(10 mL/次)洗涤沉淀2次,氮气吹干获得蛋黄PL,乙醇溶解后于4 ℃保存备用。
1.3.2 蛋黄类胡萝卜素(Cars)的提取
3 g蛋黄与9 mL混合溶液(V甲醇∶V乙酸乙酯∶V石油醚= 1∶1∶1)涡旋混匀1 min,重复提取3次,合并上清液氮气吹干。沉淀用6 mL溶液(V叔丁基甲基醚∶V乙醇=3∶1)复溶后过0.45 μm微孔滤膜制得蛋黄Cars,于4 ℃保存备用[11]。
1.3.3 磷脂-类胡萝卜素乳液(PCE)的制备
参考Tan等[12]的方法并略作修改。将0.03 g Cars溶于6 mL乙醇(含有3 g PL)溶液中获得磷脂-类胡萝卜素乳液溶液,加入60 mL磷酸盐缓冲液(pH 7.4,0.15 mol/L氯化钠,2.16 g吐温80)配成磷脂-类胡萝卜素混合液,旋转蒸发乙醇后以14 000 r/min高速剪切5 min制得PCE,于4 ℃保存备用。
1.3.4 羟自由基氧化体系的建立
在20 mmol/L磷酸盐缓冲液(pH 6.0,1 mg/mL吐温20)中添加FeCl3和抗坏血酸钠,使其最终浓度分别为0.1 mmol/L及0.1 mmol/L,通过高锰酸钾法测定H2O2浓度,分别调节H2O2浓度至0,1,2,10,20,30和40 mmol/L。
1.3.5 超氧阴离子自由基氧化体系的建立
超氧阴离子由黄嘌呤氧化酶(XO)作用于黄嘌呤(X)产生。在20 mmol/L磷酸盐缓冲液(pH 8.2,1 mg/mL吐温20)中加入X/XO(X∶XO=40 mmol/L∶1 U,U为XO酶活力单位),使超氧阴离子自由基最终浓度分别0,1,2,10,20,30和40 mmol/L。
1.3.6 不同自由基及浓度对脂质氧化的影响
向含有不同浓度羟自由基及超氧阴离子自由基的氧化体系中分别添加油酸、亚油酸和蛋白质,使油酸、亚油酸终浓度10 mg/mL,于4 ℃孵育12 h后分别测定表征脂质氧化的HPOD值和TBARS。
1.3.7 底物浓度对脂质氧化的影响
将油酸、亚油酸加入10 mmol/L羟自由基氧化体系中,使油酸、亚油酸终浓度分别为1,3,5,10,20,30和50 mg/mL,于4 ℃孵育12 h后用BHT终止反应,测定表征脂质氧化的HPOD值和TBARS值。
1.3.8 抗氧化物浓度对脂质氧化的影响
将油酸、亚油酸分别加入浓度为10 mmol/L羟自由基氧化体系中混合,使油酸、亚油酸终浓度为10 mg/mL,迅速添加不同浓度(0,2,4,6,8,10和12 mg/mL)的PL、Cars及PCE涡旋振荡,在4 ℃环境中反应12 h后用BHT终止反应,测定HPOD值及TBARS值。
1.3.9 脂质氢过氧化物(HPOD)测定
0.1 mL试样溶液与1.5 mL的异辛醇-异丙醇(3∶1,V/V)溶液涡旋均质3次(每次10 s)。后将溶液于3 400 r/min离心2 min,取0.2 mL上清液加入到2.8 mL混合溶液中(V甲醇∶V丁醇=2∶1)。分别加入15 μL硫氰酸铵(3.94 mol/L)溶液和15 μL Fe2+溶液(通过混合0.132 mol/L BaCl2和0.144 mol/L FeSO4获得),20 min后510 nm处测定吸光度。标准曲线用过氧化氢异丙苯定量,结果表示为mg HPOD/mL。
1.3.10 TBARS值测定
脂质次级氧化产物丙二醛与硫代巴比妥酸(TBA)发生反应,通过TBARS值得到丙二醛含量,但是TBARS值不等于次级氧化产物。因此,将适量试样与三氯乙酸混合后加入硫代巴比妥酸(TBA)溶液,于90 ℃水浴30 min,冷却至室温,532 nm处测得吸光度,计算TBARS含量[11]。
1.4 数据处理方法
每组试验重复3次测定,组间数据采用SPSS Statistics 17.0进行差异显著性分析(P<0.05),结果用平均值±标准差(X±SD)的形式进行表示,运用Origin Pro 8.5软件进行图表绘制。
2 结果与讨论
2.1 模拟氧化体系中不同自由基种类及浓度下油酸氧化的比较
2.1.1 不同浓度·OH对油酸氧化程度的影响
由图1可知,羟自由基浓度在0~10 mmol/L的范围内,油酸的HPOD及TBARS含量显著增加(P< 0.05),而浓度在10~40 mmol/L范围内,氧化产物含量显著减少(P<0.05)。低浓度时油酸氧化产物增加,其原因是底物油酸结构中的不饱和双键易被羟自由基攻击导致脱氢,随后分解产生丙二醇,HPOD和TBARS正是表征衡量次级氧化产物丙二醇含量的指标[3]。氧化体系中羟自由基浓度大于10 mmol/L时,羟自由基会发生聚集结合的现象使其有效浓度降低,从而表现出油酸氧化程度下降的现象[11]。
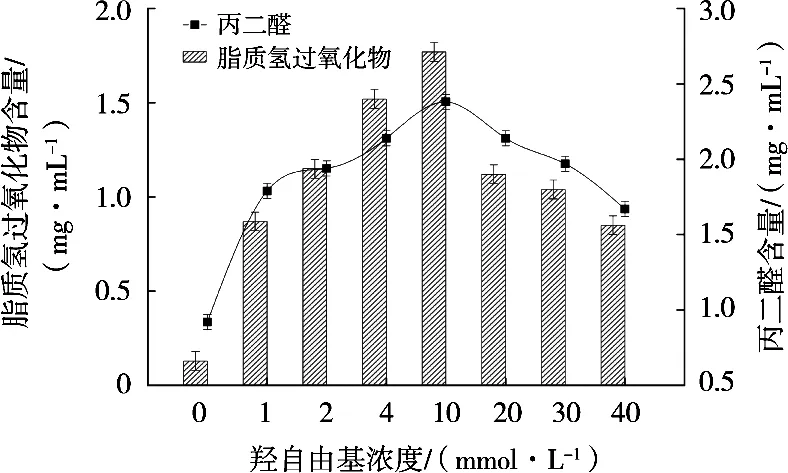
图1 不同浓度羟自由基氧化体系对油酸氧化的影响
2.1.2 不同浓度O2-·自由基对油酸氧化程度的影响
由图2可知,油酸的脂质初级氧化产物及次级氧化产物含量表现出逐渐上升趋势。与图1相比,在相同自由基浓度下,羟自由基对油酸氧化产生的HPOD及TBARS含量总体高于超氧阴离子,表明羟自由基体系对油酸的氧化诱导作用更显著。有研究表明羟自由基比超氧自由基具有更大的氧化活性,其氧化电位达2.8 V,且能透过细胞膜对细胞内部造成严重的氧化损伤。因此,在羟自由基氧化体系中,油酸HPOD及TBARS高于超氧阴离子体系。

图2 不同浓度超氧阴离子自由基氧化体系对油酸氧化的影响
2.2 模拟氧化体系中不同自由基种类及浓度下亚油酸氧化的比较
2.2.1 不同浓度的·OH对亚油酸氧化程度的影响
由图3可知,以亚油酸为底物,·OH浓度在0~10 mmol/L范围内,HPOD及TBARS含量随羟自由基浓度增加而显著上升(P<0.05)。·OH浓度在10~40 mmol/L范围内,脂质氧化产物随浓度增加而显著降低(P>0.05)。与油酸体系类似,亚油酸的大量不饱和双键易被羟自由基攻击脱氢,随后分解形成产生的丙二醇,通过测定HPOD和TBARS等衡量次级氧化产物丙二醇含量的指标得到其含量[3]。羟自由基浓度大于10 mmol/L时,部分羟自由基会形成聚合物导致链式反应作用减弱,因而表现出亚油酸氧化程度下降的现象[11]。
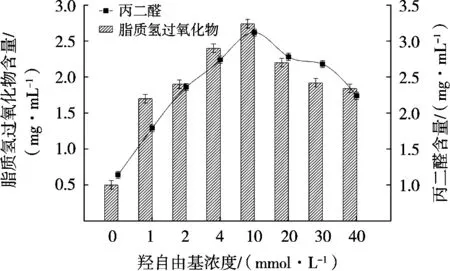
图3 不同浓度羟自由基氧化体系对亚油酸氧化的影响
2.2.2 不同浓度O2-·对亚油酸氧化程度的影响由图4可知,随着O2-·浓度增加,亚油酸的脂质初级氧化产物及次级氧化产物含量表现出逐渐上升趋势,但氧化产物含量显著低于羟自由基体系,因此·OH诱导的亚油酸氧化作用效果更强。
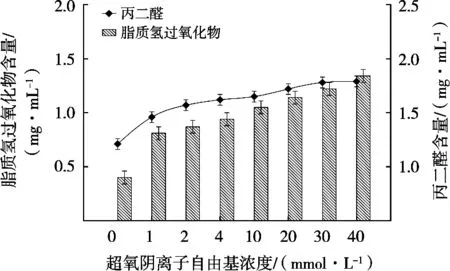
图4 不同浓度超氧自由基氧化体系对亚油酸氧化的影响
结果表明,羟自由基对油酸和亚油酸的氧化诱导作用显著高于超氧阴离子,因此选择·OH体系作为后续研究的氧化模拟体系。
2.3 底物浓度对模拟氧化体系中脂质氧化的影响
由图5可知,羟自由基氧化体系下脂质氧化指标HPOD和TBARS含量变化规律基本一致,两者含量随底物浓度增加而逐渐升高,而当油酸和亚油酸浓度在10 mg/mL及以上时趋于稳定。张迎阳[13]的研究同样发现亚油酸氧化程度在一定范围内随底物浓度增加而升高。底物浓度在1~10 mg/mL范围内时,脂质氧化程度显著加深[图5(a),P<0.05],这是由于·OH与脂质发生脂质链式氧化反应所致并生成初级脂质氧化产物及次级脂质氧化产物,在一定范围内底物浓度越高,链式反应的发生量越大,从而导致氧化产物的积累量增加。底物浓度大于10 mg/mL时,脂质氧化程度随底物浓度增加基本保持平稳,这可能是因为氧化体系中·OH的氧化能力与底物浓度基本趋于平衡,表现出脂质氧化程度小幅波动的现象[14]。

图5 不同底物浓度对油酸、亚油酸氧化的影响
2.4 PL、Cars和PCE对模拟氧化体系中脂质氧化的影响
图6为不同蛋黄抗氧化组分对羟自由基氧化模拟体系中油酸、亚油酸的氧化抑制效果。抗氧化组分的添加对羟自由基诱导的脂质氧化表现出显著的抑制效果(P<0.05),随抗氧化物浓度增加,抑制效果逐渐增强,在6 mg/mL时基本趋于平稳。这可能是由于随抗氧化物浓度的增加,体系内的抗氧化能力逐渐增强,油酸和亚油酸遭受羟自由基的氧化风险逐渐降低。但是亚油酸体系中氧化与抗氧化平衡点大于油酸体系中的平衡点,造成此现象的原因可能是亚油酸不饱C=C双键含量远高于油酸的不饱和程度[15]。
由图6可知,PCE对油酸抗氧化效果最强,原因可能是PL是双亲性分子,可形成PL双分子层包裹疏水性分子[12],PL在乳液中以PL双分子层的形式将Cars包裹于双分子层空腔中,并通过疏水性尾部吸附在油酸分子表面形成抗氧化层大幅降低油酸的氧化风险。此外,Cars的抗氧化效果强于PL。这可能是Cars中的多种抗氧化物质共同发挥抗氧化作用的结果。有研究表明Cars中叶黄素的结构以共轭双键为主并辅以2个紫罗酮环二羟基,其天然存在的紫罗酮环二羟基赋予叶黄素较高的氧自由基清除能力[16-17]。此外,任丹丹等[18]证实Cars中叶黄素与玉米黄质存在协同抗氧化的现象。蛋黄PL主要由磷脂酰胆碱(PC,占磷脂84%)构成,因其含有大量不饱和C=C双键导致PL结构不稳定,易被氧自由基攻击致使抗氧化性能减弱。
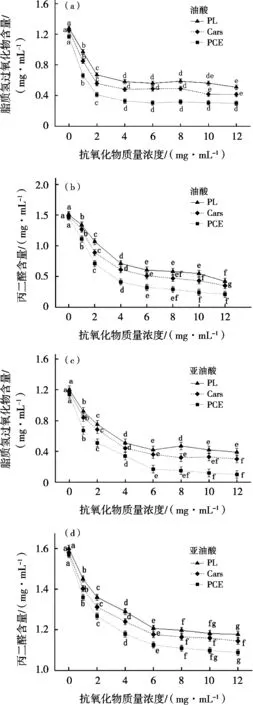
图6 不同抗氧化物浓度对油酸、亚油酸氧化的影响
3 结论
研究表明蛋黄内源抗氧化组分的添加对油酸和亚油酸自动氧化具有显著抑制作用,并且随着抗氧化物浓度增加,抑制氧化效果逐渐增强。其中,PCE对脂质抗氧化效果最强,可能是PL包裹Cars并通过疏水性尾部吸附在油酸分子表面形成抗氧化层显著降低油酸自动氧化效果。试验证实蛋黄亲脂抗氧化组分对脂质自动氧化具有抑制作用,并为PL和Cars协同调控脂质自动氧化进程提供依据。

