黄粉虫凝乳蛋白酶的分离纯化及结构预测
杨祥,乔海军,杨晓丽,文鹏程,汪月,张卫兵,*,张忠明,*
1(甘肃农业大学 食品科学与工程学院,甘肃 兰州,730070)2(甘肃农业大学 理学院,甘肃 兰州,730070)3(甘肃省商业科技研究所有限公司,甘肃 兰州,730000)
凝乳酶是干酪生产过程中的关键酶,能够使牛奶凝固并在干酪成熟过程中起着不可替代的作用[1]。凝乳酶的凝乳过程包括2个阶段:第一阶段是对κ-酪蛋白Phe105-Met106连接的肽键进行水解,暴露出内部的α-酪蛋白和β-酪蛋白;第二阶段是在Ca2+作用下,酪蛋白分子间形成化学键,并聚集形成三维网状凝胶[2]。小牛凝乳酶是最早应用于干酪制作的,然而随着干酪的市场需求不断增加,小牛凝乳酶逐渐供不应求,人们不得不寻找其替代品[1,3]。骆驼凝乳酶、羔羊凝乳酶、猪胃蛋白酶等动物源凝乳酶都具有较好的凝乳活力,它们的蛋白水解力较小,制作的干酪苦味小,风味和品质也较好。帕尔玛奶酪、高山奶酪、埃门塔尔奶酪等很多高品质的干酪都使用动物源凝乳酶进行制作[4]。动物源凝乳酶替代品中,骆驼凝乳酶与小牛凝乳酶分子结构差异很小,但其凝乳活力要高于小牛凝乳酶,且蛋白水解力只有小牛凝乳酶的30%[5]。羔羊凝乳酶的凝乳活力低于小牛凝乳酶,但具有更高的pH稳定性[6];水牛皱胃酶的凝乳活力较低,其稳定性和蛋白水解力与小牛凝乳酶差别不大[7];此外,从甲壳类昆虫Munida中提取出的凝乳酶也可应用于奶酪制作[8]。昆虫的物种丰富,数量众多,是凝乳酶开发的良好资源,然而,在现有动物源凝乳酶中,昆虫凝乳酶少有报道。
黄粉虫(Tenebriomolitor),是鞘翅目拟步行虫科粉甲属的昆虫,常被用作动物饲料。近年来,将昆虫尤其是黄粉虫作为动物蛋白纳入食品行业受到欧洲重点关注[9]。与其他动物一样,在黄粉虫的肠道中也存在很多蛋白酶。ELPIDINA等[10]在黄粉虫幼虫的后中肠中提取出胰凝乳蛋白酶样蛋白酶,并测定了其酶学性质和N端序列;CRISTOFOLETTI等[11]在黄粉虫中肠中提取出组织蛋白酶L样蛋白酶(calpain,CAL),测定了其氨基酸序列并预测了其活性位点和功能;BETON等[12]在中肠中也提取得到CAL,进一步模拟出了酶的3D结构模型;马勇等[13]研究发现将黄粉虫浆加入牛奶后,很快会发生凝乳现象,但对其凝乳机理未做进一步的研究。本研究从黄粉虫体中提取和分离纯化出凝乳蛋白酶,鉴定出该酶的氨基酸序列,并对其结构特性进行预测,以期为黄粉虫凝乳蛋白酶在的应用提供理论参考。
1 材料与方法
1.1 材料与试剂
黄粉虫,山东省德州市平原十号路市场;DEAE-Sepharose FF、Sephadex G75,上海源叶生物科技有限公司;0.45 μm滤膜,上海光谱实验科技有限公司;蛋白Marker,上海索莱宝生物科技有限公司;玻璃匀浆器,上海泽叶生物科技有限公司;丙烯酰胺、十二烷基硫酸钠(sodium dodecyl sulfate,SDS),北京酷来搏科技有限公司;甲叉双丙烯酰胺,上海中泰化学试剂有限公司;考马斯亮蓝G250、考马斯亮蓝R250,天津市光复精细化工研究所;其他常用生化试剂均为分析纯。
1.2 仪器与设备
TD5A-WS高速冷冻离心机,长沙湘仪离心机仪器有限公司;HL-2B恒流泵、BSZ-160自动部分收集器,上海沪西分析仪器厂;SCIENTZ-10 ND真空冷冻干燥机,宁波新芝生物科技有限公司;质谱仪Q Exactive HF、液相Easy nLC/ Ultimate 3000、色谱柱C18(1.9 mm,150 μm×120 mm)、色谱预柱C18(3 mm,100 μm×20 mm), 美国Thermo Scientific公司;电泳仪、电泳自动成像仪,美国Bio-Rad公司;PPSQ-33A岛津全自动蛋白质多肽测序仪,日本SHIMADZU公司。
1.3 实验方法
1.3.1 黄粉虫肠道蛋白组分析
将四龄的黄粉虫置于一块含0.9% NaCl的冰上切去其头和尾,从任意一端取出肠道,与pH 6.5的Tris-HCl缓冲液充分混合后,加入玻璃匀浆器中匀浆;将得到的匀浆液4 ℃、10 000×g离心20 min,收集上清液并用0.45 μm滤膜进行微滤,收集滤液[14];将滤液送往北京市百迈客生物科技有限公司进行LC-MS/MS分析,并对得到的碎片肽段序列进行定性和定量分析以及功能注释,建立黄粉虫肠道蛋白数据库。
1.3.2 黄粉虫凝乳蛋白酶提取与分离纯化
将黄粉虫肠道经匀浆、离心、微滤后得到滤液,然后对其进行纯化。首先,使用弱阴离子交换柱DEAE-Sepharose FF进行离子交换层析[15]:用pH 6.5的0.02 mol/L Tris-HCl作为平衡缓冲液平衡3~5个柱体积,平衡流速为1 mL/min;用0~0.6 mol/L NaCl溶液进行梯度洗脱,洗脱液用平衡缓冲液配制,洗脱流速为0.5 mL/min[16]。收集具有凝乳活力的洗脱液并用3 kDa超滤离心管进行浓缩,将浓缩液作为上样样品,使用葡聚糖凝胶Sephadex G75色谱柱(1.6 cm×20 cm)进行凝胶过滤层析:用pH 6.0的0.02 mol/L Tris-HCl作为平衡缓冲液平衡4~5个柱体积,平衡流速为1 mL/min;用平衡缓冲液进行洗脱分离,洗脱流速为0.25 mL/min;收集具有高凝乳活力的洗脱液,得到纯化的凝乳酶,冷冻干燥后保存在-80 ℃下。通过SDS-PAGE验证凝乳酶的纯度,采用考马斯亮蓝法测定蛋白含量。
1.3.3 N端15个氨基酸序列测定
采用Edman降解法测定该酶的N端15个氨基酸[10];。将冻干的样品用pH 6.0的Tris-HCl缓冲液溶解,取20 μL溶液样品进行12% SDS-PAGE后,将SDS-PAGE胶电转至硝酸纤维素膜上,并用丽春红染色。剪取相应膜放置到反应器中,组装好反应器后将其放置于仪器固定位置,通过岛津全自动蛋白质多肽测序仪(PPSQ-33A)对样品N端序列进行分析。通过软件PPSQ-30 Analysis设置:样品名称、样品号、测试循环数、选择方法文件,设置完成后开始测试,最终确定该酶N端15个氨基酸。利用该酶的N端15个氨基酸序列与黄粉虫肠道蛋白数据库比对搜索出同源蛋白。
1.3.4 凝乳酶活力测定
参照ARIMA等[17]的方法,将含有10 mmol/L CaCl2的10%脱脂乳于35 ℃水浴中孵育15 min,再按质量比1∶10加入黄粉虫凝乳蛋白酶,充分混匀后,记录下容器壁出现絮状颗粒所需要的时间,即为凝乳时间。凝乳活力的单位为索氏单位,1个索氏单位表示在35 ℃下,40 min内凝结1 mL底物所需要的酶量。凝乳活力计算如公式(1)所示:
(1)
式中:MCA为凝乳活力(milk clotting activity),t为凝乳时间,s。
1.3.5 蛋白水解力测定
参照ZHAO等[18]的方法进行测定并略作修改。样品的测定方法为:取1 mL样品在40 ℃水浴2 min,然后加入1 mL 1%酪蛋白溶液反应10 min,再加入2 mL 0.4 mmol/L三氯乙酸溶液终止反应,静置10 min后过滤溶液并取1 mL滤液在660 nm处测定吸光值。蛋白水解力的单位为U,1 U表示1 mL酶在1 min内水解酪蛋白产生1 μg酪氨酸所需要的酶量。样品的蛋白水解力(proteolytic activity,PA)计算如公式(2)所示:
(2)
式中:A660为样品在660 nm处的吸光值,4为反应试剂总体积,1/10为反应时间10 min,以1 min计算,K为吸光常数,在标准曲线上,吸光值为1时对应的酪氨酸浓度,n为稀释倍数。
1.3.6 黄粉虫凝乳蛋白酶一级结构分析
在GenBank数据库采用 BLAST 程序查找与其相似的蛋白酶序列,并与黄粉虫凝乳蛋白酶进行比较分析。
1.3.7 黄粉虫凝乳蛋白酶理化性质预测
参考 SOLEYMANZADEH等[19]的方法计算和预测黄粉虫凝乳蛋白酶的理化特性。利用肽特性计算器(https://pepcalc.com/)确定酶的分子质量、等电点(isoelectric point,PI)和净电荷;利用ExPASy ProtParam工具(https://web.expasy.org/cgi-bin/protparam /protparam)预测酶的不稳定性指数(不稳定性指数<40预示该肽可能是稳定的,不稳定性指数>40则预示蛋白质或肽可能不稳定)[20];使用肽工具(https://www.peptide2.com)确定酶的疏水性氨基酸比例。
1.3.8 黄粉虫凝乳蛋白酶二级结构预测
以黄粉虫凝乳蛋白酶的一级序列为基础,使用PSSFinder工具预测其二级结构(http://linux1.softberry.com/ berry)[21]。
1.3.9 凝乳酶的三级结构预测
以黄粉虫凝乳蛋白酶的一级结构为基础,运用I-TASSER On-line Server预测其三级结构和B-factor(http://zhanglab.ccmb.med.umich.edu/I-TASSER)。利用COACH服务器和预测到的三级结构预测该酶的活性位点,并以TM-score和Cov作为置信度的评价指标。
2 结果与分析
2.1 黄粉虫肠道蛋白数据库的建立
从样品中共鉴定到1 207种黄粉虫肠道蛋白质及其完整氨基酸序列,其中发掘出98种新蛋白。建立了黄粉虫肠道蛋白数据库,将测序数据上传至ProteomeXchange数据库,存储编号为PXD029111。鉴定到的蛋白涉及的主要代谢通路为碳代谢(ko01200)、氧化磷酸化(ko00190)、糖酵解/糖异生(ko00010)、半乳糖代谢(ko00052)以及多种氨基酸代谢;主要功能包括转移酶活性(GO:0016740)、催化活性(GO:0003824)、单体碳水化合物代谢过程(GO:0044723)、酶调节器活性(GO:0030234)等。
2.2 黄粉虫凝乳蛋白酶提取与分离纯化
如图1-a所示,粗酶液经离子交换层析后,共洗脱出6个蛋白峰,其中第1、第2和第3个峰没有肩峰,表明杂蛋白很少,而后面3个峰都有肩峰,说明存在较多的杂蛋白,蛋白并没有彻底被分开。在第一个蛋白峰的位置出现了具有高凝乳活力的蛋白,而这个位置是采用0 mmol/L NaCl的洗脱液洗脱的,说明该酶无法被阴离子交换柱吸附。将高凝乳活力的蛋白收集、浓缩,得到了部分纯化的凝乳酶,其凝乳活力达到26.81 SU/mg,C/P(clotting activity/proteolytic activity)值为4.83,纯化倍数为6.65。与粗酶液相比,其蛋白水解力明显下降,凝乳活力有一定提高。
将该提取物进行凝胶过滤层析,结果如图1-b所示,经凝胶过滤层析后,共洗脱出了2个蛋白峰,第2个峰相较于第1个峰要大很多,且这2个峰都没有肩峰,说明蛋白纯度较高,分离效果较好。在第二个峰的位置附近出现了具有高凝乳活力的蛋白,将其收集并进行了SDS-PAGE以测定其纯度(图1-c),发现黄粉虫凝乳蛋白酶已达到电泳纯,分子质量约为29 kDa。该值在目前所研究的黄粉虫肠道蛋白分子质量范围之内,并且偏小一些[22];其分子质量与小牛凝乳酶、山羊凝乳酶和猪胃蛋白酶相比较小,与羔羊凝乳酶[5]接近。相比于TERESHCHENKOVA等[23]只使用1种层析柱进行纯化,本研究采用2种层析柱和微滤组合的纯化方法能达到更好的纯化效果。
经测定该酶的凝乳活力达到173.8 SU/mg,C/P值为104.70,纯化倍数为43.13,蛋白水解力仅有1.66 U/mL (表1)。其C/P值要高于鸡胃蛋白酶、金枪鱼凝乳酶和成年的绵羊皱胃酶[24]。C/P值越高则表明在干酪的制作和成熟过程中产生的苦味越少,很多植物源和微生物源凝乳酶[18]做出的干酪质地柔软,苦味重就是由于蛋白水解力太大,C/P值不大导致的。这些都表明该酶在干酪生产上具有一定的潜力。
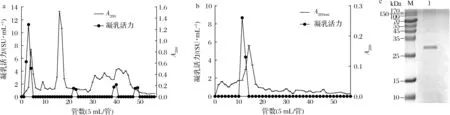
a-DEAE Sepharose Fast Flow;b-Sephadex G75;c- SDS-PAGE(M-标准蛋白;1-纯化的黄粉虫凝乳蛋白酶)图1 黄粉虫凝乳蛋白酶的柱层析纯化及SDS-PAGEFig.1 Column chromatography purification and SDS-PAGE pattern of milk-clitting protease from T.molitor larvae

表1 黄粉虫凝乳蛋白酶纯化过程Table 1 Purification procedure of milk clotting protease from T.molitor larvae
2.3 黄粉虫凝乳蛋白酶序列鉴定
经测定黄粉虫凝乳蛋白酶的N端15个氨基酸序列为MKLLVFSLVAISLAQ,与建立的黄粉虫肠道蛋白数据库比对后发现其与同源蛋白(g18990)的N端序列完全匹配(表2);该蛋白鉴定方法被许多研究学者运用[10,12],是一种经典有效的鉴定手段。该酶的氨基酸序列如图2所示,其总氨基酸残基数为279,与小牛皱胃酶和骆驼凝乳酶的N端序列都只有13.3%的相似度[21]。

表2 黄粉虫凝乳蛋白酶的序列信息Table 2 Sequence information of milk-clotting protease from T.molitor larvae
另外,该酶序列与NCBI中的几种蛋白水解酶有50%以上的相似度(表3),其中最高的1种是PREDICTED:brachyurin(XP_969640.1),相似度达到75.27%,这种蛋白水解酶来自同属鞘翅目的红面甲虫(Triboliumcastaneum),但其功能尚未证实。

图2 黄粉虫凝乳蛋白酶的氨基酸序列Fig.2 The amino acid sequence of milk-clotting protease from T.molitor larvae

表3 黄粉虫凝乳蛋白酶与其他相似蛋白水解酶氨基酸序列比对Table 3 Amino acid sequence alignment of milk-clotting protease from T.molitor larvae with other similar proteases
2.4 黄粉虫凝乳蛋白酶结构研究
2.4.1 黄粉虫凝乳蛋白酶的理化性质
对黄粉虫凝乳蛋白酶和几种序列相似的蛋白酶进行了理化性质预测,结果如表4所示。黄粉虫凝乳蛋白酶的分子质量相比表中其余几种偏小,但是其不稳定性指数<40,这表明该酶性质稳定。净电荷是在中性环境下预测的凝乳酶表面总体静电荷,均为负,黄粉虫凝乳蛋白酶与小牛皱胃酶的很接近,但比骆驼凝乳酶小很多,3种酶所带负电荷残基数相差很小,而黄粉虫凝乳蛋白酶的正电荷残基少于骆驼凝乳酶。该酶等电点与表中两种已知凝乳酶相近,几种酶的等电点都<7,均为酸性蛋白酶;该结果符合黄粉虫肠道蛋白的研究范围,黄粉虫肠道中存在酸性和碱性的蛋白酶,而且主要的消化蛋白酶为酸性蛋白酶[12,25]。几种酶的疏水性氨基酸比例都在40%左右,黄粉虫凝乳蛋白酶偏高,这表明其三级结构可能保持较高稳定性[26]。另外,疏水性氨基酸在酶与反应底物相互作用涉及到的一些非共价键的结合上起着不可替代的作用,这也预示着该酶与κ-酪蛋白的复合物的结构可能更为稳定。

表4 黄粉虫凝乳蛋白酶及其他相似蛋白水解酶理化性质及部分氨基酸残基对比分析Table 4 Comparison of physicochemical properties and partial amino acid residues of milk-clotting protease from T.molitor larvae and other similar proteases
2.4.2 黄粉虫凝乳蛋白酶二级结构
二级结构是指多肽链中主链原子的局部空间排布构象,主要包括α-螺旋、β-折叠和无规卷曲,其中α-螺旋在二级结构中起主要的稳定作用[27]。利用黄粉虫凝乳蛋白酶的完整氨基酸序列预测出其二级结构,结果显示其β-折叠的占比要略多于α-螺旋,而小牛皱胃酶和骆驼凝乳酶的β-折叠要明显多于α-螺旋[21],这表明黄粉虫凝乳蛋白酶可能具有更稳定的二级结构(图3)。3种酶二级结构的分布位置有很大差别,黄粉虫凝乳蛋白酶在N端和C端都各有1个α-螺旋,后接几个β-折叠,而其他两种酶的N端和C段则是先排列出几个β-折叠,后接1个α-螺旋。然而,与黄粉虫肠道中的主要消化蛋白酶系具有一些相似之处[12]:它们在N端都有1个α-螺旋, 其中1种组织蛋白酶L样蛋白酶 (pCAL2C25S)的C端也具有α-螺旋。

图3 黄粉虫凝乳蛋白酶二级结构预测Fig.3 The secondary structure prediction of the milk-clotting protease from T.molitor larvae注:PredSS是预测的二级结构;AA seq是氨基酸序列;H或是α-螺旋;S或是β-折叠;C是无规则卷曲
2.4.3 黄粉虫凝乳蛋白酶三级结构
黄粉虫凝乳蛋白酶的三级结构如图4-a所示,不同的颜色代表不同的结构,预测模型的C-score为-1.24,拥有最高的置信度。该结构与小牛皱胃酶和骆驼凝乳酶结构相差甚远[28],这可能是分子质量和物种上的巨大差异造成的,也表明这是1种全新的凝乳蛋白酶。使用COACH服务器预测到了黄粉虫凝乳蛋白酶可能的4个催化位点,分别是His87、Gly227、Ser229、Gly230(图4-b)。预测结果的TM-score为0.821,Cov值0.864,预测结果也拥有很高的置信度。该酶的外层大多是α-螺旋和一些无规则卷曲,而酶分子的β-折叠结构占据了内部的大部分位置,并构成了1个夹层,夹层的夹角不大,其中却包裹着该酶的活性位点,使其呈隐藏状态,并没有暴露在外层,正因存在这样的位阻影响,底物难以接近和进入酶的反应中心,导致酶的催化效率偏低,酶活力不如小牛皱胃酶、骆驼凝乳酶等。

a-黄粉虫凝乳蛋白酶三级结构;b-黄粉虫凝乳蛋白酶活性位点;c-黄粉虫凝乳蛋白酶的BFP值图4 黄粉虫凝乳蛋白酶三级结构、活性位点及BFP值预测Fig.4 The prediction of tertiary structure, active sites and normalized B-factor of milk-clotting protease from T.molitor larvae注:粉红色代表α-螺旋,黄色代表β-折叠,蓝白相间的表示无规则卷曲,紫色代表活性位点
I-TASSER 还预测了该酶中每个氨基酸的归一化B因子(normalized B-factor,BFP)值(图4-c),BFP 值>0的氨基酸残基是在实验中不太稳定的结构。如图所示,64.8%的氨基酸残基的BFP值<0,其中又有64.4%的残基参与构成蛋白的二级结构,这表明黄粉虫凝乳蛋白酶的三级结构稳定性较高。
3 结论
从黄粉虫肠中提取和分离纯化出了黄粉虫凝乳蛋白酶,通过LC-MS/MS等技术鉴定出该酶完整的279个氨基酸序列;经预测发现,该酶为酸性蛋白酶,理化性质稳定,二级结构稳定;与小牛皱胃酶和骆驼凝乳酶比较发现三者在N端序列和二级结构等方面有较大差异;通过同源建模预测出该酶的三维结构以及可能的活性位点Ser229等。本研究可为黄粉虫凝乳蛋白酶的跨膜蛋白分析、与κ-酪蛋白复合物的构建等进一步的研究提供科学依据。

