黄鳍金枪鱼油精制前后对乙酯化及其品质的影响
曹振海,陶宁萍,2*,邓尚贵
1(上海海洋大学 食品学院,上海,201306)2(上海水产品加工及贮藏工程技术研究中心,上海,201306)3(浙江海洋大学 食品与药学学院,浙江 舟山,316000)4(浙江兴业集团有限公司,浙江 舟山,316000)
海洋物种的副产物是生物活性化合物的重要潜在来源,因其鱼油中含有的具备治疗心血管疾病、治疗认知衰退和阿尔茨海默病潜能[1]的ω-3系多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)远高于其他动物、植物油脂而受到市场的青睐。目前市面上的鱼油制品形式主要分为3种:甘油三酯型、乙酯型和脂肪酸型,乙酯型是甘油酯与含有羟基的化合物(乙醇)交换烷氧基而形成的脂肪酸酯(图1),是制备高纯度ω-3浓缩物的主要构型、也是被我国唯一承认的可作为降血脂处方药药用的脂肪酸构型;同时研究发现脂肪酸乙酯可作为制备甘油三酯、磷脂等结构脂质的最优酰基供体构型,能有效提高结构脂质中ω-3PUFA的掺入程度[2],因此快速高效高产制备脂肪酸乙酯在食药领域内具有重要的生产意义。
目前,针对于食品领域鱼油乙酯的研发原料主要为符合SC/T 3502—2016精制鱼油一级标准的鱼油,而鱼油的精制过程无疑会造成原料浪费、成本增加。郑振霄等[3]对海豹油进行精制并使用NaOH催化乙酯化,所得酯化油的酸价(acid values,AV)和过氧化值(peroxide value,PV)均符合SC/T 3503—2000标准。鱼油中所含有的杂质,如游离脂肪酸、类固醇、过氧化物和降解产物均会对乙酯化反应带来一定影响[4-5],在对品质要求更高的食品领域内,鱼油中杂质对乙酯化工艺及其品质影响的探究极少。何娜等[6]使用鲢鱼鱼油为原料,以NaOH为催化剂对乙酯化工艺进行优化,并得到了乙酯转化率高达97.47%的鱼油乙酯,AGUILERA-OVIEDO等[7]使用Novozym 435作为酶催化剂,对安康鱼鱼肝油进行两步乙酯化处理,酯化得率为85.0%,但均未对原料鱼油和酯化鱼油理化指标进行测定。
取自于金枪鱼副产物的金枪鱼油具有丰富的ω-3PUFA资源,二十二碳六烯酸(docosahexaenoic acid,DHA)含量远高于二十碳五烯酸(eicosapentaenoic acid,EPA),具有极大的食药研发价值,本研究使用黄鳍金枪鱼原油(2级粗鱼油)和对其精制的黄鳍金枪鱼油(1级精制鱼油)作为原料,拟探讨粗鱼油作为直接生产符合SC/T 3503—2000脂肪酸乙酯品质原料油脂的可能性,并对2种鱼油以及2种酯化油的理化性质、脂肪酸组成、挥发性成分和氧化稳定性进行测定,并进一步探究原料鱼油理化性质的差异对乙酯化及其品质的影响。

图1 乙酯化反应示意图Fig.1 Schematic diagram of ethyl esterification reaction
1 材料与方法
1.1 材料与试剂
提取于鱼头、肝脏、血合肉等副产物的黄鳍金枪鱼原油由平太荣远洋渔业集团提供,-40 ℃保存直至使用。
十九烷酸、十九烷酸甲酯、十一烷酸乙酯、脂肪酸甲酯标品、脂肪酸乙酯标品,上海安谱科学仪器有限公司;三氟化硼-甲醇、甲醇、三氯甲烷和正己烷(均为色谱纯)、乙醇、氢氧化钠、氯化钠、磷酸、异丙醇和其他试剂(均为分析纯),上海麦克林生物科技有限公司。
1.2 仪器与设备
恒温磁力搅拌器,上海凌科事业发展有限公司;H1850台式高速离心机,长沙湘仪离心机仪器有限公司;UV-2450紫外可见分光光度计,岛津设备有限公司;IKA®RV 10旋转蒸发仪,德国IKA集团;MARS 6 CLASSIC微波消解仪,美国CEM公司;iCAP-Qc四极电感耦合等离子体质谱仪(inductively coupled plasma-MS,ICP-MS),美国Thermo Fisher公司;Trace Ultra气相色谱仪(GC),美国默赛飞科技公司;Agilent 6890 N-5975C气相-质谱联用仪(GC-MS),安捷伦科技有限公司;Spotlight 400傅里叶变换红外光谱仪(Fourier transform infrared spectrometer,FTIR),英国PerkinElmer公司;892 Rancimat油脂氧化稳定性分析仪,瑞士万通中国有限公司。
1.3 实验方法
1.3.1 黄鳍金枪鱼油的精制
精制方法参考陈转霞等[8]精制深海鱼油方法,并稍加修改。
脱胶:取一定量金枪鱼原油水浴加热至70 ℃,并加入鱼油质量1%的80%(体积分数)磷酸溶液,搅拌1 min并离心,取上层油相;脱酸:向脱胶油中加入4 mol/L占鱼油重量1.5%的超量碱和理论碱量(7.13×10-4×油重×AV)的NaOH,搅拌至70 ℃并保温30 min,冷却后离心取上层油相,并使用占油重10%的热超纯水(90 ℃)洗涤2次得脱酸精制油。由于原油颜色呈黄色,且澄清透明,未进行脱色处理。
1.3.2 黄鳍金枪鱼油乙酯化
参考MAGALLANES等[9]的乙酯化方案,并稍加修改。
称取一定量鱼油m0于圆底烧瓶中,使用磁力搅拌器预热至60 ℃,加入油醇摩尔比为1∶8的NaOH-乙醇溶液,密闭条件下反应(60 ℃,800 r/min)75 min,反应结束后,加入50 g/L NaCl热溶液进行洗涤,以拖拽甘油、NaCl、乙醇等极性化合物和脂肪酸乙酯分离,洗涤体积为加入乙醇体积的50%,洗涤重复3次,合并上层所取油样。将上层油样于40 ℃下旋蒸30 min,以除去多余的水分和乙醇,得酯化油m1。
经前期实验优化,确定金枪鱼原油和精制金枪鱼油的NaOH用量分别为鱼油质量的0.5%和0.6%。酯化油得率计算如公式(1)所示:
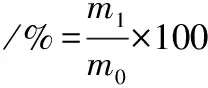
(1)
1.3.3 鱼油理化指标的测定
AV参照GB/T 5009.229—2016 《食品中酸价的测定》进行测定;PV参照GB/T 5009.227—2016《食品中过氧化值的测定》进行测定;碘值(iodine value,IV)参照GB/T 5532—2008《动植物油脂 碘值的测定》进行测定;茴香胺值(p-anisidine value,PA)参照GB/T 24304—2009《动植物油脂 茴香胺值的测定》进行测定;皂化值(saponification value,SV)参照GB/T 5534—2008《动植物油脂 皂化值的测定》进行测定。
1.3.4 金属离子污染物的测定
参照GB 5009.268—2016《食品中多元素的测定》进行测定。油样前处理参考LI等[10]的方法使用微波消解进行制备。
使用ICP-MS进行矿物质分析,仪器参数为射频功率1 500 W;雾化室温度2 ℃;采样深度8 mm;载气流速0.8 L/min;辅助气流速0.4 L/min。使用外标法对3种重金属(Pd、As、Hg)进行定量分析。
1.3.5 脂肪酸组成及乙酯化转化率的测定
金枪鱼原油以及精制油按照ZHANG等[11]的方法,以十九烷酸为内标,使用BF3-甲醇法对鱼油脂肪酸进行甲酯化,甲酯化后用气相色谱仪进行分析;酯化油使用十一烷酸乙酯作为内标,以正己烷作为溶剂进GC进行分析[9],均通过标准品峰的保留时间匹配样品脂肪酸。
气相检测条件:SP-2560毛细管色谱柱(100 m×0.25 mm×0.2 μm),载气:N2;分流比45∶1;火焰离子检测器(flame ionization detector,FID)检测温度250 ℃;程序升温:起始温度70 ℃,升温至140 ℃(20 ℃/min)并保持1 min,后升温至180 ℃(4 ℃/min)保持1 min,最后以3 ℃/min升温至225 ℃ 并保持30 min。乙酯转化率计算如公式(2)所示[12]:
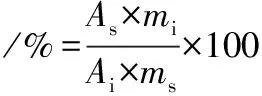
(2)
式中:As为鱼油脂肪酸乙酯峰面积;mi为十一烷酸乙酯的质量,g;Ai为十一烷酸甲酯峰面积;ms为样品质量,g。
1.3.6 鱼油FTIR测定
样品信息的采集使用单点衰减全反射(attenuated total reflectance,ATR)模式,以空气为背景扫描,波数范围为4 000~60 cm-1,分辨率为±4 cm-1,信号累加32次。使用Spectrum软件对原始图谱进行基线校正及平滑处理得FTIR图[13]。
1.3.7 挥发性风味物质测定
用固相微萃取法对鱼油中的风味物质进行提取,准确称量3.0 g鱼油样品于20 mL棕色顶空瓶中,将50/30 μm DVB/CAR/PDMS萃取纤维置于顶空瓶中于55 ℃水浴中吸附30 min,随后在GC-MS进样口解析5 min。
色谱条件:色谱柱:HP-5MS弹性毛细管柱(0.25 μm,30 m×0.25 mm),程序升温:初始温度40 ℃保持4 min,2 ℃/min升至90 ℃,保持1 min,再以8 ℃/min从90 ℃升至160 ℃,15 ℃/min升温至230 ℃保持1 min,不分流模式进样,载气(He);流速为1.0 mL/min。
质谱条件:离子源温度250 ℃;电子能量70 eV;灯丝发热电流200 μA;离子源温度230 ℃;四极杆温度150 ℃;传输线温度280 ℃;检测器电压1.2 kV;质量扫描范围m/z:30~350[14]。
定性方法:将各挥发物的质谱图与NIST 2017质谱库中标准物质的图谱比对并通过正构烷烃计算各挥发性化合物的保留指数(retention index,RI)进行比对。RI计算如公式(3)所示:
(3)
式中:Rt(x), 被分析组分的保留时间,min; Rt(n), Rt(n+1), 碳原子数为n和n+1的正构烷烃保留时间,min。
定量方法:采用峰面积归一化法求各挥发性成分在鱼油中的相对百分含量[15]。
关键风味成分评价方法:采用相对气味活度值(relatively odor activity value,ROAV)法进行评价[16],定义对样品总体风味贡献最大组分为ROAVmax=100,其他气味成分的ROAV计算如公式(4)所示:
(4)
式中:CRi为各挥发性组分的相对含量;Ti为各挥发性组分的在水中的嗅觉阈值(μg/kg);CRmax和Tmax为对样品总体风味贡献最大组分的相对含量以及嗅觉阈值。
1.3.8 鱼油氧化稳定性分析
参考GHOSH等[17]的方法,使用Rancimat方法其氧化稳定性,分别准确称取3.0 g油样置于玻璃管中,以20 L/h的恒定气流测定70、90、110、140 ℃条件下油样的氧化诱导期,该结果由电导率曲线的二阶导数自动确定,并以此推算样品在室温下货架期。
1.4 数据分析
所有实验均重复3次,结果以平均值±标准偏差(mean±SD)的形式表示。使用SPSS 23.0软件对数据进行差异显著性比较分析,P<0.05表示数据间存在显著性差异;使用Origin 2018(Origin Lab,USA)软件处理和生成图像。
2 结果与分析
2.1 酯化前后鱼油理化指标及重金属含量
表1罗列了用于酯化的原料油以及酯化后鱼油的各项理化指标,酯化前后鱼油的重金属含量如表2所示,并与SC/T 3502—2016和SC/T 3503—2000的规定标准进行对比,发现金枪鱼原油及其精制油的理化性质分别符合粗鱼油2级和精制鱼油1级标准。

由表1可知,原油及精制油酯化制备的酯化油的理化指标均符合多烯鱼油水产行业标准(SC/T 3503—2000),原油酯化油的AV、PV、PA明显低于金枪鱼原油(P≤0.05),与精制酯化油相比,除PV外,其他理化指标无明显差异(P>0.05),说明酯化过程中NaOH不仅仅充当了催化剂的角色,更是同游离脂肪酸反应生成了皂钠,并在水洗过程中去除了极性的酸、醛、酮类物质,提高了酯化油品质[5]。但值得注意的是,原油酯化油和脱酸酯化油的乙酯转化率虽无明显差异(P>0.05),但原油酯化油的得率明显低于精制酯化油(P≤0.05),仅为(84.60±3.99)%,这是因为:一方面酯化反应受到反应过程动力学和热力学的控制,过氧化物及其降解产物同NaOH反应生成水等产物,削弱催化剂的能力并促进酯化反应向乙酯生成的反方向推动[21];另一方面,粗鱼油酯化过程中过量皂钠的产生阻碍了洗涤过程中甘油等极性相和脂肪酸乙酯非极性相分离进而降低了其产率[22]。
鱼油品质差异不仅同其氧化程度和脂肪酸构成相关,还与金属离子污染物的水平有关。如表2所示,仅在金枪原油中检测到了低于鱼油水产行业标准的微量铅[(0.09±0.00) mg/g],经精制及酯化后均未检测到,结果同ZHANG等[19]一致,这可能是由于脱酸、酯化过程中产生的钠皂作为一种表面活性物质,具有很强的吸附重金属、蛋白质、色素等杂质的能力而脱除了部分金属离子。
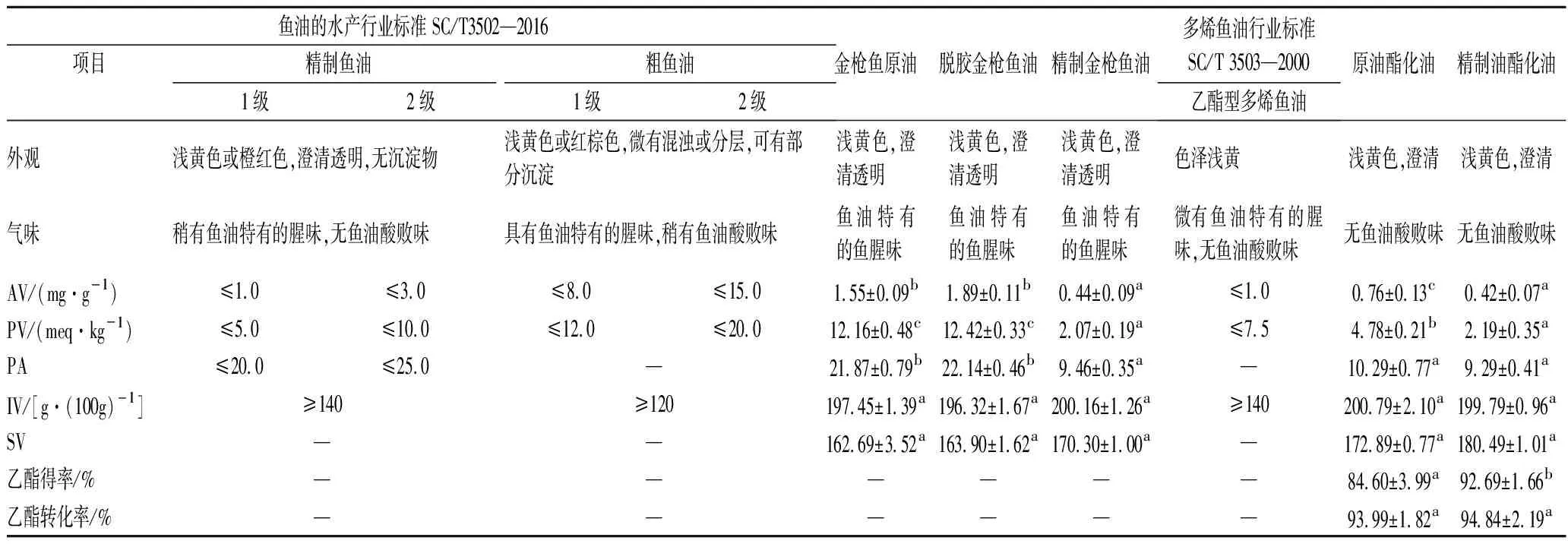
表1 金枪鱼油精制前后及其酯化油的理化指标Table 1 The physical and chemical indexes of the crude and refined tuna oil and fish oil ethyl ester
2.2 酯化前后鱼油脂肪酸组成
由表3可知,金枪鱼油精制前后及其酯化油共检测出25种脂肪酸,包括10种饱和脂肪酸(saturated fatty acid,SFA)、7种单不饱和脂肪酸(monounsaturated fatty acid,MUFA)以及8种PUFA。在4种油样的SFA中,棕榈酸(C16∶0)及其乙酯是含量最多的组分,占SFA的60%以上;油酸(C18∶1)及其乙酯是MUFA中含量最高的组分,该结果与之前的报道相一致[23]。EPA和DHA是PUFA最主要的成分,占比分别为91.90%、91.23%、90.69%和90.31%,且无显著性差异(P>0.05),EPA和DHA可作为新生儿发育必需的营养素及减低癌症风险的功能而受到关注[19],因此金枪鱼油可作为富含ω-3系脂肪酸产品的重要生产原料。
金枪鱼原油经脱胶脱酸或酯化处理后,PUFA含量出现略微降低,可能化学碱炼的化学试剂或高温导致PUFA的轻微降解(P>0.05),这与DE OLIVEIRA等[23]精炼鱼油过程中所观察到的现象相一致;另外,分子结构以及脂肪酸类型会影响酯化反应的速度以及平衡程度,鱼油中脂肪酸种类的差异会对酯化反应造成一定的影响,顺式的不饱和脂肪酸会延迟酯化反应的进行,进而导致PUFA乙酯含量降低[21]。金枪鱼原油和精制油经酯化后所形成的鱼油乙酯的PUFA和MUFA含量均无明显差异,可作为酯交换反应合成富含PUFA甘油酯、磷脂的优质反应底物。结合其理化性质和重金属含量分析,说明不通过精制处理的金枪鱼原油直接制备乙酯具有一定可行性。
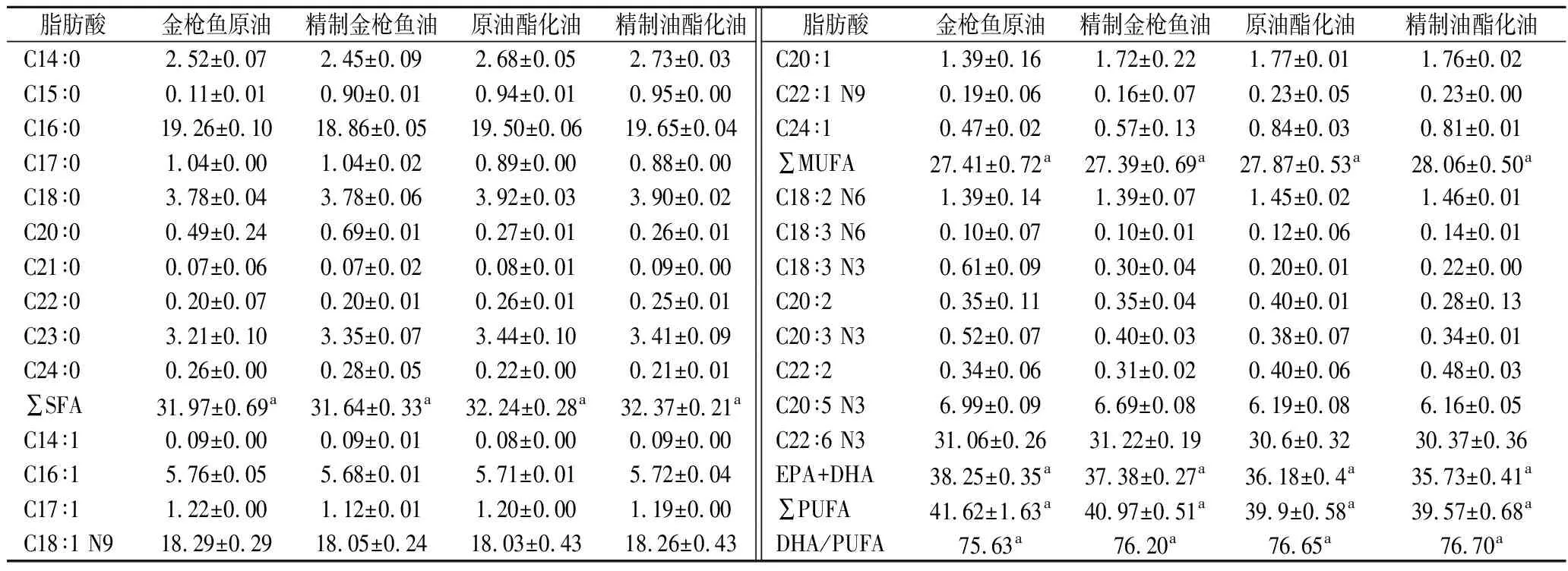
表3 金枪鱼油精制前后及其酯化油脂肪酸相对含量 单位:%
2.3 酯化前后鱼油FTIR分析
不同的分子结构以及原子间的振动在FTIR图中会有不同的响应[24],图2-a中标示了FTIR在4 000~650 cm-1的主要特征吸收峰,从鱼油样品的扫描光谱图中可看出,样品呈现出相似的FTIR图以及相同的油脂特征吸收峰;金枪鱼原油和精制油图谱相关系数为0.968,原油酯化油和精制油酯化油图谱相关系数为0.977,说明2种同类型的鱼油的结构无较大差异,与脂肪酸组成测定结果相一致。
结合图2-a和图2-b,2 924和2 854 cm-1处特征峰是饱和烷烃甲基不对称振动引起的,可反映油脂脂肪酸的链长及分子质量的大小[24],与SV值测定结果相吻合。3 025 cm-1处是烯烃双键上C—H伸缩振动引起,4种油样在该处吸光度一致,说明精炼和酯化并没有改变鱼油的不饱和程度,与表3脂肪酸含量变化结果相一致。3 472 cm-1处是氢过氧化物—OH键伸缩振动[13],与PV相对应,金枪鱼原油经精制和酯化后吸光度明显降低,与PV降低的结果相一致。值得注意的是,图2-a中,1 036 cm-1处出现了仅于酯化油中出现的特征吸收峰,推断其可能是乙酯乙氧基C—O振动产生,可作为检测油脂类型的指标。
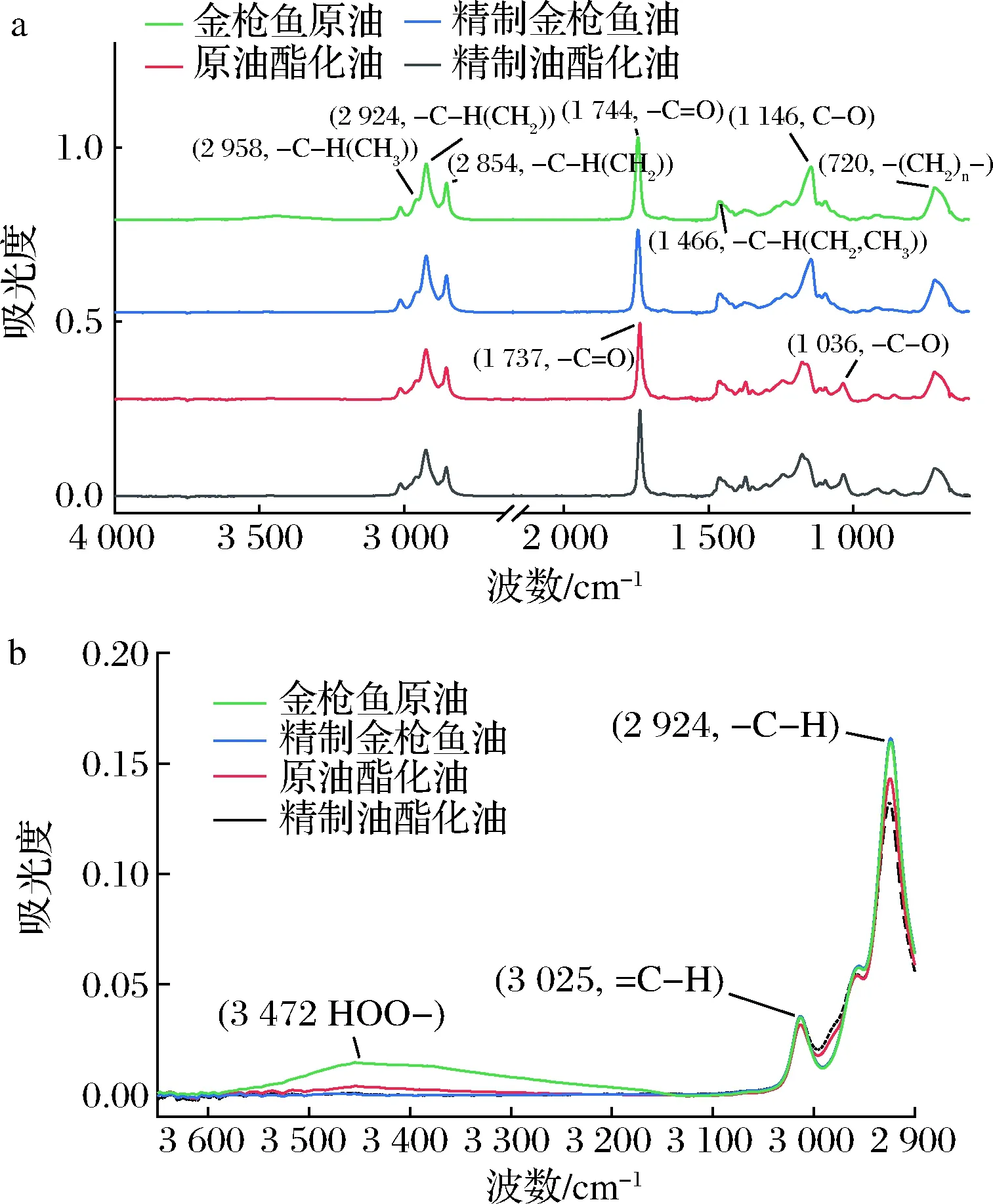
a-4 000~650 cm-1;b-3 600~2 900 cm-1图2 金枪鱼油精制前后及其酯化油FTIR图Fig.2 FTIR of the crude and refined tuna oil and fish oil ethyl ester
2.4 酯化前后鱼油挥发性成分
采用SPME-GC-MS法在4种鱼油样品中共检测出78种挥发性物质并使用面积归一化法计算各物质的相对含量,并使用ROAV法对其关键风味成分进行主成分分析(principal component analysis,PCA),结果如表4、图3和图4所示。
醛类是金枪鱼油嗅感的主要物质,主要由脂质自氧化产生,是反应鱼油氧化程度的重要指标;由于其具备较低的阈值,对鱼油挥发性风味贡献较大[14]。原油中检测出15种醛类,相对含量为(34.58±1.93)%,种类及含量明显高于其他3种鱼油(P≤0.05),与PA检测结果相一致。精制和酯化处理后,醛类物质明显降低,说明其样品氧化产物减少,品质上升。烃类是甘油三酯型鱼油含量最高的挥发性化合物,分别为(53.55±3.93)%和(77.04±4.23)%,与ZHANG等[14]的报道相似;醇类是脂肪酸的氢过氧化物2次分解产生的,可归因于ω-3和ω-6系不饱和脂肪酸脂氧合酶促过氧化过程,经精制处理,其含量降低69.58%(P≤0.05)。酯化油中醛酮等物质明显减少,而酯类物质增多,可能是一方面长链脂肪酸和乙醇结合时发生断链形成短链脂肪酸酯且鱼油中的酸、醇等其他物质的形式转化为了乙酯[3],另一方面,水洗过程中乙醇和酯化油液液分离以及真空干燥过程中达到了一定的脱臭效果[25],大幅减少了醛酮类挥发性成分。
鱼油的关键风味成分是由其相对含量和感觉阈值共同决定的。在金枪鱼原油和精制油中(E)-2-壬烯醛的相对含量较高且嗅觉阈值为0.08 μg/kg,对整体风味贡献最大,所以定义(E)-2-壬烯醛ROAVmax=100。在2种酯化油中,(E)-2-己烯醛被定义为ROAVmax=100,选择ROAV≥0.01的主体风味物质进行PCA,结果发现原油和精制鱼油在PCA中距离较远,说明两者区分度较高,其风味相差较大,且原油中的(Z)-5-辛烯醇、1-戊烯-3-酮、壬醛等赋予其浓郁的鱼腥味、蜡质味,而精制金枪鱼油中(Z,E)-2,6-壬二烯醛、1-辛烯-3-醇、己醛给予了其浓郁的脂香味、蘑菇味。2种酯化油在PCA得分图中距离较近,虽95%置信区间内并无交叉,但表明2种油脂的主要风味贡献物质种类及含量相近,其(E)-2-己烯醛、庚酸乙酯所赋予的青草味、果香味、脂肪味能够准确同原油、精制油进行区分。

表4 金枪鱼油精制前后及其酯化油中挥发性成分及其相对含量 单位:%

续表4
2.5 酯化前后鱼油氧化稳定性分析
Rancimat法通过测定鱼油氧化诱导时间以判断其氧化稳定性。在同一种Rancimat方法下,诱导时间越长,说明其稳定性越好[27]。脂质氧化速率和温度呈现指数变化,即ln(诱导时间)与温度呈线性关系,因此使用经验Q10法外推至25 ℃预测4种鱼油货架期。如图5所示,斜率越小,说明其氧化稳定性越低。在25 ℃下,精制金枪鱼油氧化稳定性>精制油酯化油≈粗鱼油酯化油>金枪鱼原油,货架期预测依次为224.75、180.50、176.50和123.00 h,2种酯化油氧化稳定性相似,但较同品质的甘油酯型鱼油相比更易氧化,与之前的报道相一致[28]。
由图5可看到,随着温度上升,诱导时间减少,在同一温度下,金枪原油的氧化诱导时间明显低于精制油和酯化油,这是因为其本身所含有的氢过氧化物在高温下迅速分解并引发油脂氧自由基链式传递反应[5],产生大量醛、酮、酸类物质促进油脂氧化,导致电导率迅速升高。经过精制和酯化处理后,自由基、金属元素等杂类物质的减少有效减慢了链式反应速率,使诱导时间延长。

图5 Rancimat法测定金枪鱼油精制前后及其酯化油的氧化稳定性Fig.5 The oxidation stability of the crude and refined oil from tuna and fish oil ethyl ester by Rancimat
3 结论
本研究使用黄鳍金枪鱼原油和精制油作为原料,碱法催化制备鱼油乙酯,从理化性质、重金属污染物、脂肪酸组成、挥发性化合物以及氧化稳定性角度探究原料鱼油对酯化鱼油得率和品质的影响。结果表明,高PV、高PA的金枪鱼原油制备的酯化油除PV值高于精制油酯化油(P≤0.05)外,其他理化性质、污染物含量、乙酯转化率同精制油酯化油均无显著性差异,均符合多烯鱼油行业标准SC/T 3503—2000,但得率略低于精制油酯化油,为(84.60±3.99)%(P≤0.05)。精制、酯化处理并不会使鱼油脂肪酸图谱发生改变,且有效减少了鱼油中醛、醇类挥发性化合物的数量,提高了其氧化稳定性,从PCA图中可观察到2种酯化油挥发性成分气味相似,(E)-2-己烯醛、庚酸乙酯所赋予的独特青草香味、果香味可有效同甘油酯型鱼油进行区分,因此,使用粗鱼油直接制备鱼油乙酯具有一定的可行性。该研究为食品级乙酯型鱼油的生产和功能研发提供实验依据。

