一种调味白酒发酵过程中微生物菌群结构及代谢研究
杨贵,张宿义,*,赵金松,4,张立强,杨艳,宋攀,冉茂芳,薛江林,林慧
1(四川轻化工大学 生物工程学院,四川 宜宾,644000)2(泸州老窖股份有限公司,四川 泸州,646000)3(国家固态酿造工程技术研究中心,四川 泸州,646000)4(四川省酒业集团有限责任公司川酒研究院,四川 成都,610000)
随着我国经济的快速发展,人民的生活水平逐渐提高,对白酒口味的需求越来越多元化,所以调味白酒一直是行业内研究的重点。调味白酒一般采用特殊工艺生产,因含有较多特定的香味成分及拥有独特风味,在酒体设计和勾调过程中,可以明显提高和弥补酒体在某些方面的不足,提升基础酒的香味和口感;其特点在于添加量少,起到画龙点睛的作用。魏志阳等[1]利用筛选自老白干酒醅中的一株高产乳酸干酪乳杆菌(Lactobacilluscasei)发酵制得乳酸发酵液,通过南极假丝酵母(Candidaantarctic)脂肪酶B催化乳酸发酵液与酒尾合成乳酸乙酯,并通过单因素试验和正交试验对其催化工艺进行了优化,最后通过蒸馏浓缩得到乳酸乙酯调味白酒。吴轩德等[2]在酿酒酵母转化L-苯丙氨酸合成β-苯乙醇的基础上,通过紫外诱变育种、好氧发酵与补料厌氧发酵的二步法工艺来研制β-苯乙醇调味白酒。目前针对调味酒的研究更多是在工艺方面,对酿造机理方面的研究相对较少;本研究是在创新设计并已成熟运用的调味白酒酿造工艺基础上,通过高通量测序揭示该发酵过程微生物群落演替的时空特征,并通过多元统计分析,解释微生物与理化指标的相关性以及微生物代谢间的差异,为进一步探究调味白酒的酿造机理和提高发酵过程的可控性提供依据,为满足消费者多元化需求以及白酒行业高质量发展奠定基础。
1 材料与方法
1.1 材料与试剂
主要材料:某酒厂调味白酒糟醅;其酿造工艺路线如图1所示。

图1 调味酒酿造工艺流程图Fig.1 Brewing process flow chart of flavoring Baijiu
该调味白酒酿造工艺是以浓香型白酒生产工艺为基础,结合其他香型白酒生产工艺,创新设计的一套调味白酒酿造工艺,采用了续糟配料、复合配料、高温堆积、高温流酒、混蒸混烧、分层蒸馏、长期贮存等工艺,酿造出具有总酯含量高、口感甜净,有明显焦糊香味的特殊调味白酒。
试验试剂:CTAB Buffer、V(氯仿)∶V(异戊醇)=24∶1、V(酚)∶V(氯仿)∶V(异戊醇)=25∶24∶1、聚乙二醇(polyethylene glycol,PEG)6000、氯化钠、无水乙醇、磷酸氢二钠、磷酸二氢钠、氢氧化钠、葡萄糖、盐酸、五水硫酸铜、酒石酸钾(均为分析纯),聚合化工。
1.2 仪器与设备
TL2010S中通量组织研磨仪,北京鼎昊源科技有限公司;ND1000微量紫外可见分光光度计,Nano drop;MLS-375L全自动灭菌锅,日本日立公司;DHG-9245A鼓风干燥箱,上海一恒科学仪器有限公司;DL-1 电炉,北京中兴伟业仪器有限公司;5804R高速冷冻离心机,德国艾本德公司。
1.3 实验方法
1.3.1 取样
同时跟踪相邻3口大小(3.2 m×2.4 m×1.8 m)一样的窖池,从入窖后,每7 d取1次样,共发酵35 d。每次从糟醅的上层、中层和下层分别取样,将3口窖池取自同一层次的样品置于无菌取样袋中立即密封混合均匀,再将其分为2份,1份保存在-20 ℃用于理化特性检测,1份保存在-80 ℃用于基因组DNA的提取。
1.3.2 理化指标检测
理化指标检测参照《泸型酒技艺大全》[3]。
1.3.3 DNA提取方法
称取10 g糟醅,用十二万基硫酸钠(sodium dodecyl sulfate,SDS)法提取糟醅中微生物的基因组DNA[4]。基因组DNA送往上海美吉生物医药科技有限公司进行高通量测序,测序数据在美吉生物云平台(https://icloud.majorbio.com/)进行处理。
1.3.4 数据分析
根据高通量扩增子测序数据,利用R-3.3.1 (stat)以及Kruskal-Wallis秩和检验,对α多样性指数组间差异检验分析。利用R-3.3.1 (vegan)进行冗余分析(redundancy analysis,RDA),分析理化指标与微生物群落间的相关性,并计算糟醅理化指标与微生物群落物种分布的解释率。利用R-3.3.1 (stat)、python-2.7 (stat) 计算物种-理化指标之间的相关性,构建出物种相关性网络图。利用PICRUSt2 (v2.2.0-b) 对标记基因(16S/ITS)序列进行功能丰度预测,获得每个样本中对应的功能信息和丰度信息。
2 结果与分析
2.1 理化指标分析
发酵过程中,糟醅的理化性质能够直观地体现出当时糟醅的发酵情况,通过动态监测发酵过程中糟醅的理化性质,进一步解释调味白酒发酵过程中的发酵机理。糟醅理化指标均以绝干状态计算(图2)。
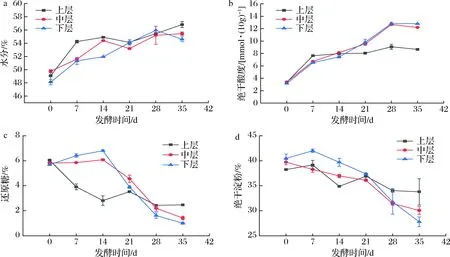
a-水分含量;b-酸度;c-还原糖含量;d-淀粉含量图2 调味白酒发酵过程中糟醅理化性质Fig.2 Physicochemical properties of fermented grains during flavoring Baijiu fermentation
如图2所示,在发酵过程中,微生物不断消耗糟醅中的淀粉、还原糖等,产生水分,使得水分含量呈现增长趋势(48.12±0.4)%~(56.82±0.45)%。酸是酒体中重要的风味物质,能够起到提味的作用,其主要由微生物代谢产生,随着发酵进行,糟醅酸度呈现逐渐增加趋势,由(3.17±0.06) mmol/10g增加至(12.8±0.04) mmol/10g,中下层糟醅酸度较高,可能是发酵过程中黄水向下渗透所致,酸度较高同时也会影响微生物的代谢活动及酶的活性等。还原糖[(1±0.08)%-(6.8±0.06)%]和淀粉含量[(27.8±0.98)%-(41.99±0.35)%]总体都呈现下降趋势,随着发酵的进行,淀粉被酶和有机酸逐渐分解为微生物可利用的糖;在发酵前期,因上层糟醅中含氧较高,微生物繁殖能力强,对糖类的消耗巨大,发酵前期上层糟醅淀粉和还原糖含量快速下降。由于水分向下渗透,将一部分淀粉和还原糖带到中下层,可能导致发酵前期中下层糟醅中的淀粉和还原糖的含量略有上升且下降缓慢,后期则在微生物的利用下迅速下降。
2.2 微生物多样性分析
如表1所示,随着发酵时间的增加,细菌群落的丰富度和多样性先增加后减少,而真菌群落的丰富度和多样性先增加后趋于稳定。
对Chao指数和Shannon指数进行差异性检验,如图3所示,在整个发酵期间,不同层糟醅微生物之间丰度和多样性无显著差异(P>0.05);而在发酵过程中存在显著差异,如图4-a所示,细菌在0~7 d丰富度变化明显(P>0.05),第7天之后的样本间丰富度变化差异显著(P<0.05),可能是微生物在0~7 d 在大量繁殖,使得丰富度增加,但由于窖池内酸度和酒精度不断增加,溶氧不断减少,环境极端性增强,窖池内微生物群落结构随之发生转变,导致微生物群落丰富度在第7天之后逐渐降低,并趋于稳定;与此同时,糟醅中微生物多样性也会随着微生物丰富度变化而变化。相反,在0~14 d,真菌微生物丰富度和多样性均呈现迅速增加的趋势,推测是真核微生物中,优势微生物大多是由酵母属、霉菌属等兼性厌氧或好氧微生物组成,从而使得在发酵前期有氧条件下能够迅速繁殖的同时,还能够在发酵后期厌氧环境下保持较高的丰富度和多样性。微生物群落丰富度和多样性在整个发酵过程中的变化情况与发酵温度前缓、中挺、后缓落遥相呼应,这也进一步证明在白酒酿造过程中,在不同发酵时间下微生物的代谢繁殖与温度、微生态环境变化有着一定的相关性。

a-细菌Chao指数Kruskal-Wallis秩和检验;b-细菌Shannon指数Kruskal-Wallis秩和检验;c-真菌Chao指数Kruskal-Wallis秩和检验;d-真菌Shannon指数Kruskal-Wallis秩和检验图4 不同发酵时间的糟醅微生物α多样性Chao、Shannon指数Kruskal-Wallis秩和检验Fig.4 Microbes in fermented grains at different fermentation times α diversity Chao, Shannon index Kruskal-Wallis H test注:“*”代表显著性差异,*,P<0.05;**,P<0.01;***,P<0.001(下同)
2.3 微生物群落分布特征分析
2.3.1 细菌微生物群落在属水平上的组成
基于16S rRNA高通量测序的序列数据分析表明,在发酵过程糟醅样品中细菌分布在28个门、68个纲、159个目、276个科、520个属、747个种以及1 617个ASV(amplicon sequence variants)集。这些细菌主要分布在厚壁菌门[Firmicutes(80%)]、变形菌门[Proteobacteria(16.33%)]、拟杆菌门[Bacteroidota(1.05%)]等。根据高通量测序结果,结合ASVs聚类分析结果和研究需求,将细菌微生物群落在属水平上相对丰度较大的菌属进行统计分析(图5)。
由图5所示,发酵第0天,醋杆菌属[Acetobacter(55.3%)]处于优势地位,发酵第7天,Acetobacter(9.11%)的优势地位被乳酸杆菌属[Lactobacillus(53.7%)]所取代;除此之外,优势物种还包括芽孢杆菌属(Bacillus)、高温放线菌属(Thermoactinomyces)、氨基杆菌属(Aminobacterium)、氢孢菌属(Hydrogenispora)、克罗彭斯特菌属(Kroppenstedtia)、产己酸菌属(Caproiciproducens)、红球菌属(Rhodococcus)、互营乙酸氧化菌属(Syntrophaceticus)等,这些微生物主要代谢产生乙醇、乙酸、乳酸、己酸等白酒中重要的风味物质及其风味前体物质[5-6]。值得注意的是,在发酵0~14 d,优势物种主要分布在Proteobacteria和Firmicutes。Proteobacteria类微生物一般都具有较强的固氮能力[7],发酵0~14 d,其丰度从82%降低至1.7%;在该门类中丰度最大的是Acetobacter,因溶氧量逐渐降低,丰度也从56%逐渐降低至1.1%。相反Firmicutes丰度由12%增加至97%;随着发酵的进行,在发酵0~7 d高含氧量条件下,芽孢杆菌大量繁殖,丰度由2.9%增加至5.8%,后因糟醅中溶氧量减少,丰度随之逐渐降低,并最终稳定在0.038%。在白酒酿造过程中,芽孢杆菌不仅能够通过自身代谢直接产生风味物质,还能够产生风味物质的前体物质,为其他微生物协同发酵和美拉德反应提供物质基础[8]。特别是Aminobacterium、Hydrogenispora、Caproiciproducens、Rhodococcus、Syntrophaceticus等在发酵第14天后才出现;有研究表明,Thermoactinomyces可产生耐高温α淀粉酶、丝氨酸蛋白酶、脱氢酶、多酚氧化酶和脲酶等[9];Aminobacterium属于Synergistetes门Synergistaceae科,是典型厌氧专性氨基酸降解细菌,在代谢氨基酸的同时能够产生脂肪酸[10],该菌在发酵后期出现,表明该调味酒在发酵后期产生了大量的氨基酸;Caproiciproducens是一类代谢产生氢气、丁酸和己酸的细菌,可提供己酸乙酯的前体物质己酸[6],Syntrophaceticus能够降解长链脂肪酸或丁酸产生氢气、乙酸、丙酸[11]。Lactobacillus是整个发酵过程中的优势物种,在发酵0~14 d,丰度从0.5%增加至94%,并最终稳定在95%以上至发酵结束;这是由于Lactobacillus是一类厌氧微生物,环境适应性强,具有较强的代谢碳水化合物产酸的能力,在白酒酿造过程中能够为其他微生物提供碳源以及形成风味前体物质,是白酒酿造过程中不可或缺的一类微生物。
2.3.2 真菌微生物群落在属水平上的组成
相对于细菌而言,真菌群落变化较为单一,分布在7个门、22个纲、41个目、100个科、172个属、264个种以及507个ASV集。其主要分布在子囊菌门[Ascomycota(75%)]和担子菌门[Basidiomycota(2.23%)]等(图6)。

a-真菌属水平丰度图;b-真菌属水平圈图图6 糟醅发酵过程中真菌属水平丰度图和圈图Fig.6 Bar and circos diagram of fungi genus in fermented grains during fermentation
如图6所示,真菌优势微生物包括伊萨酵母属(Issatchenkia)、丝衣霉属(Byssochlamys)、毕赤酵母属(Pichia)、哈萨克斯坦酵母属(Kazachstania)、嗜热子囊菌属(Thermoascus)、曲霉菌属(Aspergillus)、节担菌属(Wallemia)、耐干霉菌属(Xeromyces)、酵母菌属(Saccharomyces)等。随着发酵的进行,优势真菌Byssochlamys、Aspergillus和Kazachstania逐渐变为非优势真菌,Issatchenkia和Pichia逐渐变为优势真菌,且丰度在整个发酵过程中呈线性变化趋势,表明Lactobacillus对该发酵体系中的真菌抑制作用较弱,这也许是调味酒高酯的重要原因。在发酵第0天,Byssochlamys(59%)和Aspergillus(4.1%)处于绝对的优势地位,为淀粉酶和糖化酶的主要生产者,是发酵前期淀粉含量迅速下降、还原糖含量增加的主要原因;随着发酵的进行,糟醅中溶氧量逐渐降低,酸度逐渐增加,其丰度逐渐降低,至发酵结束,两者丰度都仅占1.2%;研究表明,曲霉属在发酵过程中能够分解原辅料中的淀粉和蛋白质,代谢产生大量的还原糖和氨基酸,其代谢产物是构成酒体风味与口感的重要物质基础[12]。在0~7 d,环境极端性较低时,Kazachstania大量繁殖,丰度从0.42%增加至25%,在发酵后期缓慢降低,至发酵结束丰度为3.7%;谭壹[13]研究发现,Kazachstania属中Kazachstaniasp.为浓香型白酒优势真菌微生物,且为好氧微生物[14];该调味酒工艺是在浓香型白酒工艺基础上创新设计,是该调味白酒中Kazachstania的主要来源,故推测发酵后期溶氧量低是Kazachstania丰度降低的主要原因。Issatchenkia和Pichia因具有一定的嗜酸性和乙醇耐受能力强[15]的特点,故丰度在发酵过程中不断增加;同时,在发酵前期,与乳酸杆菌属类微生物还存在争夺营养物质的竞争关系,由于乳酸杆菌的糖代谢能力强于酵母菌类微生物,故其生长速率远大于酵母菌。值得注意的是,Thermoascus在发酵后期的丰度激增,该类真菌可以分泌β-木聚糖酶、碱性耐热过氧化氢酶、超氧化物歧化酶、角质酶等酶类,可将植物细胞壁中木聚糖转化成木糖等,并具有产花果香类物质的能力,醇、酮和呋喃类是其主要的呈香载体物质,同时还能生成散囊菌特有的“菌花香”,所以该类菌可作为重要的产香功能菌[16]。
2.4 微生物群落结构和环境因素关联分析
为更好地反映微生物群落与糟醅理化性质之间的关系,本文通过R-3.3.1和python-2.7软件对其进行RDA,并基于Sperman相关性构建双因素相关性网络图(图7)。
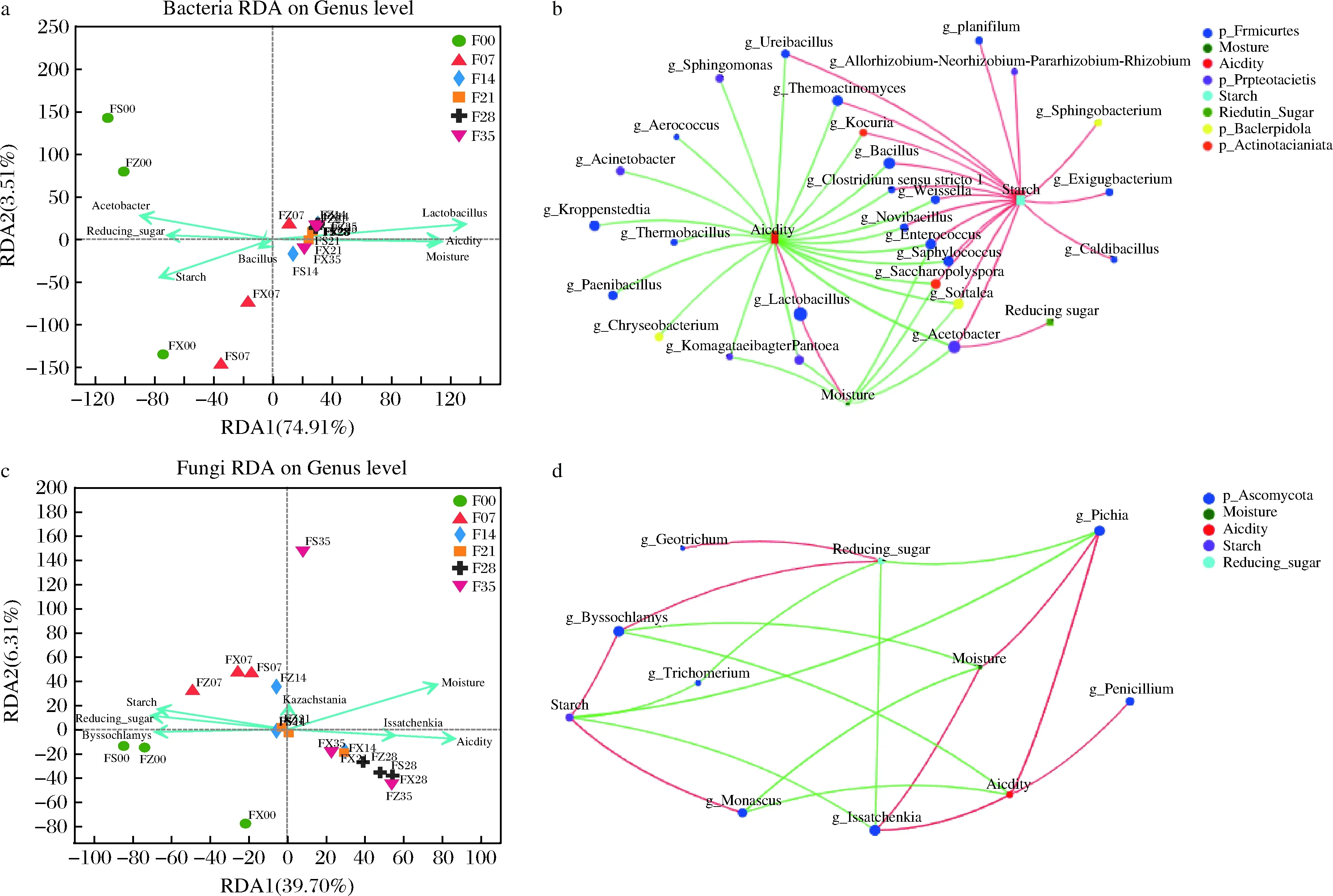
a-细菌RDA;b-细菌基于Sperman相关性的微生物-理化指标共现网络;c-真菌RDA;d-真菌基于Sperman相关性的微生物-理化指标共现网络图7 发酵过程中微生物与理化指标相关性分析Fig.7 Correlation analysis between microbes and physical and chemical indexes in fermentation process注:图b、d中红色和绿色分别代表正和负相互作用
根据RDA结果,糟醅理化性质对细菌和真菌群落微生物的分布解释率分别为78.42%和46.01%(图7-a、图7-c),说明糟醅理化性质与细菌群落分布有较高的相关性,与真菌群落分布有一定的相关性。同时,根据微生物与理化双因子相关性网络图(图7-b、图7-d),糟醅理化因子与大多数细菌和部分的真菌微生物都存在显著的相互作用。对细菌而言,淀粉和还原糖含量与Acetobacter、Bacillus等呈显著正相关;水分和酸度与Lactobacillus等呈显著正相关(图7-b)。对真菌而言,相关性网络结构相对简单,淀粉和还原糖含量与Byssochlamys、Monascus等呈正相关。水分和酸度与Issatchenkia、Pichia等呈正相关,与Byssochlamys、Monascus等呈负相关(图7-d)。酸度与第一优势微生物呈现出较强的正相关性,与其他多数微生物都呈现负相关性。而这主要是由于优势微生物在发酵过程中能够大量代谢产生乳酸、乙酸,从而抑制耐酸能力差的微生物生长繁殖,其次,Lactobacillus的代谢产物双乙酰,对很多腐败菌和致病菌都有抑制作用,双乙酰可通过革兰氏阴性菌精氨酸的结合蛋白反应,从而干扰精氨酸的利用,抑制革兰氏阴性菌的生长,这也可能是乳酸杆菌属微生物能够成为优势物种保证发酵体系稳定的原因之一。
2.5 细菌代谢通路预测分析
基于16S扩增子高通量测序数据,利用软件PICRUSt2对细菌群落微生物进行功能预测,如图8所示,结果表明,该调味白酒发酵过程中,在KEGG(Kyoto Encyloedia of Genes and Genomes)通路水平1上的分布相对稳定,其中,涉及代谢、遗传信息处理和环境信号处理的通路比例,分别为(77.44±0.81)%、(9.79±1.52)%和(5.58±0.26)%;可以看出,代谢途径丰度占比最大,因此进一步对代谢功能进行分析,如图9所示,随着发酵的进行,细菌微生物群落结构演替使得特定代谢功能丰度显著变化,氨基酸转运与代谢、碳水化合物运输和代谢以及核苷酸转运与代谢功能丰度呈现不断增长的趋势,且丰度最大,可能由于调味白酒采用高氮配料工艺,蛋白质含量丰富,使能利用含氮化合物的微生物大量繁殖,相应的氨基酸转运与代谢以及核苷酸转运与代谢功能丰度呈现增长趋势。其中,乳酸菌对糊精、D-果糖、D-半乳糖、D-麦芽糖、纤维二糖、D-甘露糖等多种糖类物质的利用较强[17],而Bacillus可以合成淀粉酶、蛋白酶、脂肪酶并催化产生各种风味物质的前体[18],Lactobacillus对Bacillus的取代使得细菌类微生物在发酵后期对碳源(淀粉、蔗糖、果糖、甘露糖和半乳糖)的分解利用加强,从而碳水化合物运输和代谢丰度也逐渐提高。相反,辅酶转运与代谢、无机离子转运与代谢、次生代谢物生物合成、运输和分解代谢丰度呈现出不断减小的趋势,可能由于微生物多样性逐渐降低,发酵环境中微生物的代谢途径多样性也逐渐降低,使得辅酶、无机离子以及次级代谢物主要为优势微生物所利用,从而丰度不断减小。而脂质在白酒酿造过程中利用程度低,故其丰度在整个发酵过程中相对稳定。

T-出窖上层糟醅;M-出窖中层糟醅;B-出窖底层糟醅图8 调味白酒发酵过程中细菌微生物群落KEGG通路分布Fig.8 Distribution of KEGG pathways of bacterial community during roasted flavoring Baijiu fermentation

T-出窖上层糟醅;M-出窖中层糟醅;B-出窖底层糟醅图9 调味白酒发酵过程中细菌微生物群落主要COG代谢功能分布Fig.9 Distribution of main COG metabolites in the bacterial community during flavoring Baijiu fermentation
3 结论与讨论
本文采用高通量测序技术和常规理化分析等方法,对调味白酒发酵过程中微生物群落时空演示特征及其与理化指标间相关性以及细菌代谢功能进行分析。结果表明,随着发酵的进行,不同层糟醅微生物之间丰度和多样性虽存在差异,但并不显著,而在发酵过程中存在显著差异;细菌群落的丰富度和多样性先增加后逐渐减少,真菌群落则先增加并逐渐趋于稳定;其中,优势细菌主要有Lactobacillus、Acetobacter、Bacillus等,且Lactobacillus在发酵第14天后占据绝对优势(>94%);优势真菌主要有Issatchenkia、Byssochlamys、Pichia、Kazachstania、Thermoascus等,且在整个发酵过程中,Lactobacillus对真菌的抑制较弱,使得酵母属微生物不受限制的正常代谢,这或许是调味酒高酯的原因之一。相关性分析显示,淀粉和还原糖含量与Acetobacter、Bacillus、Byssochlamys等呈显著正相关,与Trichomerium、Pichia等呈负相关。酸度和水分与Lactobacillus、Issatchenkia、Pichia等呈正相关,与Acetobacter、Bacillus、Byssochlamys、Monascus等呈负相关;这与李小龙[19]的研究趋于一致。随着发酵的进行,细菌在KEGG通路水平1上的分布相对稳定,涉及代谢、遗传信息处理和环境信号处理的通路比例分别为(77.44±0.81)%、(9.79±1.52)%和(5.58±0.26)%;与芝麻香型白酒发酵相比,该调味酒在发酵前期细菌多样性更丰富,代谢通路丰度更大,且以氨基酸转运与代谢、碳水化合物运输和代谢以及核苷酸转运与代谢为主,并随发酵时间不断增加,这与李小龙[19]对芝麻香型白酒代谢路径的研究结果相反,推测是因为配料和工艺不同,该调味酒在发酵过程中能更多保留产淀粉酶、脂肪酶、蛋白酶和脱氢酶等的微生物,从而更有利于美拉德反应。

