纳米氢氧化铜暴露对水培生菜生长变化的影响
丁润润 童玲 张议戈 高露露 史鸿飞 章伟成 方涛
(1.南阳师范学院生命科学与农业工程学院,南阳 473061;2.南阳师范学院水资源与环境工程学院,南水北调中线水源区水安全河南省协同创新中心,南阳 473061;3.中国科学院水生生物研究所,武汉 430072;4.中国科学院大学,北京 100049)
随着纳米技术的迅猛发展,纳米材料被广泛应用于农业、畜牧、工业、医药和军工等领域[1]。纳米材料因其特有的比表面积、分散性、覆盖率和黏附性[2]等优点促就了它在农药领域上的广阔应用前景[3—5]。“十一五”计划开始,我国陆续通过973计划、国家重点研发计划和中国农业科技创新工程等项目大力发展新型纳米农药[6]。2019年,纳米农药被IUPAC(国际纯粹与应用化学联合会)评为将改变世界的十大化学新兴技术之首[7]。纳米氢氧化铜(nano-Cu(OH)2)作为新型纳米农药之一备受重视[8],其高效杀菌能力将有效缓解作物种植过程中农药滥用的现状。基于nano-Cu(OH)2安全设计与应用的需求,它对靶标和非靶标生物体内的毒性机制的研究还需要深入开展。
生菜(Lactuca sativaL.)是深受大众喜爱的一种富含多种矿物质与营养元素的蔬菜[9]。在追求生菜高产量和品质的过程中往往会出现农药滥用的现象[10]。作为新型纳米农药之一的nano-Cu(OH)2具有改善传统农药(有机磷和有机铜农药等)滥用的现状。但是,nano-Cu(OH)2在施用过程中是否会对生菜生长产生不利影响还有待进一步研究[11,12]。
本实验选取生菜作为研究对象,探讨不同浓度与暴露时间下nano-Cu(OH)2对生菜株高、根长、鲜重和叶绿素等指标的影响,同时考察生菜体内抗氧化酶与MDA含量的变化,以期为nano-Cu(OH)2的设计研发和合理施用提供一定的理论基础与必要的数据支撑。
1 材料与方法
1.1 实验仪器与材料
实验仪器:ZEISS Sigma 500 FE型扫描电镜(SEM)、Multiwave 3000微波消解仪、电感耦合等离子体发射光谱仪(岛津ICP-9800)、Zeta电位分析仪、Eppendorf 5810R离心机、Heal Force超纯水仪和SpectraMaxM5多功能酶标仪等。
Nano-Cu(OH)2购自北京中科雷鸣科技有限公司,其商用信息表明nano-Cu(OH)2的直径为40—80 nm,长度为1—2 μm。CuSO4(Cu2+)购自天津市光复科技发展有限公司。Hoagland营养液配方[13]为(不含铜):Ca(NO3)2·4H2O(945 mg/L),KNO3(607 mg/L),NH4H2PO4(115 mg/L),MgSO4·7H2O(493 mg/L),H3BO3(2.86 mg/L),MnSO4·7H2O(2.13 mg/L),ZnSO4·7H2O(0.22 mg/L),H2MoO4·2H2O(0.02 mg/L)和铁盐溶液(FeSO4·7H2O,5.57 mg/L;EDTA-2Na,8.5 mg/L)。化合物均购自天津市光复科技发展有限公司,纯度>99%。生菜种子购自南阳种子公司。超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和丙二醛(MDA)等测定试剂盒均从南京建成生物工程研究所购置。
1.2 实验方法
纳米氢氧化铜表征测定 取适量待检样品均匀平铺在碳导电胶上,用洗耳球吹去残余样品,处理完成后上机待测,电压为3 kV(图1A)。
生菜的培养与暴露生菜种子经10%的H2O2杀菌消毒(30min)后用超纯水冲洗干净,并转移至铺有湿润纱布的培养皿中避光催芽3d(16℃)[14—16]。3d后,将发芽的生菜种子移至条件为25℃,16h(光照)和20℃,8h(黑暗)的恒温光照培养箱中驯化3周,且每周的第3和第7天更换营养液。随后将生菜移栽至装有Hoagland营养液的玻璃三角瓶(250 mL)中继续驯化一周并选取长势一致的生菜[株高=(19.27±2.72) cm,根长=(13.77±2.87) cm和鲜重=(0.31±0.06) g]用于涂抹暴露实验。
涂抹暴露实验设置空白对照(纯水)、1 mg/L nano-Cu(OH)2、50 mg/L nano-Cu(OH)2和50 mg/L Cu2+(CuSO4)处理组(各3个重复)。标记生菜最外层的4—5片老叶并用于涂抹暴露实验,每天涂抹两次,每次涂抹两遍(使用无菌棉签将上述溶液均匀涂抹在标记叶片的正面)。分别在第7、第14、第21和第28天进行实验取样,所有指标测定前均使用10 mmol/L EDTA-2Na清洗实验样品,消除样品表面Cu的残留对测定结果的影响。
生物量及酶的测定生菜的株高、根长和鲜重每周测定2次。生菜体内(老叶、新叶和根)SOD、POD、CAT和MDA的含量严格按照试剂盒提供的方法进行测定。上述酶分别在第7、第14、第21和第28天进行测定(4个平行),并将其结果汇总用以阐明在整个28d暴露期生菜体内抗氧化酶和MDA含量的整体响应水平。
叶绿素含量的测定称取适量生菜鲜叶[m(鲜重),不含中脉],放入含有1 mL无水乙醇的研钵中研磨。研磨后的样品用80%丙酮定容(V)并浸提。浸提后的样品经0.22 μm滤膜(醋酸纤维素)过滤后测定其在663和645 nm处的吸光度,根据Lambert-Beer定律[公式(1)-(3)]计算滤液的叶绿素含量[17]:

Cu含量的测定生菜老叶、新叶和根经10 mmol/L EDTA-2Na清洗后置入纸皮袋于80℃烘至恒重。称取适量样品[m(干重)]并加入6 mL浓硝酸和高氯酸(3∶1)[18]于消解罐中150℃消解过夜,随后230℃下赶酸至液体且澄清透明(<200 μL)。消解后的样品用~2%硝酸定容(V),经0.22 μm滤膜(醋酸纤维素)过滤后使用ICP测定Cu的含量[C(测)],同时设置3个水样用作空白消除误差。实验数据代入公式(4)计算生菜根、老叶和新叶中铜的含量:
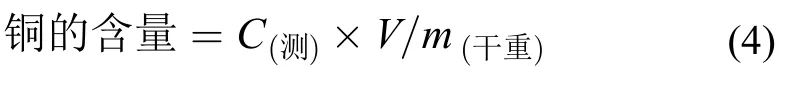
1.3 数据处理
数据结果表示为平均值±标准偏差,并采用Sigmaplot 12.5进行单因素方差分析(One-way ANOVA),设显著水平为*P<0.05,极显著水平为**P<0.01。
2 结果与讨论
2.1 Nano-Cu(OH)2表征分析
Nano-Cu(OH)2为棒状,直径为40—80 nm,长度为1—2 μm (图1A),与商用信息相吻合。水合粒径(DLS)测定结果表明,nano-Cu(OH)2(1 mg/L)在纯水中的粒径为(1084.97±907.29) nm,Zeta电位为(-13.33±0.21) mV。这说明nano-Cu(OH)2在水环境中具有一定的稳定性。
2.2 Nano-Cu(OH)2和Cu2+暴露对生菜生物量的影响
与空白对照相比,50 mg/L的Cu2+暴露对生菜的株高产生了一定的抑制作用(图1B),且其引起的抑制作用在第7至第10天尤为显著(P<0.05)。但是,Cu2+对生菜株高的抑制作用在暴露后期逐渐消失(17—28d)。值得注意的是,在暴露初期nano-Cu(OH)2对生菜株高产生了一定的抑制作用但并不显著(P>0.05)。相比Cu2+与nano-Cu(OH)2暴露的实验结果表明,离子形态的Cu可能是影响生菜株高的关键因素。但李伟琦[19]关于Ag在生菜体内富集的研究表明,Ag对生菜的有害作用与施用Ag的形态无关(AgNPsvs.Ag+)。上述不同点可能是本实验中nano-Cu(OH)2的粒径较大不易穿过生菜的细胞壁,而离子形态的Cu能相对快速与有效地被生菜吸收,进而引起毒害效应。López-Moreno等[20]研究也发现经ZnO NPs暴露后,大豆[Glycine max(Linn.)Merr.]组织中的Zn以Zn2+而非ZnO NPs形式存在,毒害作用源于ZnO NPs溶出的Zn2+,这与本研究的结果一致。同对株高的影响相似,50 mg/L Cu2+暴露下的生菜根长(图1C)与对照组相比有所下降,且在第10天表现出显著差异(P<0.05),说明Cu的离子形态可能也是影响生菜根长的关键因素。前期研究也发现,豆瓣绿[Peperomia tetraphylla(Forst.f.)Hook.et Arn.]的营养液中添加外源CuSO4后,它根系的生长受到了抑制[21]。与空白对照相比,1 mg/L nano-Cu(OH)2暴露的生菜鲜重在第28天显著增加(P<0.05),但在50 mg/L Cu (nano-Cu (OH)2和Cu2+)暴露条件下,生菜叶片边缘在第14天暴露期出现干枯泛黄的现象(图2C和图 2D),且在第28天,干枯泛黄的叶片受到不可逆的损伤而出现脱落。生菜在暴露初期(0—14d)对Cu2+与nano-Cu(OH)2胁迫具有一定的响应,主要表现为株高、根长和鲜重的下降,在暴露后期(17d)生菜的生长得到一定的恢复。肖梦婷等[22]在研究Cr胁迫对油菜(Brassica napusL.)株高,鲜重实验中发现同样的现象,其原因可能是植物具有自我防御机制,抑制自身对重金属过多的积累。Nano-Cu(OH)2在28d暴露期符合“低促高抑”的现象,这可能与暴露期间生菜体内积累过多的Cu密切相关。
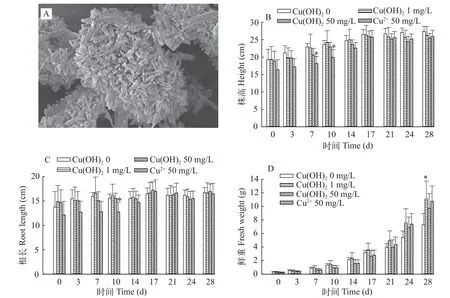
图1 纳米氢氧化铜扫描电镜图(A)和Nano-Cu(OH)2和Cu2+暴露28d对生菜株高(B)、根长(C)和鲜重(D)的影响Fig.1 SEM of nano-Cu(OH)2 (A);Effects of nano-Cu(OH)2 and Cu2+ during 28 days exposure of lettuce height (B),root length (C) and fresh weight (D)
2.3 Nano-Cu(OH)2和Cu2+暴露过程中生菜体内Cu含量的变化
在暴露初期(7d,图 3A)与空白组相比,生菜老叶、新叶和根中Cu的含量并无显著性增加(P>0.05),但是老叶中Cu的含量表现出一定程度富集,这主要因为老叶是直接暴露的器官。在暴露第14天,50 mg/L Cu2+暴露组中老叶Cu的含量有了极显著的增加(P<0.01),同时,50 mg/L的Cu [nano-Cu (OH)2和Cu2+]暴露条件下新叶中Cu的含量也有显著增加(P<0.05)。这说明暴露初期(0—14d),作为直接暴露器官的老叶在受到一定程度的损伤后,其体内Cu的含量出现显著性的累积效应,这可能是导致老叶边缘损伤的直接与不可忽视的原因。值得注意的是,在第14天,老叶中的Cu开始向新叶和根中转移,且在新叶中出现了显著的累积(P<0.05)。
Nano-Cu(OH)2和Cu2+暴露第21天,与空白组相比,生菜的老叶、新叶和根中Cu的含量均无显著性变化(P>0.05)。在第28天的1 mg/L nano-Cu(OH)2和50 mg/L Cu2+暴露组中,根部Cu的含量比空白组有了极显著的升高(P<0.01),但老叶中Cu的含量仍旧低于空白对照。这说明生菜受到长期高浓度Cu胁迫时,老叶会受到不可逆的损伤(图2C和2D),从而阻断了Cu在老叶中进一步的富集。所以相比第14和第21天(图3B和3C),Cu在新叶中的有效富集也逐渐消失。有趣的是,高浓度Cu暴露组中,根部Cu的含量有了极显著地升高(P<0.01),这可能是因为前期累积在老叶和新叶中的Cu转移到根部。实验结果表明,Cu离子可能是nano-Cu(OH)2暴露与累积的有效形态。与本研究结果不同的是,Ag[14]在大豆体内现出了优先向根部转移的特性与规律,这表明不同的纳米材料在植物体内的吸收转运机制不同。

图2 生菜暴露于nano-Cu(OH)2和Cu2+14 (A、B、C和D)侧视图和28d (E、F、G和H)俯视图表观的特征Fig.2 Side (A,B,C and D) and top (E,F,G and H) view of lettuce after 14d and 28d exposure to nano-Cu(OH)2 and Cu2+

图3 Nano-Cu(OH)2和Cu2+暴露7d(A)、14d(B)、21d (C)和28d (D)生菜体内Cu含量的变化Fig.3 The amount of Cu in lettuce after 7d (A),14d(B),21d (C) and 28d (D) exposure to nano-Cu (OH)2 and Cu2+
2.4 Nano-Cu(OH)2和Cu2+暴露对生菜叶绿素含量的影响
与空白对照相比,在nano-Cu(OH)2和Cu2+暴露初期(7—14d),生菜老叶和新叶中叶绿素a(Chl.a)和叶绿素b(Chl.b)的含量均无显著性变化(P>0.05),除了50 mg/L nano-Cu(OH)2暴露条件下促进了新叶中Chl.b含量的显著增加(P<0.05,图 4B)。在50 mg/L Cu2+暴露第21天,老叶中Chl.b的含量有了显著增加(P<0.05,图 4C)。在nano-Cu(OH)2和Cu2+暴露第28天,生菜叶片中叶绿素的含量没有显著变化。结合图 3C、3D和图 4D说明:(1)长期高浓度Cu胁迫会抑制生菜老叶中叶绿素的合成,使得老叶受到不可逆的损害而出现失绿脱落等现象;(2)前期生菜老叶中富集的Cu仍旧可以向新叶中转移,弥补了新叶中Cu的缺乏(Hoagland营养液无Cu培养),从而促进了新叶的生长。类似地,随着AgNPs[14]暴露浓度的升高,大豆叶片中叶绿素的含量呈下降的趋势(P<0.05)。在空心菜(Ipomoea aquaticaForsk.)[23]、梭鱼草(Pontederia cordataL.)[24]的相关研究中同样证实低浓度的Cu能促进植株的生长,而高浓度的Cu会降低PSⅡ的反应活性,损伤植物的叶绿体或类囊体等来抑制植株的生长。

图4 Nano-Cu(OH)2和Cu2+暴露7d(A)、14 d (B)、21d (C)和28d (D)对生菜叶绿素含量的影响Fig.4 The content of chlorophyll in lettuce after 7d (A),14d (B),21d (C) and 28d (D) exposure to nano-Cu(OH)2 and Cu2+
2.5 Nano-Cu(OH)2和Cu2+暴露对生菜体内抗氧化酶和MDA含量的影响
由图 5A可知,尽管暴露组的老叶、新叶和根中SOD含量与空白组相比均无显著性变化(P>0.05),但是50 mg/L nano-Cu(OH)2和Cu2+暴露组中老叶的SOD含量仍旧分别增加了8%和16%。据文献报道,当小麦花药[25]、菜心(Brassica raga syn.campestrisL.ssp.Chinensis var.utilisTsen et Lee)[26]和水培生菜[27,28]等受到外来胁迫时,它们体内会大量生成SOD以歧化胁迫产生的超氧自由基,从而达到保护植株的作用[29,30]。在本研究中,高浓度Cu胁迫下,生菜体内SOD含量出现增长趋势,有利于激发其保护机制;低浓度Cu暴露下生菜未受影响表现为SOD的含量变化较小。
Cu暴露对生菜老叶、新叶和根中CAT的含量没有显著影响(P>0.05,图 5B)。与空白对照相比,暴露组生菜根部中CAT含量呈下降趋势,这可归因于老叶中积累的Cu向根部转移从而抑制了生菜根部藻类的生长,使得暴露组中根部CAT含量相对较低。类似的,赵兰枝等[21]研究水培中抑制绿藻生长的方法时发现,低浓度的Cu(CuSO4)会抑制营养液中绿藻的生长,同时促进植物根系的伸长。
与空白对照相比(图5C),高浓度Cu暴露组[50 mg/L nano-Cu(OH)2和50 mg/L Cu2+]下老叶中POD的含量有极显著的增加(P<0.01),说明POD有效地清除了生菜老叶中累积的H2O2,降低自由基的含量减轻膜脂过氧化对老叶的伤害。相关研究也证实,葡萄(Vitis viniferaL.)常温储存的过程中POD活性不断升高用于清除体内累积的H2O2[31],Cd胁迫诱导生菜体内POD酶基因的大量表达,抵御Cd胁迫的伤害[32]。在本实验中,Cu胁迫虽然提高了POD的含量,但长期高浓度的Cu胁迫超出了POD清除有害物质的负荷,对生菜造成不可逆的损伤(图2C和2D)。

图5 Nano-Cu(OH)2和Cu2+暴露28d对生菜体内SOD (A)、CAT (B)、POD (C)和MDA (D)含量的影响Fig.5 Levels of SOD (A),CAT (B),POD (C) and MDA (D) in lettuce during 28 days exposure to nano-Cu(OH)2 and Cu2+
Cu暴露对生菜老叶、新叶和根中MDA含量的变化没有显著影响(P>0.05,图 5D)。但与空白对照相比,1 mg/L nano-Cu(OH)2暴露条件下老叶中MDA的含量降低了9%,50 mg/L nano-Cu(OH)2、50 mg/L Cu2+暴露条件下MDA的含量分别升高了8%和16%。这说明生菜在1 mg/L nano-Cu (OH)2的暴露下一定程度上促进了生菜的生长,在高浓度的暴露条件下老叶和新叶均受到了不同程度的损伤。老叶中MDA含量上升的趋势与图 2C和2D中生菜表观变化现象相符合。同样地,孟媛[33]的研究表明,Cd胁迫下生菜、菠菜(Spinacia oleraceaL.)和茼蒿(Chrysanthemum coronariumL.)体内MDA含量均呈现升高的趋势(P>0.05)。以上结果表明,低浓度nano-Cu(OH)2暴露可以促进生菜的生长,高浓度nano-Cu(OH)2暴露则会对生菜产生毒害作用,抑制其生长。
3 结论
综上所述,与nano-Cu(OH)2相比,Cu2+暴露对生菜产生的毒害作用更为严重;nano-Cu(OH)2对生菜的主要致毒机理来源于它溶出的铜离子。在nano-Cu(OH)2和Cu2+暴露初期,Cu会先富集到老叶中(靶器官)且不会对生菜的生长产生显著影响。随着暴露时间的延长,低浓度nano-Cu(OH)2促进了生菜的生长;高浓度的nano-Cu(OH)2和Cu2+胁迫对生菜产生不可逆的损伤,表现为生菜叶片干枯变黄脱落,此时生菜主要通过调控体内的SOD和POD等抗氧化酶的含量来抵御Cu的胁迫伤害。

