灰葡萄孢对氟唑菌酰羟胺不同敏感型菌株的生物学特性
杨可心, 毕秋艳, 吴 杰, 路 粉, 王文桥, 韩秀英, 赵建江
(河北省农林科学院 植物保护研究所,河北省农业有害生物综合防治工程技术研究中心,农业农村部华北北部作物有害生物综合治理重点实验室,河北 保定 071000)
灰葡萄孢Botrytis cinerea可侵染番茄的茎、叶、花和果实等部位,引起灰霉病。灰霉病是设施番茄生产上的重要病害,一般可造成番茄减产10%~20%,严重时达60%以上[1]。目前化学防治仍是控制该病害的主要手段。然而,灰葡萄孢具有繁殖速度快、遗传变异大和田间适合度高等特点,已被国际杀菌剂抗性行动委员会 (Fungicide Resistance Action Committee, FRAC) 划分为具有高抗药性风险的病原菌。目前,多个国家报道了不同作物上的灰葡萄孢已对苯并咪唑类的多菌灵、N-苯氨基甲酸酯类的乙霉威、二甲酰亚胺类的异菌脲和苯氨基嘧啶类的嘧霉胺等多种杀菌剂产生了抗性[2-5]。
氟唑菌酰羟胺是由先正达公司于2018 年研发上市的新型琥珀酸脱氢酶抑制剂类 (SDHIs) 杀菌剂,其通过抑制病原菌呼吸作用电子传递链中琥珀酸脱氢酶的活性阻碍其能量代谢,从而显示出抑菌活性[6]。氟唑菌酰羟胺对禾谷镰刀菌Fusarium graminearum、核盘菌Sclerotinia sclerotiorum和大豆尾孢菌Cercospora sojina等病原菌均具有良好的抑制作用[7-9]。目前,该药剂已在中国登记用于防治小麦赤霉病和油菜菌核病[10]。
前期研究表明,氟唑菌酰羟胺对番茄灰霉病具有良好的防治效果[11]。SDHI 类杀菌剂由于其作用位点单一已被FRAC 归为中度抗性风险杀菌剂,而有关氟唑菌酰羟胺不同敏感型灰葡萄孢菌株的抗性遗传稳定性、产孢量、致病性等生物学性状如何尚未见报道。鉴于此,本研究以灰葡萄孢对氟唑菌酰羟胺具有不同敏感性的菌株为研究对象,比较不同水平抗性菌株与敏感菌株之间的生物学性状的差异,研究抗氟唑菌酰羟胺灰葡萄孢菌株的适合度,旨在为灰葡萄孢对氟唑菌酰羟胺的抗性治理及氟唑菌酰羟胺的合理应用提供理论依据。
1 材料与方法
1.1 试验材料与仪器
1.1.1 供试药剂 98%氟唑菌酰羟胺 (pydiflumetofen)原药,先正达 (中国) 投资有限公司。将原药溶于适量甲醇中,配成104mg/L 母液,置于4 ℃冰箱中保存。
1.1.2 供试培养基
PDA 培养基:马铃薯200 g/L,葡萄糖20 g/L,琼脂粉15 g/L,蒸馏水定容至1 L。
WA 培养基:琼脂粉15 g,蒸馏水定容至1 L。
PA 培养基:马铃薯200 g/L,琼脂粉15 g/L,蒸馏水定容至1 L。
1.1.3 供试菌株 从田间发病的番茄果实上采集分离并经敏感性测定后,选取8 个灰葡萄孢对氟唑菌酰羟胺不同敏感型菌株,分别为:敏感菌株BLH5 和WP7,低抗菌株WP8 和WP9,中抗菌株WP3 和WP6,以及高抗菌株WPE8 和WPE9。实验室驯化高抗菌株BLH5F,由敏感菌株BLH5在含10 mg/L 氟唑菌酰羟胺的PDA 培养基上继代培养,逐步提高药剂浓度,直至菌株能在含500 mg/L 氟唑菌酰羟胺的PDA 平板上生长而获得抗性菌株[12]。依据灰葡萄孢对氟唑菌酰羟胺的敏感基线 ( 0.3717 ± 0.2744 ) mg/L[11],参照联合国粮农组织(FAO)抗药性划分标准[13],即测试菌株的EC50值是敏感基线的5~10 倍即为抗性菌株。本研究中抗药性水平的划分依据抗性倍数 (resistance factor, RF),划分标准为[4]: RF<10 的为敏感菌株(S);10≤RF<50 的为低抗菌株 (LR);50≤RF<100 为中抗菌株 (MR);RF≥100 的为高抗菌株 (HR) (RF = 供试菌株EC50/敏感基线)。
1.1.4 供试仪器 BX51 显微镜 ,奥林巴斯株式会社;DYY-8C 电泳仪,北京六一生物科技有限公司。
1.2 试验方法
1.2.1 灰葡萄孢对氟唑菌酰羟胺不同敏感型菌株抗性遗传稳定性测定 分别将各供试菌株在无药PDA 平板上以菌丝体继代培养10 代,每代培养3 d。将第1 代和第10 代菌株接种至含不同质量浓度氟唑菌酰羟胺的PDA 平板上 (抗药性菌株接种的药剂质量浓度为500、100、50、10、5 和1 mg/L;敏感菌株接种的药剂质量浓度为10、5、1、0.5、0.1 和0.05 mg/L),于24 ℃下培养72 h 后,采用十字交叉法测量各处理菌落直径 (mm)。每处理重复3 次,计算药剂对各菌株的EC50值和各抗性菌株的抗性倍数 (RF = 抗性菌株EC50值/敏感基线)及敏感性变异指数 (FSC = RF第10代/RF第1代)[14]。
1.2.2 灰葡萄孢对氟唑菌酰羟胺不同敏感型菌株菌丝生长速率、产孢量、孢子萌发率及致病性测定
1.2.2.1 菌丝生长速率的测定 采用菌丝生长速率法[15]分别将各供试菌株 (直径5 mm) 接种至PDA平板上,于24 ℃ 黑暗培养 72 h 后测量菌落直径。每个菌株重复3 次,计算菌丝生长速率。试验重复3 次。
1.2.2.2 产孢量的测定 各菌株先在24 ℃下培养72 h 后,再在黑暗条件下培养7 d。向每个平板中加入无菌水10 mL,用涂布器刮下分生孢子,然后用4 层纱布过滤孢子悬浮液,并将孢子悬浮液定容至10 mL,在振荡器上振荡 1 min 使孢子充分分散均匀。用血球计数板在显微镜下计数,测定各菌株的产孢量[16]。试验重复3 次。
1.2.2.3 孢子萌发率的测定 将孢子悬浮液用无菌水配制成孢子浓度为105个/mL。取 40 μL 孢子悬浮液均匀涂布在WA 平板上,于 23 ℃、黑暗条件下培养 10 h,调查分生孢子萌发情况,计算各菌株分生孢子的萌发率[16]。试验重复3 次。
1.2.2.4 致病性的测定 将各供试菌株 (直径5 mm) 分别接种至番茄叶片背面中央,叶柄用脱脂棉裹好,置于铺有湿滤纸的150 mm 的培养皿中,于24 ℃、照度10 000 lx 下培养2 d 后,采用十字交叉法测量各菌株的病斑直径。每处理重复5 次,试验重复3 次。
三是完善乡村治理机制。实施乡村振兴,强化乡村治理,迫切需要一系列制度的跟进。要根据变化发展的乡村实际,加大涉农立法修法力度,让进一步修正完善的各项涉农法律法规规章更加符合农村实际、更加切合农业供给侧结构性改革需要、更能满足广大农民追求美好生活的期待。要在不断完善的涉农立法构架下建立健全乡村治理机制。进一步完善乡村治理的法治体系、责任体系和各项监管制度,让乡村治理步入社会化、法治化、智能化、专业化轨道。
1.2.3 对温度的敏感性 将各供试菌株 (直径5 mm) 接种于PDA 平板上,分别置于不同温度(5、10、15、20、25 和30 ℃) 及黑暗条件下培养72 h,记录各处理的菌落直径。每处理重复3 次。
1.2.4 对pH 值的敏感性 将各供试菌株 (直径5 mm) 分别接种于pH 值为4、5、6、7、8、9、10 和11 的PDA 平板上,置于24 ℃、黑暗条件下培养72 h,记录各处理的菌落直径。每处理重复3 次。
1.2.5 对葡萄糖的敏感性 将各供试菌株 (直径5 mm) 分别接至分别含0、10、20、40、80、160、240 和320 g/L 葡萄糖的PA 培养基上,置于24 ℃、黑暗条件下培养72 h,记录各处理的菌落直径。每处理重复3 次。
1.2.6 靶标基因的克隆与测序 将敏感菌株和抗性菌株分别接种至铺有玻璃纸的PDA 平板上,黑暗条件下培养3 d 后,刮下菌丝,利用康为世纪DNA 提取试剂盒提取基因组。
以抗/感灰葡萄孢菌株的DNA 为模板,利用4 对引物 (表1) 扩增琥珀酸脱氢酶SdhA、SdhB、SdhC和SdhD4 个基因的DNA 序列。采用50 μL PCR 反应体系:25 μL 2 × Es Taq Master Mix、2 μL DNA 模板(100 μg/mL),上、下游引物各1 μL (10 μmol/L),ddH2O 补足至50 μL。PCR 扩增条件:94 ℃预变性2 min;94 ℃变性30 s,52~57 ℃退火30 s,72 ℃延伸30 s,35 个循环,72 ℃延伸5 min。PCR 产物经琼脂糖凝胶电泳检测,胶回收纯化后克隆至 pEASY-T3 载体,送北京华大基因测序。

表1 PCR 扩增所用引物Table 1 Primers used for PCR reactions
2 结果与分析
2.1 灰葡萄孢对氟唑菌酰羟胺不同敏感型菌株抗性遗传稳定性
将灰葡萄孢对氟唑菌酰羟胺不同敏感型菌株在无药培养基上培养10 代,除中抗菌株WP3 外,其他6 个抗性菌株对氟唑菌酰羟胺的抗性倍数均有不同程度的降低,其中室内药剂驯化获得的高抗菌株BLH5F 的敏感性变异指数仅为0.23,说明该高抗菌株对氟唑菌酰羟胺的抗性稳定性较差;而从田间检测获得的低抗菌株 (WP8 和WP9)、中抗菌株 (WP6) 和高抗菌株 (WPE8 和WPE9) 的敏感性变异指数在0.60~0.97 之间 (表2),表明这些田间获得的抗性菌株对氟唑菌酰羟胺的抗性相对稳定。
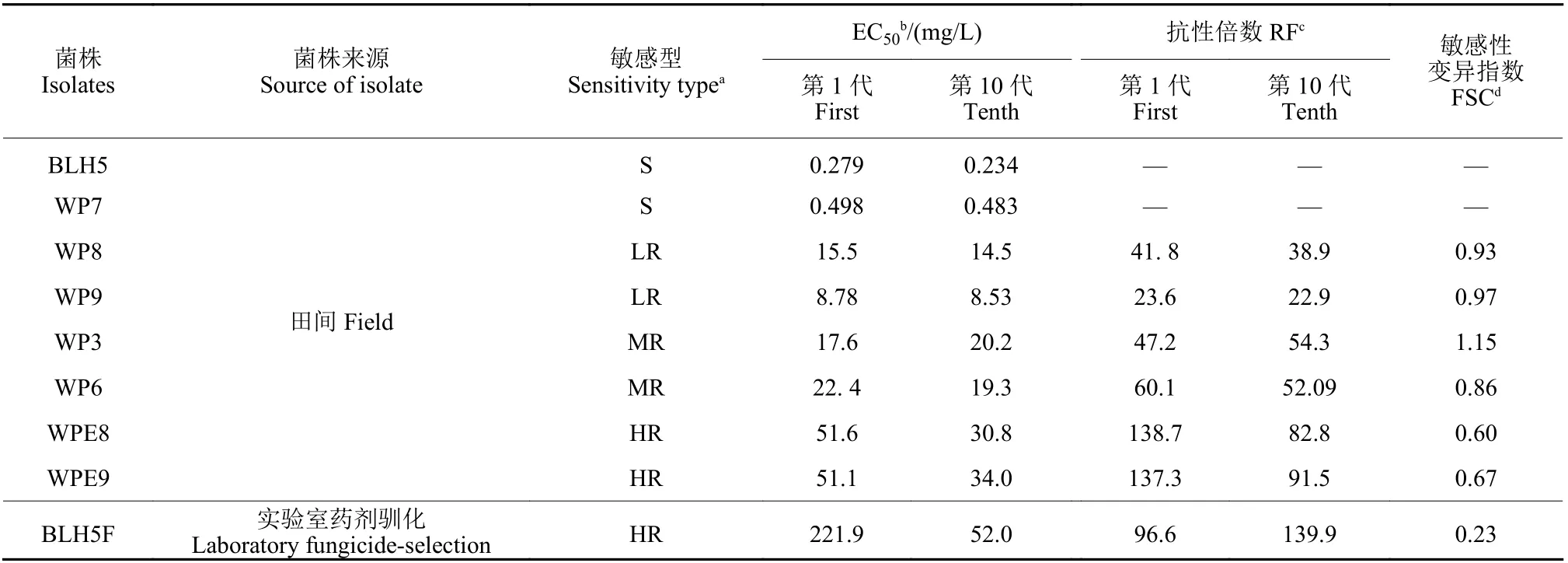
表2 灰葡萄孢对氟唑菌酰羟胺不同敏感型菌株抗性遗传稳定性Table 2 Genetic stability of the resistance of Botrytis cinerea isolates with different sensitivity types to pydiflumetofen
2.2 灰葡萄孢对氟唑菌酰羟胺不同敏感型菌株的菌丝生长速率、产孢量、孢子萌发率及致病性
结果 (表3) 显示,除低抗菌株WP8 的菌丝生长速率显著低于两敏感菌株及中抗菌株WP6 和高抗菌株WPE9 的产孢量显著低于两敏感菌株外,其他各抗性菌株在菌丝生长速率、产孢量、孢子萌发率和致病性方面与敏感菌株并无显著性差异。

表3 灰葡萄孢对氟唑菌酰羟胺不同敏感型菌株菌丝生长速率、产孢量、孢子萌发率及致病性Table 3 Mycelial growth, conidial production, conidium germination rate, and pathogenicity of B. cinerea isolates with different sensitivities to pydiflumentofen
2.3 对温度的敏感性

图1 温度对氟唑菌酰羟胺不同敏感型灰葡萄孢菌株菌丝生长的影响Fig. 1 The effect of temperature on mycelial growth of B. cinerea isolates with different sensitivity types to pydiflumentofen
2.4 对pH 值的敏感性
由图2 可以看出:各抗性菌株和敏感菌株在pH 4~11 的PDA 培养基上均能生长。当pH 值为5~6 时,各菌株生长速率最快,当pH 值大于7 时,随着pH 值的升高,各菌株的生长速率逐渐降低。在相同的pH 值下,抗性菌株与敏感菌株的菌落直径存在显著差异。pH 值为5 时,高抗菌株BLH5F的菌落直径显著大于两敏感菌株,而低抗菌株WP9和中抗菌株 (WP3 和WP6) 的菌落直径显著小于两敏感菌株;pH 值为11 时,高抗菌株WPE8 和BLH5F 的菌落直径显著大于两敏感菌株,而低抗菌株WP8 和WP9 的菌落直径显著小于两敏感菌株。

图2 pH 值对氟唑菌酰羟胺不同敏感型灰葡萄孢菌株菌丝生长的影响Fig. 2 The effect of pH values on mycelial growth of B. cinerea isolates with different sensitivity types to pydiflumentofen
2.5 对葡萄糖的敏感性
结果 (图3) 显示:随着葡萄糖质量浓度的升高,各抗性菌株和敏感菌株的菌丝生长速率逐渐加快,当质量浓度为40 g/L 时,各菌株的生长速率达到最大,而当质量浓度超过80 g/L 后,各菌株的生长速率随葡萄糖质量浓度的升高而降低。在葡萄糖质量浓度相同时,抗性菌株与敏感菌株的菌落直径存在显著差异。当质量浓度为40 g/L时,低抗菌株WP9 和中抗菌株 (WP3 和WP6) 的菌落直径与两敏感菌株无显著差异,而高抗菌株BLH5F 和WPE9 的菌落直径显著小于两敏感菌株;当浓度为320 g/L 时,高抗菌株WPE8 的菌落直径显著大于敏感菌株BLH5,而显著小于敏感菌株WP7。
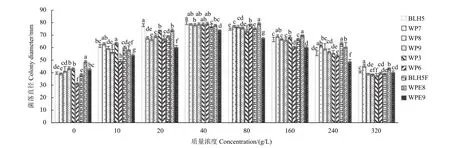
图3 葡萄糖质量浓度对氟唑菌酰羟胺不同敏感型灰葡萄孢菌株菌丝生长的影响Fig. 3 The effect of different concentrations of glucose on mycelial growth of B. cinerea isolates with different sensitivity types to pydiflumentofen
2.6 靶标基因序列的比对分析
分别对氟唑菌酰羟胺不同敏感型灰葡萄孢菌株的靶标基因 (SdhA、SdhB、SdhC和SdhD) 进行克隆与测序分析,结果显示 (图4 和表4),对氟唑菌酰羟胺不同抗性水平的菌株仅在SdhB基因上发生了点突变,而在SdhA、SdhC和SdhD等3 个基因上未检测到点突变。在SdhB基因上,只有室内药剂驯化获得的高抗菌株BLH5F 编码272 位氨基酸的碱基发生了点突变 (由CAC 变为CGC),氨基酸由组氨酸 (His) 变为了精氨酸 (Arg) (H272R);而其他田间获得的低抗、中抗和高抗6 个抗性菌株均在编码225 位氨基酸的碱基发生了点突变(由CCC 变为CTC),氨基酸由脯氨酸(Pro)变为了亮氨酸 (Leu) (P225L)。

图4 SdhB 基因氨基酸序列的多重对比Fig. 4 Multiple alignments of deduced amino acid sequences of SdhB genes

表4 灰葡萄孢对氟唑菌酰羟胺不同敏感型菌株中SdhA, SdhB, SdhC 和SdhD 基因点突变类型Table 4 Point mutation types of SdhA, SdhB, SdhC, and SdhD genes detected in B. cinerea isolates with different sensitivity types to pydiflumentofen
3 结论与讨论
氟唑菌酰羟胺是由先正达公司开发的新型琥珀酸脱氢酶抑制剂类杀菌剂,对灰霉病具有良好的防治效果。虽然氟唑菌酰羟胺尚未广泛用于灰霉病的防治,但在田间已经检测到了该药剂的抗性菌株[18]。研究灰葡萄孢对氟唑菌酰羟胺不同敏感型菌株的生物学特性,对推断田间抗性菌株的形成及发展,制定有效的抗药性治理策略具有重要意义。
琥珀酸脱氢酶抑制剂类杀菌剂包括啶酰菌胺、吡噻菌胺、吡唑萘菌胺、氟唑菌酰胺和氟吡菌酰胺等品种,是目前防治灰霉病的主要药剂。研究表明,灰霉病菌对该类药剂的抗性主要是由琥珀酸脱氢酶基因发生点突变引起的[19-23]。在SdhB基因上共检测到7 种突变类型:分别为225位脯氨酸突变为苯丙氨酸、苏氨酸、亮氨酸(P225F/T/L)、230 位天冬氨酸突变为异亮氨酸(N230I)、272 位组氨酸突变为酪氨酸、精氨酸、亮氨酸 (H272Y/R/L);在SdhD基因上检测到132 位组氨酸突变为精氨酸 (H132R);在SdhC基因上检测到了G85A、I93V、M158V 和V168I 共4 种突变,但这些点突变与灰霉病菌对啶酰菌胺的抗性无关[24]。本研究在氟唑菌酰羟胺抗性菌株SdhA、SdhC和SdhD3 个基因上均未检测到点突变,仅在SdhB基因上检测到了H272R 和P225L两种突变。有学者在抗氟唑菌酰羟胺的灰葡萄孢菌株的SdhB基因上检测到了P225F、N230I 和H272Y/R 4 种突变类型,其中产生P225F 和H272Y突变类型的菌株对氟唑菌酰羟胺具有低到中等水平抗性,而产生H272R 和N230I 突变类型的菌株对氟唑菌酰羟胺具有低水平抗性[18],本研究中,具有H272R 突变的灰葡萄孢菌株对氟唑菌酰羟胺具有高水平抗性,产生P225L 突变类型的菌株对氟唑菌酰羟胺也表现出不同的抗性水平。因此,推测灰葡萄孢对氟唑菌酰羟胺的抗性机制除靶标基因产生点突变以外还存在其他抗性机制。
有研究表明,灰葡萄孢对琥珀酸脱氢酶抑制剂类杀菌剂啶酰菌胺[12]和氟吡菌酰胺[17]的抗性可以稳定遗传,西瓜蔓枯病菌对氟唑菌酰羟胺的抗性也可稳定遗传[25]。本研究发现,从田间获得的6 个氟唑菌酰羟胺抗性菌株经无药培养10 代后,对氟唑菌酰羟胺的抗性相对稳定,而从室内驯化获得的抗性突变体对氟唑菌酰羟胺的抗性稳定性较差。然而,灰葡萄孢具有遗传变异大的特点,抗性菌株在经过数十代甚至上百代以后,能否变为敏感菌株还有待于进一步研究。
本研究从菌丝生长速率、产孢量、孢子萌发率、致病性、温度敏感性和pH 值敏感性等方面综合分析了灰葡萄孢对氟唑菌酰羟胺不同敏感型菌株的生物学特性。结果显示,大部分的抗药性菌株在菌丝生长速率和产孢量方面与敏感菌株无显著差异;7 个供试抗性菌株在分生孢子萌发和致病性方面与敏感菌株均无显著差异;在对温度、pH 值和葡萄糖浓度的敏感性方面,9 个灰葡萄孢对氟唑菌酰羟胺不同敏感型菌株之间存在差异,但在特定的温度、pH 值或葡萄糖浓度下,有时部分抗性菌株的菌落直径显著大于敏感菌株,有时显著小于敏感性菌株,说明抗氟唑菌酰羟胺的灰葡萄孢菌株在不同环境条件下的生存能力和抗逆性与敏感菌株相当。本研究结果表明,抗氟唑菌酰羟胺的灰葡萄孢菌株与敏感菌株具有相似的适合度。因此,在药剂的选择压下,田间较容易形成抗氟唑菌酰羟胺的灰葡萄孢优势种群。然而,本研究仅通过室内试验测定了抗氟唑菌酰羟胺的灰葡萄孢菌株的适合度及对温度、pH 值和葡萄糖的敏感性,尚需对灰葡萄孢进行长期田间抗性检测,以掌握抗性菌株的发展动态。
有研究发现,氟唑菌酰羟胺与琥珀酸脱氢酶抑制剂类杀菌剂啶酰菌胺和氟吡菌酰胺之间存在交互抗性[11,18-19]。早在2016 年,本研究团队已在河北省设施番茄主产区检测到了灰葡萄孢对啶酰菌胺的抗性菌株,抗性频率最高可达50.8%[1],也有报道称在山东省和河南省也检测到抗啶酰菌胺的灰葡萄孢菌株[24,26]。综合以上结果可以推测,灰葡萄孢对氟唑菌酰羟胺具有中到高水平的抗性风险。为延缓灰葡萄孢对氟唑菌酰羟胺抗性的产生和发展,该药剂在施用过程中,应严格控制每个生长季节的使用次数,建议与啶菌噁唑、咯菌腈等不同作用机制的杀菌剂交替或复配施用,避免与啶酰菌胺、氟吡菌酰胺等相同作用机制的杀菌剂桶混或连续施用。

