盐生植物根际细菌B268 的鉴定及其抑菌抗盐活性
李楚翘, 王天宇, 尹 颖, 陈安良, 张心齐*,, 陈旭华
(1. 浙江农林大学 浙江省绿色农药 2011 协同创新中心,杭州 311300;2. 浙江省乐清市自然资源和规划局森林病虫防治中心,浙江 乐清 325600)
土壤盐害是威胁全球农林业生产的最主要的非传染性病害之一[1-2]。目前,全球已有约20%(6.2×107hm2) 的耕地受到盐害影响,并以每年1%~2%的速度递增[3-4]。可溶性盐的积累可改变土壤的物理结构、生化性质和营养组成,在短时间内即对植物形成渗透胁迫、离子胁迫和氧化胁迫,同时抑制根际有益微生物的多样性和活性,造成植物生产能力下降或生态功能丧失[2-7]。相比于物理浸提、化学中和以及抗性选育等方法,耐盐生防菌被认为是提升盐土地力,协助植物抵御病害和盐害多重胁迫,促进植物生长最经济有效的工具[3-7]。其中,盐生植物的根际细菌,兼具耐盐和生防活性,近年来逐渐受到关注[7-8]。据报道,在盐胁迫条件下,耐盐植物根际土壤中的微生物量会随着种植时间的延长而增加,并显著高于非根际土壤,而有益微生物在根际和根内的富集和定殖是盐生植物适应盐胁迫的主要机制之一,因此,盐生植物的根被认为是分离耐盐生防菌的天然菌种库[7,9]。然而,盐生植物虽然占到全球植物多样性的1%,但进行根际细菌资源挖掘的盐生植物种类较少,主要集中在藜科、禾本科、蝶形花亚科等盐地优势类群[7]。而木麻黄Casuarinaspp.是一种在热带和亚热带沿海地区被广泛栽种的防护林、用材林以及土壤修复树种,其根部与弗兰克氏菌Frankiaspp.、丛枝菌根真菌的共生关系,以及与自由生活的根际细菌的互作关系被认为是其耐盐速生特性的重要基础,但目前对后者的研究报道还很少[10]。基于上述背景,本文从海岸带短枝木麻黄Casuarina equisetifoliaL.植株根部分离获得了1 株新的生防细菌B268,在多相分类鉴定的基础上,对其嗜盐和生防活性的相关性,及其提高作物耐盐性等特性进行评估,旨在拓展耐盐生防菌的种质资源和使用范围,为研发适用于盐土环境的新型菌剂奠定基础。
1 材料与方法
1.1 材料
1.1.1 供试菌株及黄瓜种子 菌株B268 分离自浙江省乐清市木麻黄海防林的根际土壤样品 (Na+含量为每克干土7.119 mg),保藏号CGMCC No.13225。青枯病菌Ralstonia pseudosolanacearumYQ 分离自相同木麻黄林的染病植株木质部,由实验室自行保藏。苹果树腐烂病菌Valsa malivar.mali、番茄早疫病菌Alternaria solani、胶孢炭疽菌Colletotrichum gloeosporioides、交替链格孢Alternaria alternata、尖孢镰刀菌Fusarium oxysporum、灰葡萄孢Botrytis cinerea、禾谷镰刀菌Fusarium graminearum、茶藨子葡萄座腔菌Botryosphaeria dothidea均为实验室保藏菌种。
供试黄瓜Cucumis sativusL.为驰誉®518号,购自天津科润黄瓜研究所。
1.1.2 培养基及培养液
鉴定培养基:Marine 2216 改良培养基[11],用于底物水解、甲基红试验、 Voges-Prauskauer(VP) 试验、产硫化氢分析和抗生素敏感性试验。
YTGB 培养基 (W/V):酵母粉 (yeast extract,BD) 0.05%、胰蛋白胨 (trypticase peptone, BD)0.5%、葡萄糖1%、牛肉粉0.3%,pH 7.0,用于RNA 抽提的细胞培养、适盐性分析、病原细菌拮抗活性分析、吲哚和吲哚乙酸 (indole-3-acetic acid,IAA) 合成分析。
改良PDA 培养基 (W/V):马铃薯20%,葡萄糖1%,胰蛋白胨 (trypticase peptone, BD) 0.5%,酵母粉 (yeast extract, BD) 0.1%,pH 7.0,用于病原真菌拮抗活性分析。
嗜铁素检测培养基:LNM 缺铁培养基[12]。
溶磷培养基 (W/V):蒙金娜有机磷 (0.1%植酸钙) 培养基[13];NBRIP 无机磷 (0.1%磷酸钙) 培养基[14]。
黄瓜苗水培液:0.5 × Hoagland 营养液。
1.2 菌株鉴定
1.2.1 形态及生长特征分析 细胞和菌落形态观察,底物水解、甲基红试验、VP 试验、产硫化氢、过氧化氢酶、抗生素敏感性分析参照文献方法[11],运动性观察参照文献方法[15],其余生理生化特征分析采用API ZYM、API 20NE、API 32GN (bioMérieux) 试剂盒。以0~20% NaCl (间隔1%,W/V) 梯度下的培养液OD600值分析最适和极限生长盐浓度。所有培养物均于28 ℃、140 r/min或28 ℃静置培养。
1.2.2 系统发育树分析 利用Genome BLAST Distance Phylogeny (GBDP) 方法,基于Type (strain) Genome Server 基因组数据库 (http://tygs.dsmz.de/) 构建基因组系统发育树[16],B268 基因组序列登录号为CP053764。
1.2.3 比较基因组分析 以OrthoANIu algorithm法 (https://www.ezbiocloud.net/) 进行平均核苷酸相似性 (average nucleotide identity, ANI) 分析[17];以genome-based distance matrix calculator (http://enveomics.ce.gatech.edu/g) 进行平均氨基酸相似性(average amino acid identity, AAI) 分析[18];以genometo-genome distance calculator (GGDC) 2.1 (http://ggdc.dsmz.de/ggdc.php) 进行模拟DNA 杂交率 (in silicoDNA-DNA hybridization,isDDH) 分析[19];以JSpeciesWS (http://jspecies.ribohost.com/jspeciesws/) 进行四核苷酸特征相关性指数 (tetranucleotide signature correlation index, TETRA) 分析[20]。
1.3 生防活性分析
1.3.1 抑菌活性 细菌抑制活性采用活菌计数法。菌株B268、YQ 分别于28 ℃、140 r/min 下活化培养48 h。B268 菌液制备成无细胞上清液[21],并补加等体积的YTGB 空白培养基混合,再按8.5% (V/V) 接种青枯病原菌YQ 菌液或YTGB 空白培养基 (对照),继续于28 ℃、140 r/min 下培养4、8 及12 h,分别取样涂布平板以及透镜电镜(Hitachi H-7 650) 观察。
真菌抑制活性参照文献方法[22],同时以扫描电镜 (Hitachi SU-8 010) 观察菌丝形态。
1.3.2 适盐促生活性分析 分别在0~7% NaCl (间隔1%,W/V) 梯度下对B268 培养液的 IAA 浓度[21]、嗜铁素相对含量[12]以及平板溶磷指数 (phosphate solubilizing index, PSI)[23]进行分析。
1.4 功能基因分析
采用RAST Server v2.0 (https://rast.nmpdr.org/)进行功能基因预测[24];采用antiSMASH v6.0.1 (https://antismash.secondarymetabolites.org/#!/start) 进行次级代谢产物合成基因 (簇) 预测[25]。对预测的IAA 合成关键基因dhaS、嗜铁素合成关键基因dhbC及植酸酶基因phyC设计引物 (表1),进行NaCl 浓度梯度下的差异表达分析。采用RNAiso Plus (TaKaRa) 抽提RNA,PrimeScriptTMRT reagent kit with gDNA eraser (TaKaRa) 制备cDNA, TB Green®Premix Ex Taq™ (TaKaRa) 进行反转录荧光定量PCR (RT-qPCR),具体操作参照各试剂盒说明书。程序:95 ℃,5 min;95 ℃,5 s;55 ℃,30 s;72 ℃,30 s;40 个循环。以16S rRNA 基因为内参,以0% NaCl 梯度为对照,采用2-ΔΔCt法进行数据分析[26]。

表1 生防功能基因扩增引物Table 1 Amplification primers of biocontrol-related functional genes
1.5 促植物耐盐性分析
泥炭土 (德国维特) 经121 ℃ × 20 min 灭菌两次后加入育苗盘中,黄瓜种子经体积分数为70% 乙醇4 min,0.1% 氯化汞30 s,70% 乙醇1 min 消毒后播种,待长出第5 片真叶时转水培:共12 个水培箱,每个水培箱加8 L 营养液,12 株苗,24 h 曝气,4 d 更换营养液1 次,于28 ℃、相对湿度50%~60%、光照14 h (6:00 至20:00)条件下培养。缓苗后,将12 个水培箱随机分成4 组,分别进行以下处理:①新鲜的B268 培养液离心收集细胞,无菌水漂洗后以0.75 × Hoagland 营养液重悬 (OD600=1),按每个水培箱1 L 菌悬液、7 L营养液的比例接种;②以含640 mmol/L NaCl 的0.75 × Hoagland营养液替代①中的菌悬液接种,NaCl 终浓度为80 mmol/L;③以含640 mmol/L NaCl 的0.75 × Hoagland 营养液制备菌悬液后接种;④对照 (不处理),以空白的0.75 × Hoagland营养液接种。于处理后的第4 天更换营养液前,每个水培箱随机选取6 株苗,采集从上往下第2 片真叶,于 -80 ℃保存,备用。更换营养液的同时重新接种B268 和盐胁迫 (终浓度120 mmol/L),并于二次处理后的第4 天相同时间点,采集剩下苗株的真叶保存备用,取样方法同上。最后对所有样本进行丙二醛和可溶性糖含量的分析[27]。
1.6 数据统计分析
所有数据均采用SPSS Statistics 26.0 进行方差分析及差异显著性检验 (P<0.05)。
2 结果与分析
2.1 分类鉴定
2.1.1 形态及生长特征 菌株B268 的细胞为革兰氏阳性,杆状,1.8~2.0 μm × 0.6 μm,形成近端生、不膨大的柱状芽孢 (图1-A),同时具有单端丛生鞭毛 (图1-B),进行群聚运动 (swarming)。B268在YTGB 平板上形成平整延展状生物膜,在Marine 2216 改良平板上形成褶皱收敛状生物膜。在含0~15%NaCl (W/V) 的YTGB 液体培养基中均能生长,最适生长NaCl 为3%。

图1 菌株B268 的细胞形态Fig. 1 Cell morphology of strain B268
2.1.2 生理生化特征 菌株B268 能够利用D-葡萄糖、D-核糖、L-阿拉伯糖、D-甘露糖、D-麦芽糖、D-甘露醇、N-乙酰葡萄糖胺、糖原、乙酸盐、丙二酸盐、3-羟基丁酸盐、戊酸盐、葡萄糖酸盐、2-酮基葡萄糖酸盐、5-酮基葡萄糖酸盐、柠檬酸盐、苹果酸盐、DL-乳酸盐、3-羟基苯甲酸盐、4-羟基苯甲酸盐、L-丙氨酸、组氨酸、L-脯氨酸作为单一碳源和能源。水解七叶苷、酪蛋白、脱脂牛奶、羧甲基纤维素钠、淀粉、木聚糖、明胶和吐温20、40、60,不水解几丁质、果胶、葡聚糖和吐温80。硝酸盐还原、VP 试验、产吲哚和硫化氢阳性,甲基红试验阴性。过氧化氢酶、氧化酶、脲酶、碱性磷酸酶、酸性磷酸酶、萘酚双磷酸水解酶、C4 酯酶、C8 酯酶阳性。对复方新诺明、青霉素G、羧苄青霉素、氨苄青霉素、万古霉素、卡那霉素、庆大霉素、米诺环素、头孢噻吩、氯霉素、红霉素、新生霉素、新霉素、诺氟沙星和氧氟沙星敏感,对链霉素、四环素、多粘菌素、阿莫西林、林可霉素不敏感。未列举的API ZYM、API 20NE、API 32GN 试剂盒分析结果均为阴性。
2.1.3 系统发育地位及基因型特征 基于基因组序列的系统发育分析结果表明 (图2):菌株B268 属于枯草芽孢杆菌复合种 (Bacillus subtiliscomplex species) 内的解淀粉芽孢杆菌世系(Bacillus amyloliquefaciensclade),在同种贝莱斯芽孢杆菌群 (conspecificB. velezensisgroup) 中形成一个分支最早、相对独立的单系支 (monophyletic branch)。

图2 枯草芽孢杆菌复合种的基因组系统发育树Fig. 2 Phylogenomic tree of Bacilus subtilis species complex
比较基因组分析结果表明 (表2):B268 与同种贝莱斯芽孢杆菌群内所有标株间的ANI (97.7%~97.83%)、isDDH (80.3%~81.4%)、AAI (98.19%~98.21%) 和TETRA (0.999 2~0.999 63) 值均高于菌群外标株,进一步证明B268 与该菌群为同种关系。其次,B268 与菌群内标株间的ANI 值 (97.7%~97.83%) 低于原核微生物亚种的划分阈值 (ANI>98%),而isDDH 值 (80.3%~81.4%) 高于亚种划分阈值 (isDDH>79%~80%),表明B268 为同种贝莱斯芽孢杆菌群内的一个新种系型,基于目前分类标准,还不能确定是否为一个新亚种。
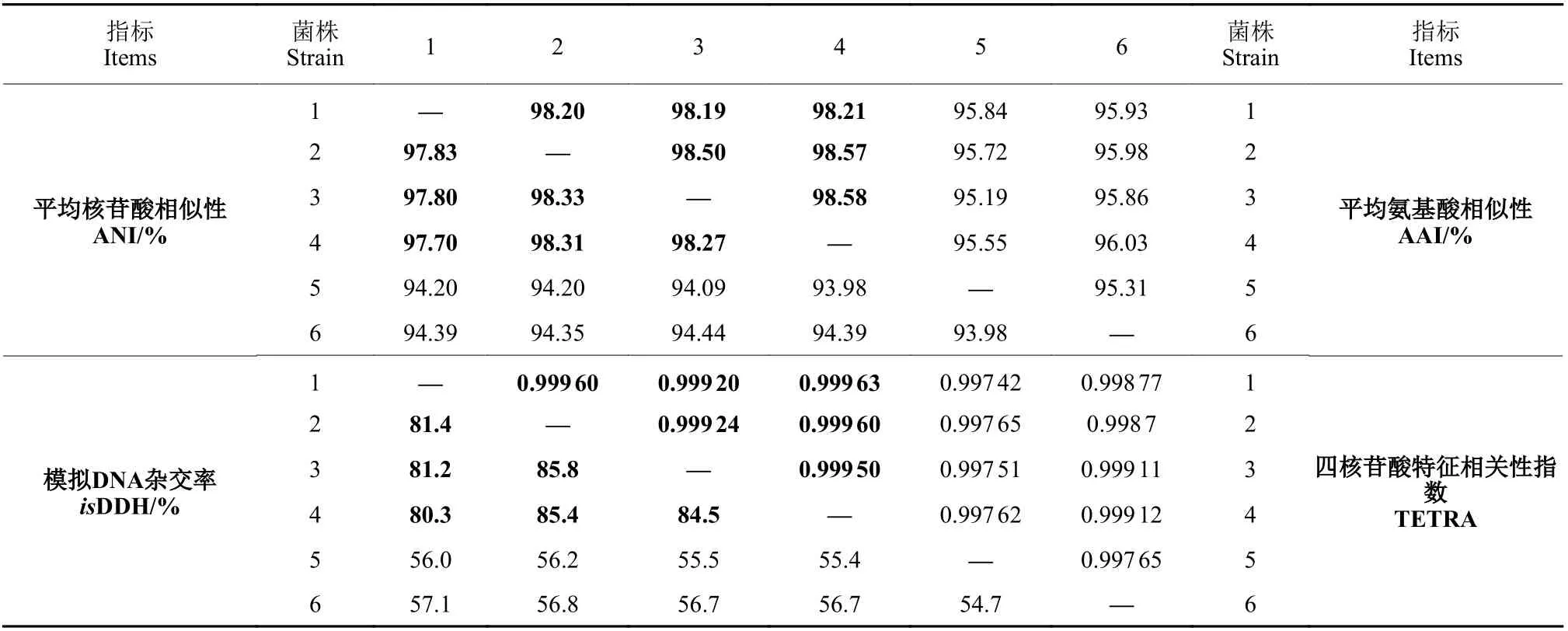
表2 解淀粉芽孢杆菌世系内的比较基因组分析Table 2 Comparative genome analysis within Bacillus amyloliquefaciens clade
综合上述多相分类结果以及芽孢杆菌分类现状,将菌株B268 鉴定为同种贝莱斯芽孢杆菌群成员,与FZB42T等经典生防菌株为同种关系。
2.2 生防活性
2.2.1 病原细菌拮抗活性 在含有B268 无细胞上清液的体系中,培养4 h 时,青枯病原菌YQ 开始出现细胞变形死亡现象 (图3-B,箭头),但此时的细胞繁殖速度仍高于死亡速度,因此总的活细胞数缓慢增加 (图4);培养至8 h 时,活细胞数达到最高,之后细胞死亡速度开始高于生长速度;至12 h 时,绝大多数细胞出现变形 (图3-C,箭头),表明B268 具有较强的拮抗活性。

图3 B268 无细胞上清液中R. pseudosolanacearum YQ 的细胞形态Fig. 3 Cell morphology of R. pseudosolanacearum YQ in the cell-free supernatant of B268

图4 B268 无细胞上清液中R. pseudosolanacearum YQ 的活细胞数变化Fig. 4 Change of living cell numbers of R. pseudosolanacearum YQ in the cell-free supernatant of B268
2.2.2 病原真菌拮抗活性 平板对峙结果表明(表3):菌株B268 对8 种常见植物病原真菌均有拮抗活性,对其中6 种的抑制率高于50%。同时,扫描电镜结果显示,在B268 拮抗作用下,菌丝普遍呈现干瘪、皱缩或粘连状 (图5-A),而胶孢炭疽菌产生了大量的孢子 (图5-C,箭头)。

表3 B268 对病原真菌的拮抗活性Table 3 Antagonistic activities of B268 against pathogenic fungi (n=7)

图5 B268 抑制作用下病原真菌的菌丝形态Fig. 5 Hypha morphology of pathogenic fungi antagonized by strain B268
2.2.3 适盐促生活性 菌株B268 在0~6% NaCl梯度下均能合成IAA,最适梯度在3%~4%,培养5 d时胞外IAA 浓度达到最高 (图6)。其中,6% NaCl下的IAA 合成出现延滞,培养3 d 时仍接近于零,但随着培养时间的延长,5 d 时4%~6% NaCl 下的IAA 浓度均明显提高,且增幅大于0~2%梯度。

图6 B268 吲哚乙酸合成活性的盐相关性Fig. 6 The correlation of indole acetic acid production with salinity in strain B268
图7 显示B268 的嗜铁素合成有明显的盐相关性,不同培养时间下均在1%NaCl时相对含量最高,其次为0%NaCl,而2%~6%梯度时相对含量在较低水平上波动。

图7 B268 嗜铁素合成活性的盐相关性Fig. 7 The correlation of siderophore production with salinity in strain B268
平板溶磷结果 (图8) 表明:B268 兼有溶解有机磷和无机磷的活性,3%~4%NaCl 时溶磷指数相对较高,在0~7%NaCl 梯度下总体保持稳定。

图8 B268 溶磷活性的盐相关性Fig. 8 The correlation of phosphate solubilizing activity with salinity in strain B268
2.3 生防功能基因
基于RAST 分析结果,在B268 基因组 (CP 053764) 中发现了IPyA 型IAA 合成途径、儿茶酚型嗜铁素 (bacillibactin) 合成途径以及单个植酸酶(phytase) 基因。其中,前两个途径中的吲哚3-乙酰乙醛脱氢酶 (indol 3-acet-aldehyde dehydrogenase)基因dhaS、异分支酸合成酶 (isochorismate synthase) 基因dhbC以及植酸酶基因phyC在NaCl 梯度培养条件下的转录活性同相应的表观活性类似,也呈现出盐相关性,分别在1%或3%NaCl下转录水平最高 (图9)。

图9 B268 生防功能基因转录活性的盐相关性Fig. 9 The correlation of transcriptional activity of biocontrol-related genes with salinity in strain B268
基于antiSMASH 分析结果,在B268 基因组中发现了13 个抗菌物质合成基因簇 (表4),其中7 个为同种贝莱斯芽孢杆菌群标株的共有基因簇,而rhizocticin 和plantazolicin 分别仅在B268 和B.amyloliquefacienssubsp.plantarumFZB42T预测到,mersacidin 仅在B268 和B. velezensisNRRL B-41580T预测到。结合表观抗菌活性分析结果,进一步表明B268 具有广谱抗菌的潜力,以及不同的抑菌谱。

表4 同种贝莱斯芽孢杆菌群内的次级代谢基因簇比较Table 4 Comparison of the secondary metabolic gene clusters within conspecific B. velezensis group
2.4 促植物耐盐活性
以叶组织中的丙二醛 (MDA) 和可溶性糖含量变化为表征,对不同程度盐胁迫下,B268 促进黄瓜耐盐性的效果进行了评估。结果 (图10) 表明:在低盐 (80 mmol/L) 胁迫下,未接种B268 的苗株,可溶性糖含量比对照增长52.5%,且MDA含量没有明显增加,表明该盐度下,黄瓜能够自主地积累渗透保护物质来避免盐害;同时,接种B268 的苗株,可溶性糖含量比未接种苗株低23%,而MDA 含量同样没有明显增加,表明B268 能够降低黄瓜对低盐胁迫的敏感性。在高盐 (120 mmol/L)胁迫下,未接种B268 的苗株,可溶性糖含量比对照增长123.6%,但MDA 含量也比对照提高76.7%,表明该盐度下,黄瓜的自主渗透保护已无法有效抵抗盐害;而接种B268 的苗株,可溶性糖含量仅比未接种的苗株高46.4%,而MDA 含量则比未接种的苗株低67.2%,与对照相近 (仅比对照高5.7%),表明接种B268 能够调节渗透保护物质的积累,有效降低盐害所造成的细胞损伤,提高黄瓜的耐盐性。

图10 不同程度盐胁迫下B268 对黄瓜叶片中可溶性糖及丙二醛含量的影响Fig. 10 Influence of B268 on the soluble sugar content and MDA content in cucumber leaves under different salt stresses
3 讨论
Dunlap 等在2016 年建议将亲缘关系相近的原B. velezensis与B. amyloliquefacienssubsp.plantarum、B. methylotrophicus合并为新B.velezensis[28]。而Fan 等在2017 年提出同种概念,即由上述3 个 (亚) 种组成同种贝莱斯芽孢杆菌群[29]。根据基因组比较分析结果可以确定,B268属于同种贝莱斯芽孢杆菌群,同时,与群内各标株间的ANI 值低于原核微生物亚种的划分阈值[29],因此认为其为贝莱斯芽孢杆菌群的一个新种系型。
近10 年间,贝莱斯芽孢杆菌成为继枯草芽孢杆菌、解淀粉芽孢杆菌、地衣芽孢杆菌B.licheniformis之后,又一个被重点挖掘的具有多领域应用潜力的芽孢杆菌种,尤其在生物防治和促生增产方面潜力巨大[30]。与同类群的FZB42T等经典生防芽孢杆菌一样,B268 具有合成IAA、嗜铁素和溶磷等促生活性,以及广谱的抗菌能力。不同的是,B268 分离自盐生植物根际。目前,来自于盐生植物根际环境的贝莱斯芽孢杆菌报道较少,仅B. velezensisXT1 (分离自盐土灯心草根际)[31],B. velezensisMBY2 (分离自驼蹄瓣属根际)[32]等少量菌株,而不同的盐生植物具有不同的根际群落,形成特异的微生物-植物互作机制[8],因此,B268 也表现出一些新性状,如生防活性的盐响应性。B268 所在的采样点受海水倒灌影响而重度盐渍化,因而具有嗜盐生长的特征 (最适生长3% NaCl,生长范围0~15% NaCl)。相应地,B268 的IAA、嗜铁素合成和溶磷活性在基因转录水平以及生理水平上也都表现出适盐性 (最适NaCl> 0%)。众所周知,芽孢杆菌是目前抗逆性最强的生防菌种类,Upadhyay 等的研究表明,在盐胁迫下,仅有18%的小麦根际细菌仍能表现出生防活性,其中芽孢杆菌及其相近属占80%,但与B268 不同的是,这些产芽孢细菌的生防活性随着培养基盐度的升高而下降,即没有盐响应性[33]。由此可见,盐胁迫下不同芽孢杆菌的表现不同,而B268 融合了嗜盐性和生防活性。依据Etesami和Arora 等的观点,耐盐生防菌的压力响应特性不仅作用于自身抗逆,也可能有助于其对植物的抗逆保护,但具体机制目前仍知之甚少[4,7],而B268 在这方面具有一定的研究价值。
水培试验中,在黄瓜苗可耐受的盐胁迫程度下 (80 mmol/L NaCl),接种B268 可降低植株的盐反应,而在高盐胁迫 (120 mmol/L) 下,接种B268 可提高植株的盐保护水平,形成一定的盐耐受性,表明B268 能在短时间内 (4 d) 与植物形成有效的抗盐互作。此外,B268 还具有一定的次生代谢潜力。据报道,贝莱斯芽孢杆菌的次级代谢产物合成具有菌株特异性[34],而在B268 的基因组中发现了在同种贝莱斯芽孢杆菌群中出现频率较低(12%) 的mersacidin 基因簇[35],以及多个目前尚未解析的活性物质合成基因簇,包括萜烯类(terpene)、三型聚酮合酶类 (T3PKS) 等。因此,在盐害及病害防治方面,B268 也具有一定的挖掘潜力。
目前,我国盐渍土面积已达3.69×107hm2,且分布广阔、类型多样,因此,盐渍土的修复和资源化利用已成为我国农林业发展和生态环境保护的重要内容[36]。而耐盐生防菌在提高盐土肥力、促进植物健康方面具有不可替代的作用,是土壤盐渍化防治体系中的重要一环。B. velezensisB268对盐具有响应特性,可助力盐害的绿色治理。

