不同群体鸭生长曲线拟合及肌纤维特性分析
王晋,匡伟,何宗亮,高鹏,祝启钊,杨铭宣,杨海霞,虞徳兵
(南京农业大学动物科技学院,江苏 南京 210095)
生长曲线是研究动物生长性能最常用的数学模型,用来发掘生长规律及进行群体间比较,在遗传育种实践中发挥重要作用。Gompertz和Logistic模型是畜禽上应用较多的生长模型,在牛[1]、鸡[2]、鸭[3]等动物的研究中发挥了重要作用,并且在禽类生长分析上具有一定优势[4]。金陵白鸭是本课题组和南京市畜牧家禽科学研究所合作,通过快大型樱桃谷鸭和小型地方连城白鸭杂交、横交固定,历经6个世代的群体继代选育后形成的新品系,金陵白鸭为暂定名。7周龄群体均重2.0 kg,料重比3∶1,年产蛋260枚,肉质鲜美,并且同连城白鸭一样具有很高的药用价值[5-7]。肉用动物躯体的40%为骨骼肌,而肌纤维是骨骼肌的主要成分。相比腿肌,禽类胸肌结构简单,主要以快肌纤维为主,是研究品种间差异很好的对象[8]。此外,物种间的肌纤维数量具有显著的差异[9],且不同品种间肌纤维的密度和直径具有不同水平的差异[10]。因此,不同品种间肌纤维形成过程的研究具有重要价值。
生肌调节因子(myogenic regulatory factor,MRF)家族、肌增强因子2(myocyte enhancer factor 2,MEF2)家族等基因共同参与调控肌细胞的生成和发育[11-12],但肌纤维数量在胚胎期就已经确定,出生后肌纤维肥大主要靠卫星细胞的增殖与分化和肌蛋白的沉积[13]。生肌决定因子(myogenic factor 5,Myf5)、肌转录调节因子(myogenic differentiation 1,MyoD1)是主要生肌调节因子,肌生成素(myogenin,MyoG)是成肌细胞分化融合的关键基因,肌增强因子2C(myocyte enhancer factor 2C,MEF2C)与MyoG具有协同作用[14]。本研究为完善连城白鸭的配套系选育,运用 Logistic和Gompertz 模型拟合生长曲线,探求北京鸭、金陵白鸭及其正反交群体的生长规律;并对肌纤维特性和肌发育相关基因表达水平进行比较,分析肌发育相关基因分别与胸肌重和肌纤维特性的相关性,为地方鸭品种资源开发利用、品种选育等后续工作提供参考。
1 材料与方法
1.1 试验动物及试验设计
试验于2020年7月至11月在江苏省南京市畜牧家禽科学研究所淳化基地完成。试验分为4组,分别为北京鸭纯繁组(P,对照组)、金陵白鸭纯繁组(J)、北京鸭和金陵白鸭的正交组(PJ)和金陵白鸭和北京鸭的反交组(JP)。4组均未设重复试验。每组选取健康状况相近的1日龄公母混合雏鸭50只分别饲养。育雏期(0~2周)网床养殖,育成期(3~7周)地面平养,乳头饮水器饮水,桶料饲喂,自由采食。其他常规饲养管理如免疫等严格按鸭场饲养管理措施进行。
1.2 试验方法
1.2.1 生长性能测定生长性能测定根据《家禽生产性能名词术语和度量统计方法:NY/T 823—2020》进行。期间每2周在禁食6 h后,每组随机选择10只鸭称重并记录。7周龄按同样方法称重后选择6只体重在均重附近的公鸭屠宰,取胸肌称重并采样。在同一部位取胸肌组织样2份,1份修剪为2 cm×1 cm×1 cm 的组织块后放入4%多聚甲醛溶液中固定,用于制作石蜡切片;另外1份放入冻存管置液氮中速冻,后转入-80 ℃冰箱保存用于后续试验分析。
1.2.2 生长曲线拟合分析根据Logistic函数模型和Gompertz函数模型对4组生长数据进行拟合分析[15]。采用高斯-牛顿(Gauss-Newton)算法,逐次迭代计算各参数值直到收敛,收敛标准精度为0.001,同时计算残差平方和(E)和拟合度(R2)选做参考标准,求出最适拟合曲线模型。每组选择R2最大和E最小的函数模型进一步计算并使用相关性最高的曲线预测其拐点体重、拐点周龄和最大周增重。Logistic:Y=A/(1+Be-KT);Gompertz:Y=Ae-Be-KT。式中:T为周龄;Y为T周龄时体重;A为体重的极限参数;K为接近生长极限值时的生长速度;B为调节参数。
1.2.3 石蜡切片制作与HE染色将固定24 h的胸肌组织样流水冲洗3 h,按梯度使用乙醇溶液脱水 2次;再依次经过乙醇与二甲苯的等体积混合液、二甲苯2次;恒温箱中依次经过石蜡与二甲苯的等量混合液、石蜡后,用纸质包埋盒包埋;待石蜡完全凝结,修蜡块为梯形,切片,捞片。将切片依次浸入二甲苯Ⅰ20 min、二甲苯Ⅱ 20 min、无水乙醇Ⅰ5 min、无水乙醇Ⅱ 5 min、75%乙醇5 min、自来水洗;浸苏木素染液3~5 min,自来水洗,分化液分化,自来水洗,返蓝液返蓝,自来水冲洗;切片依次浸85%、95%乙醇5 min,伊红染液5 min;切片依次浸无水乙醇Ⅰ5 min、无水乙醇Ⅱ 5 min、无水乙醇Ⅲ 5 min、二甲苯Ⅰ5 min、二甲苯Ⅱ 5 min,中性树胶封片,显微镜镜检合格后用于后续试验分析。
1.2.4 RT-qPCR用Trizol试剂(Invitrogen公司)提取胸肌组织总RNA。经NanoDrop 2000分光光度计检测合格后,利用5×All-In-One RT MasterMix反转录试剂盒(Abm公司)冰上反转录(RT)成cDNA。RT反应体系及程序:800 ng总RNA、反转录酶4 μL,加无酶去离子水至20 μL;37 ℃ 15 min,85 ℃ 5 s。反转录产物稀释成400 ng·μL-1后,以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参基因,利用EvaGreen 2×qPCR Master Mix荧光定量试剂盒(Abm公司)对与肌肉发育和肌纤维类型相关基因(表1)mRNA表达水平进行qPCR。引物经Primer Premier 5.0在线设计,被NCBI primer-blast网站验证后由南京擎科生物公司合成。反应体系:上、下游引物各0.6 μL,cDNA模板2 μL,定量酶10 μl,加无酶去离子水至20 μL。反应条件:95 ℃ 5 min;95 ℃ 15 s,60 ℃ 30 s,72 ℃ 60 s,40个循环;72 ℃ 7 min。熔解曲线程序:95 ℃ 15 s;60 ℃ 1 min;95 ℃ 15 s。

表1 qPCR引物序列Table 1 Primer sequences for qPCR
1.3 数据的统计分析
2 结果与分析
2.1 不同群体鸭生长性能比较分析
由表2可知:P组鸭体重始终具有优势,杂交组介于父本纯繁和母本纯繁组之间,但是在4周龄时各组体重比较接近。另外,P组生长速度(即曲线斜率)始终高于其他组,斜率由大到小依次是P、PJ、JP、J,这说明北京鸭生长速度最快,最慢是金陵白鸭。第2周龄时,PJ组体重略大于JP组外,JP组体重整体略重于PJ组(P>0.05)。在不同时间点,P与J组体重具有极显著差异(P<0.01)。由表3可知:7周龄4组公鸭活体重和胸肌重互相之间差异极显著(P<0.01),而胸肌率PJ与P相近,并与其他组有极显著差异(P<0.01)。亲代胸肌率平均值明显低于F1代,体现出较强的杂种优势。
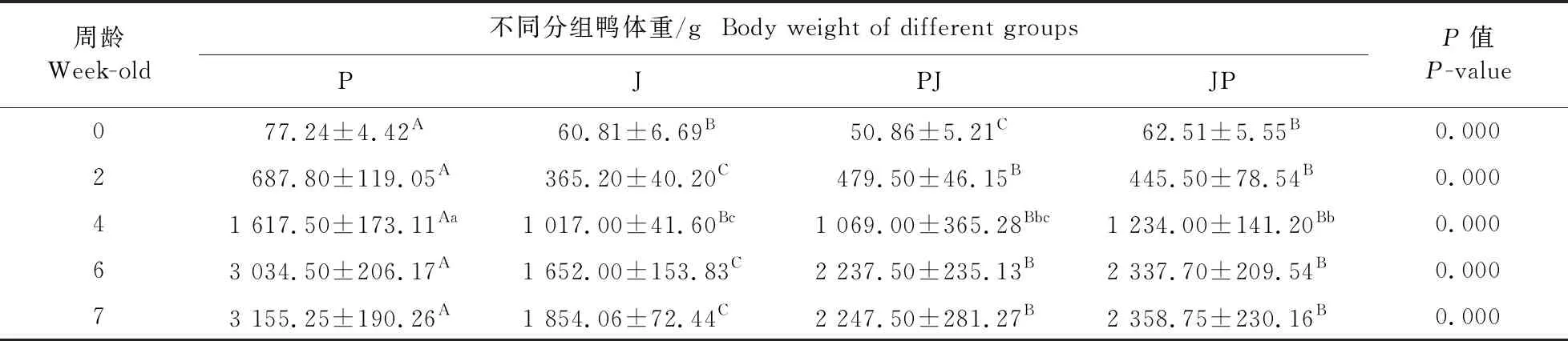
表2 不同群体鸭不同时间点体重比较Table 2 Comparison of body weight of different groups of ducks at different time

表3 不同群体公鸭7周龄胸肌重和胸肌率比较Table 3 Comparison of breast muscle weight and breast muscle rate of different groups of male ducks at 7 week age
2.2 不同群体鸭生长曲线拟合分析
Logistic和 Gompertz函数模型的拟合结果如表4和图1所示。其中P、PJ和JP组选择Logistic函数模型,R2分别为0.994、0.986、0.994,E为每组最小值。J组选择Gompertz函数模型,R2=1,E=751.49,其对应模型曲线公式如表5所示。其中拐点周龄均预测为4周龄(26~30 日龄)左右,拐点体重由大到小依次为P、JP、PJ和J组,符合实际观测值。最大周增重反映了拐点时期各组鸭的生长速度,各组之间大小顺序同拐点体重。图1将各组鸭体重实际观测值和拟合值可视化,直观展示拟合度的高低。以上均说明4周龄是鸭生长重要时期,需要相对严格的饲养管理。

图1 不同群体鸭实际与累积生长曲线比较Fig.1 Comparison of actual and cumulative growth curves of different duck groups
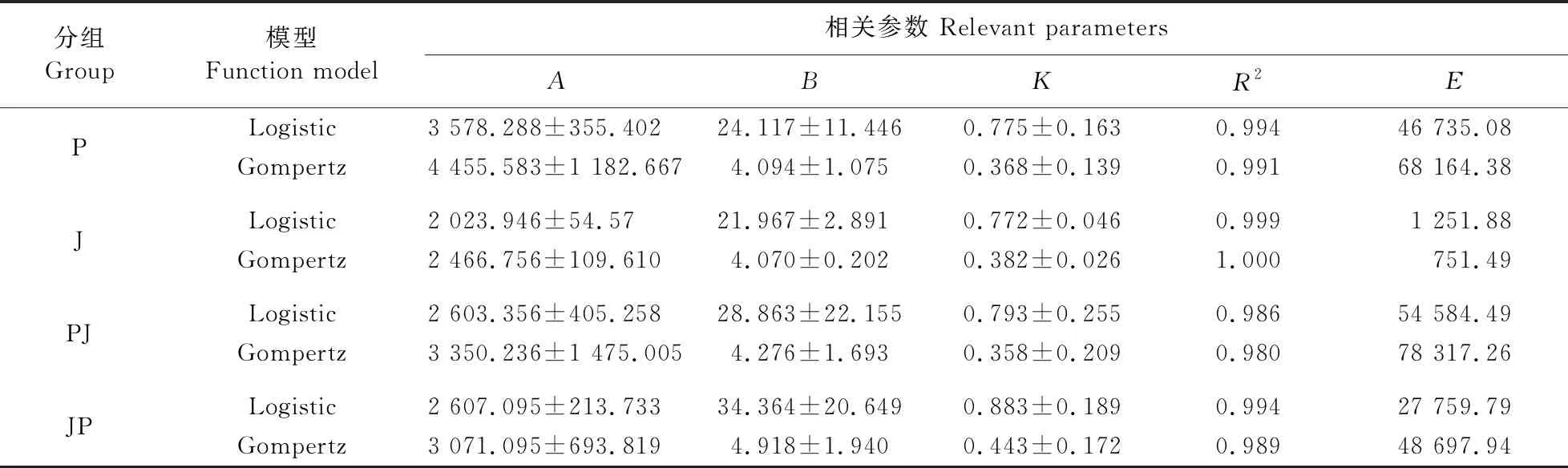
表4 生长曲线拟合相关参数Table 4 Relevant parameters of growth curve fitting

表5 不同群体鸭最适函数模型及其拐点分析和最大周增重Table 5 Optimal function model of different groups and their inflection point analysis and maximum weekly weight gain
2.3 不同群体鸭绝对和相对生长率
用最适函数模型计算鸭的相对生长和绝对生长曲线相对增长率。如图2所示:4组鸭的相对生长率整体差异不大,并且随周龄增加呈下降趋势。但J组在0周龄(1日龄)时,相对生长率大于1,这是由于计算函数模型的误差造成的(图2-A)。由图2-B可知,P组的生长水平高于其他3组,而PJ和JP组相差不大,但在4~6周龄JP组下降速度超过PJ组,在6周龄后J组的下降趋势逐渐减缓。4周龄时,4组绝对生长差异较为明显并达到顶峰。分别计算对应杂种优势率得知(图3):在4周龄之前,虽然相对生长率逐渐降低,但其和绝对生长率的杂种优势率均逐渐上升,在4周后开始下降。其中,F1代在2~5周的相对生长率表现出一定的杂种优势,但在绝对生长率并不明显。在4周前,JP组的绝对生长率较PJ组始终具有明显的优势,这也说明其前期生长速度快。在6周龄后,JP组的瞬时生长速度远远低于PJ组,PJ组在后期的生长速度具有一定优势,这些结果表明母体效应明显。
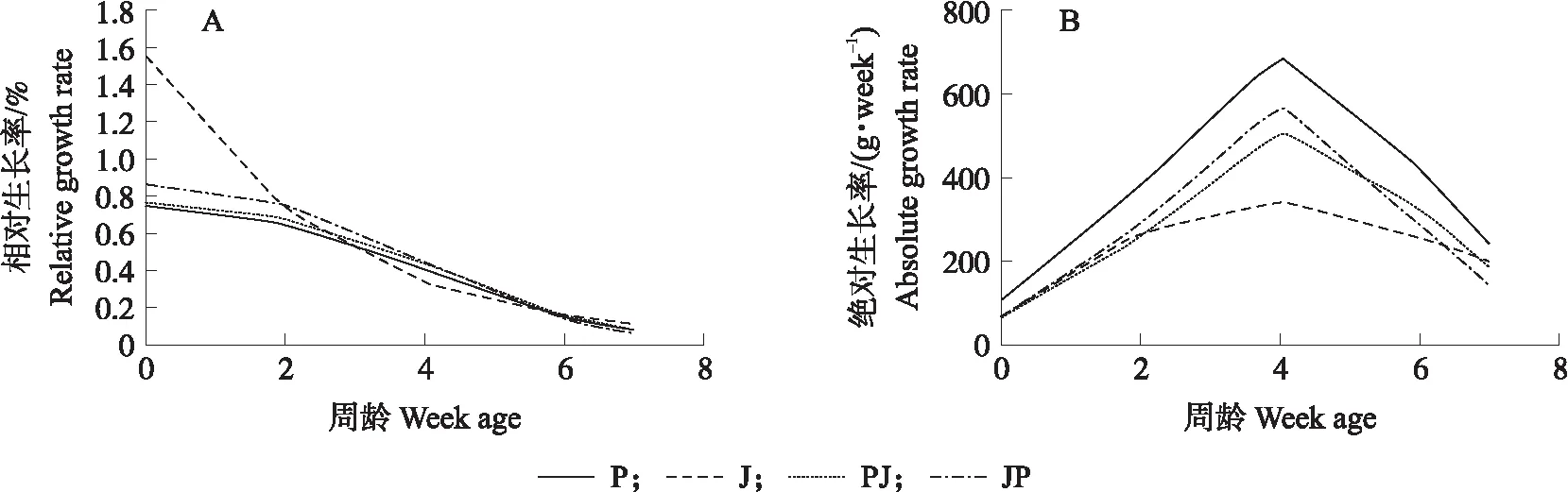
图2 不同群体最适相对生长率(A)和绝对生长率(B)Fig.2 The optimum curve of relative growth rate(A)and absolute growth rate(B)of different groups
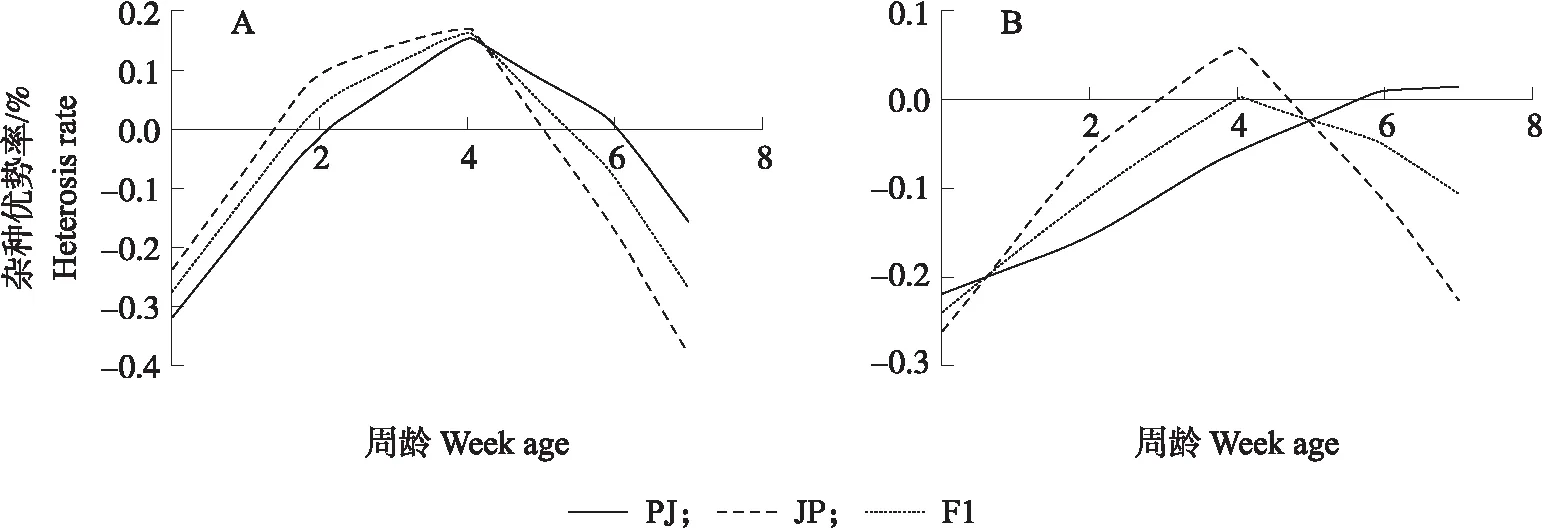
图3 杂交一代(F1)相对增长率(A)和绝对增长率(B)的杂种优势率Fig.3 Heterosis rate of relative growth rate(A)and absolute growth rate(B)of the first hybrid generation(F1)
2.4 不同群体公鸭肌纤维特性指标和相关基因表达水平比较
如图4所示:7周龄公鸭胸肌肌纤维从大到小依次为P、JP、PJ、J。如表6所示:经过计算,P组的肌纤维直径、横截面积和密度与其他3组均有极显著差异(P<0.01),各组的直径越大,密度越小;杂交组的各指标均介于亲本之间。此外,J和JP组肌纤维直径差异显著(P<0.05);J、PJ和JP组肌纤维横截面积差异不显著(P>0.05);J组肌纤维密度与其他3组差异均极显著(P<0.01),但PJ与JP组差异不显著(P>0.05)。
由图5可知:与肌肉发育相关基因表达水平在不同品种间具有差异,在P组的水平最高。各组Myf5基因的表达水平表明,P组与J组分别均与其他组具有极显著差异(P<0.01),而在PJ和JP组差异不显著(P>0.05);在MyoD1和MyoG的表达水平中,P组与其他3组具有极显著差异(P<0.01),而J、PJ、JP组之间并不具有显著差异(P>0.05);然而,P和JP组MEF2C的表达水平与其他组均具有极显著差异(P<0.01),J和PJ组表达水平相对较低,且差异不显著(P>0.05)。

图4 7周龄不同群体公鸭胸肌切片Fig.4 Paraffin sections of pectoral muscles of 7 week age male ducks of different groups

表6 不同群体公鸭肌纤维特性指标的比较Table 6 Comparison of muscle fiber characteristics of different male ducks
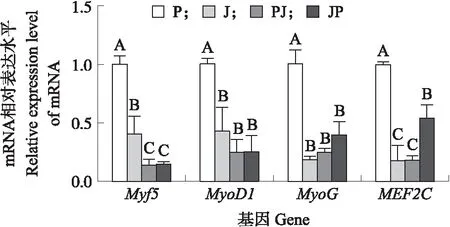
图5 肌肉发育相关基因在不同群体公鸭的表达水平Fig.5 Expression levels of muscle development related genes in male ducks of different groups柱上不同大写字母表示在0.01水平差异极显著。Different upper case letters on the column are significantly differnet at the level of 0.01.
2.5 胸肌重与肌纤维特性指标和相关基因表达的相关性分析
由表7可知:胸肌重分别与肌纤维直径、MEF2C表达水平极显著相关,与肌纤维密度极显著负相关(P<0.01),表明MEF2C的表达水平对肌纤维直径和胸肌重有重要影响,还需进一步加深对肌发生相关基因的研究。肌纤维直径、肌纤维面积均与肌纤维密度极显著负相关,从侧面证明了相关性分析的准确性。Myf5、MyoD1、MyoG、MEF2C之间均具有显著相关性(P<0.05),表明基因之间的协同作用。

表7 肌纤维特性指标和相关基因表达水平与体重的相关性(R2)Table 7 Correlation analysis between muscle fiber characteristics,related gene expression level and body weight(R2)
3 讨论
Gompertz和Logistic均属于S型生长曲线的计算模型,但由函数可以看出其一阶、二阶导数在中期具有一定差异。本试验发现仅有J组的2种模型拟合度最高,且Gompertz模型拟合度为1,而其他3组最适用Logistic模型拟合。这从侧面说明金陵白鸭经过北京鸭杂交改良后,生长速度明显提高且中期生长速度加快,而金陵白鸭在后期的生长速度具有一定优势,这与Z型北京鸭品系的曲线拟合结果相似[16-17]。但是,畜禽的生长满足这种生长规律的同时,易受环境和人为因素的影响,如丁贤群等[17]比较北京鸭生长模型时,最适曲线为Gompertz,且拐点为3.5周龄,与本试验结果不同。JP组4周龄的生长速度出现明显杂种优势,而PJ组在6周后才出现优势,这为F1代在后续选育中提供参考。
生长性能同样影响屠宰性能。胸肌作为与体重相关的育种指标被广泛研究。通过计算7周龄胸肌和活重的比率发现F1均具有杂种优势,而胸肌肌纤维的形成过程是造成品种间差异的主要原因。研究表明,不同条件不同品种肉牛的肌纤维及其类型具有显著差异[18],但是对鸭的研究中,由于缺乏鸭Ⅱ型肌纤维的抗体,很遗憾未能研究杂交后代之间与亲代的肌纤维类型差异。在出生后肌肉肥大过程中,不同时期的基因表达水平不同[19-20],但在不同品种,尤其是杂交后代中的差异研究很少。本研究中MEF2C表达水平在7周龄正反交鸭之间差异极显著,但肌纤维特性和其他基因表达水平在正反交组未体现出显著差异。

