娄地青霉和纳地青霉对发酵鸭肉制品理化特性和微观结构的影响
孙萍,王梦曼,王淑玲,孙京新,2,3 ,苗春伟,黄河,戴爱国,张晶
1.青岛农业大学 食品科学与工程学院,山东 青岛 266109;2.青岛特种食品研究院,山东 青岛 266109;3.山东省肉类食品质量控制工程技术研究中心,山东 青岛 266109;4.山东新希望六和集团有限公司,山东 青岛 266000;5.青岛波尼亚食品有限公司,山东 青岛 266100
0 引言
发酵肉制品是指鲜肉受微生物及自身酶的影响发生物理、化学及生物变化,从而获得独特风味、色泽和质地的肉制品,具有可即食、高营养、性状稳定、保质期长等优点,深受消费者喜爱[1]。细菌、酵母和霉菌都可以用作发酵肉制品的发酵剂[2]。阮一凡等[3]利用植物乳杆菌和酿酒酵母菌发酵鸭腿,在赋予产品良好风味的同时延长了产品货架期。J.A.Arcila等[4]研究发现,利用木糖葡萄球菌发酵肉制品所产生的硝酸盐还原酶、蛋白酶和脂肪分解酶可以保持肉制品的颜色。肉制品发酵菌株所产生的蛋白酶可将蛋白质和脂肪分解为氨基酸、小肽等,有助于开发干腌肉制品的特殊香味和风味[5]。此外,在肉制品表面接种霉菌会形成白色菌丝体,耗氧特性使其具有的抗氧化作用可防止肉制品表面过度干燥,改善肉制品质地;蛋白水解作用也可避免成熟肉制品(如香肠和火腿)硬度过大,从而改善产品口感[6]。蔡嘉铭等[7]研究发现,由枝孢菌作为优势菌发酵的香肠,杂菌数量降低,氧化减缓。C.Alapont等[8]研究发现,青霉菌属(如产黄青霉、纳地青霉等)的水解蛋白和肌球蛋白活性最高,既可作为发酵菌株,也可与蛋白水解菌株联合使用。然而,有害霉菌会影响肉制品的品质,产生的霉菌毒素会污染肉制品并使其腐败变质,且霉菌毒素通常是稳定的分子,一旦产生就很难去除[9]。因此,寻找无害且优质的霉菌发酵菌株对制作高品质发酵肉制品具有重要意义。
鸭肉物美价廉,国内外消费者对鸭肉制品的需求量逐年增加。娄地青霉和纳地青霉均属于耐酸、耐低氧和耐高浓度CO2的霉菌,将二者加入鲜肉中进行发酵,可以提高肉制品的风味并降低其他有害霉菌滋生的可能性[10]。课题组前期已对娄地青霉、产黄青霉[11]发酵鸡肉和鸭肉制品进行了研究,均取得了良好的发酵效果。基于此,本研究拟以新鲜鸭胸肉为原料,娄地青霉和纳地青霉为发酵菌株,探究两种霉菌对发酵鸭肉制品的理化特性和微观结构的影响,以期进一步寻找适用于发酵鸭肉制品的无害且优质的霉菌发酵菌株,为提高发酵鸭肉制品的品质提供理论依据和参考。
1 材料与方法
1.1 材料与试剂
纳地青霉(3.435 7)、娄地青霉(3.509 7),购于中国工业微生物菌种保藏管理中心;新鲜鸭胸肉,山东新希望六和集团有限公司产;NaCl、戊二醛、四氧化锇、乙醇、叔丁醇、Epon-812环氧树脂,均为分析纯,国药集团化学试剂有限公司产。
1.2 主要仪器与设备
TA-XT2i型质构仪,英国Stable Micro Systems公司产;7500F型扫描电子显微镜(SEM),日本电子株式会社(JEOL)产;EM UC7型超薄切片机,德国莱卡公司产;HT7700型透射电子显微镜(TEM),日本日立高新技术公司产;JY Labram HR 800型显微激光拉曼光谱仪,法国Jobin-Yvon公司产;MicroMR20-025型低场核磁共振分析仪,上海纽迈电子科技有限公司产。
1.3 实验方法
1.3.1 娄地青霉和纳地青霉菌悬液的制备将娄地青霉和纳地青霉菌株分别接入察氏琼脂培养基斜面,于22 ℃条件下恒温培养4 d后,用无菌水冲洗菌落并移入三角瓶(50 mL)内,振摇后过滤,冲洗滤渣3次。将两种霉菌的滤液分别于6000 r/min条件下离心10 min,获得澄清的孢子悬浮液后进行梯度稀释,即得目标菌悬液,备用。
1.3.2 发酵鸭肉制品的制备将新鲜鸭胸肉用手术刀切成3.0 cm×3.0 cm×1.0 cm块状,每个平皿(直径10 cm)中放置4块,并于121 ℃,0.1 MPa条件下灭菌15 min。无菌条件下,每个平皿均接种2 mL菌悬液于鸭肉中,于27 ℃条件下前发酵7 d后,将平皿中的肉块转移至质量分数为4.0%的NaCl溶液中,并于30 ℃恒温条件下密封后发酵13 d,分别制得娄地青霉发酵鸭肉制品和纳地青霉发酵鸭肉制品。
1.3.3 质构测定在室温条件下,采用质构仪测试发酵过程中的样品,每个样品均重复测试3次。参考W.Park等[12]的方法,采用TPA二次下压法,探头型号为P/0.5R柱状,测试前速度为2.0 mm/s,测试中速度为1.0 mm/s,测试后速度为5.0 mm/s,下压距离为8.0 mm,触发力为5.0 g。测定参数为硬度、黏性和弹性。
1.3.4 微观结构观察参考张丹等[13]的方法,并作适当修改。去除发酵鸭肉制品表面的霉菌菌膜,切成0.5 cm×0.5 cm×0.3 cm条状,浸泡于体积分数为2.5%的戊二醛溶液中,于4 ℃条件下固定12 h后,用磷酸缓冲盐溶液(0.1 mol/L)漂洗6次,每次20 min;将四氧化锇溶于磷酸缓冲盐溶液(0.2 mol/L)中,配制成质量分数为1.0%的溶液,将漂洗后的样品于4 ℃条件下浸入该溶液中2 h,再用磷酸缓冲盐溶液(0.1 mol/L)漂洗6次,每次10 min;每15 min用体积分数为50%、70%、80%和90%的乙醇溶液梯度脱水后,用纯乙醇脱水3次,每次30 min;再用叔丁醇置换3次,每次30 min;真空冷冻干燥后喷金,于SEM下(电压为15.0 kV)放大1000倍进行观察。再用Epon-812环氧树脂包埋发酵鸭肉制品,采用超薄切片机切片并自然干燥,于TEM下放大1000倍观察肌原纤维小片化程度。
1.3.5 拉曼光谱测定将样品切薄片后,置于显微激光拉曼光谱仪中进行测定,波数300~3500 cm-1,120 cm-1/min扫描3次。具体参数为:激光器785 nm,功率100 mW,光栅600 g/mm,分辨率2 cm-1,孔径200 μm,积分时间60 s。参考H.Susi等[14]的方法计算蛋白的二级结构(α-螺旋、β-折叠、β-转角和无规则卷曲)含量。
1.3.6 低场核磁共振(LF-NMR)测定称取去除霉菌菌膜的发酵鸭肉制品1.5 g,保鲜膜包好后装入15 mm核磁管中,放入低场核磁共振分析仪用CPMG序列进行横向驰豫时间(T2)测试,使用SIRT算法进行1 000 000次迭代拟合[15]。参数设置为:P90=4.5 μs,P180=9 μs,SW=200 kHz,D3=20 μs,TR=5000 ms,RG1=20,RG2=3,NS=4,EchoTime=300 μs,EchoCount=6000,重复扫描8次。
1.3.7 气相色谱-质谱(GC-MS)测定将萃取头老化60 min后插入瓶中顶空部分,于60 ℃条件下吸附60 min后,插入GC进样口,于250 ℃条件下解吸2 min。
GC条件:采用毛细管色谱柱(30 m×0.25 nm×0.25 μm);载气为He,流速为1.6 mL/min,不分流解析20 min;起始柱温40 ℃保持3 min,以5 ℃/min升温至200 ℃,再以10 ℃/min升温至240 ℃,保持10 min;运行总时间为49 min;检测温度为240 ℃。
MS条件:恒压13.022 kPa,离子源温度240 ℃,电子能量70 eV。
1.4 数据处理
利用SPSS软件对数据进行统计分析,采用方差分析和邓肯多重范围检验确定差异显著性,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 发酵鸭肉制品质构分析
2.1.1 硬度变化分析肉制品的硬度与蛋白变性、水解及水分流失有关,是衡量肉制品成熟度的一个指标[16]。不同霉菌发酵鸭肉制品在发酵过程中的硬度变化如图1所示,其中,不同大写字母表示同一发酵时间不同霉菌对发酵鸭肉制品硬度的影响差异显著(P<0.05),不同小写字母表示同一霉菌不同发酵时间对发酵鸭肉制品硬度的影响差异显著(P<0.05),下同。由图1可知,前发酵阶段,娄地青霉发酵鸭肉制品的硬度可达1 561.62 g,比同时期纳地青霉发酵鸭肉制品的硬度(1 530.74 g)略大,且两种霉菌发酵鸭肉制品的硬度均随发酵时间的延长而逐渐增加,这可能是因为该阶段的霉菌菌丝体将鸭肉紧密包裹形成保护层,且霉菌的生长降低了发酵鸭肉制品的水分活度。后发酵阶段,娄地青霉发酵鸭肉制品和纳地青霉发酵鸭肉制品的硬度最终分别降至652.82 g和451.37 g,且纳地青霉发酵鸭肉制品的硬度比娄地青霉发酵鸭肉制品显著降低(P<0.05),这可能是因为发酵鸭肉制品的蛋白发生水解,致使网状结构被破坏。这与蓝天婵等[11]的研究结果一致。
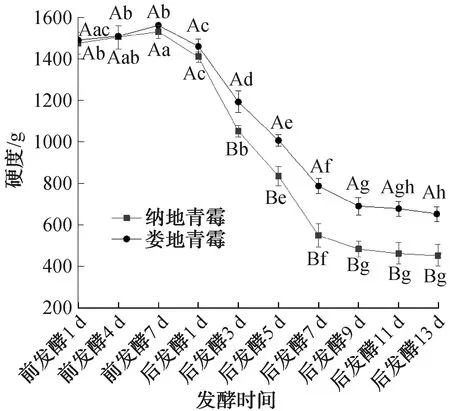
图1 不同霉菌发酵鸭肉制品在发酵过程中的硬度变化
2.1.2 黏性变化分析不同霉菌发酵鸭肉制品在发酵过程中的黏性变化如图2所示。由图2可知,前发酵阶段,两种发酵鸭肉制品的黏性均先增大后减小,其中娄地青霉发酵鸭肉制品和纳地青霉发酵鸭肉制品的黏性分别可达8.03 g/s和12.35 g/s。这可能是因为在前发酵阶段,霉菌数量先呈指数增长,在细胞外分泌多糖,不但会产生黏附于细胞表面的荚膜多糖,在细胞周围的培养基表面也会存在黏质多糖[17],导致发酵鸭肉制品表面的黏性增加。而当霉菌进入生长稳定期后会消耗大量水分,使发酵鸭肉制品含水量下降,黏性降低。后发酵阶段,娄地青霉发酵鸭肉制品和纳地青霉发酵鸭肉制品的黏性最终分别可达36.40 g/s和47.50 g/s,且纳地青霉发酵鸭肉制品的黏性比娄地青霉发酵鸭肉制品显著增大(P<0.05)。这可能是因为在后发酵阶段,霉菌生长缓慢,但代谢产物蛋白酶可将发酵鸭肉制品中的蛋白分解为分子更小的蛋白、胨、小肽等,导致固形物含量降低,黏性增加[18]。纳地青霉发酵鸭肉制品比娄地青霉发酵鸭肉制品提前2 d到达成熟期且黏性更大,这可能是因为纳地青霉的酶活力及对蛋白的分解能力更强,导致鸭肉蛋白分解快速彻底且结构更松散。

图2 不同霉菌发酵鸭肉制品在发酵过程中的黏性变化
2.1.3 弹性变化分析不同霉菌发酵鸭肉制品在发酵过程中的弹性变化如图3所示。由图3可知,在发酵过程中,两种发酵鸭肉制品的弹性总体呈下降趋势,娄地青霉发酵鸭肉制品和纳地青霉发酵鸭肉制品的弹性最终分别降至0.69和0.66,这可能是由于发酵对凝胶结构造成了破坏。纳地青霉发酵鸭肉制品的弹性下降速率较娄地青霉发酵鸭肉制品稍大,因而其最终发酵鸭肉制品的弹性更低。

图3 不同霉菌发酵鸭肉制品在发酵过程中的弹性变化
2.2 发酵鸭肉制品微观结构分析
不同霉菌发酵鸭肉制品的SEM图和TEM图分别如图4和图5所示。由图4可知,两种发酵鸭肉制品均无完整的肌纤维结构,表面呈颗粒状且相互粘连成糜状,其中纳地青霉发酵鸭肉制品比娄底青霉发酵鸭肉制品的表面平滑。S.Fadda等[19]利用植物乳杆菌提高发酵肉制品产酸证明了蛋白分解会影响发酵肉制品的微观结构。由图5可知,两种发酵鸭肉制品均无肌原纤维结构,肌节断裂为碎片状且无规则排列,碎片间空隙明显。这与K.Katsaras等[20]的研究结果一致。霉菌发酵对鸭肉肌原纤维结构变化起主要作用,肌原纤维结构的变化也印证了发酵鸭肉制品硬度显著降低(P<0.05)、黏性显著增大(P<0.05)是霉菌作用的结果。

图4 不同霉菌发酵鸭肉制品的SEM图(×1000)
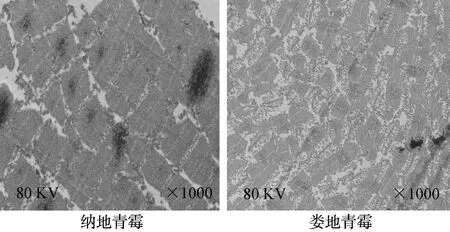
图5 不同霉菌发酵鸭肉制品的TEM图(×1000)
2.3 发酵鸭肉制品蛋白质构象分析
2.3.1 拉曼光谱分析不同霉菌发酵鸭肉制品的蛋白质结构拉曼光谱图如图6所示。由图6可知,娄地青霉发酵鸭肉制品和纳地青霉发酵鸭肉制品中二硫键的出峰波数分别为537 cm-1和556 cm-1,二硫键在发酵鸭肉制品蛋白质中的数量减少且结构被破坏,而二硫键的断裂会引起蛋白质高级结构(如蛋白活性、功能等)的改变[21]。结合发酵鸭肉制品TEM图可知,发酵鸭肉制品肌原纤维肌节断裂及蛋白结构的改变可能与二硫键峰值的降低有关。
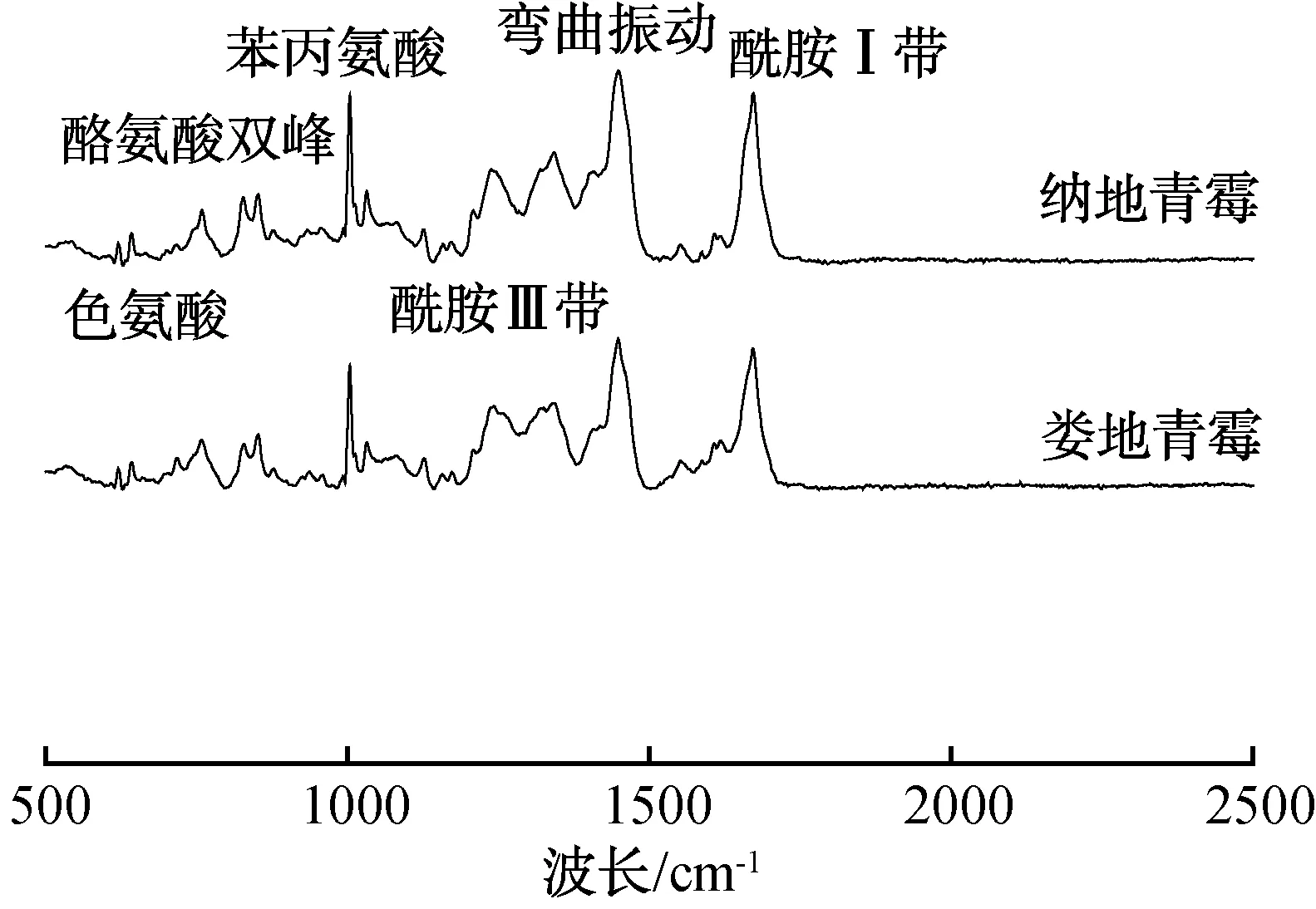
图6 不同霉菌发酵鸭肉制品的蛋白质结构拉曼光谱图(500~2500 cm-1)
2.3.2 蛋白质二级结构分析不同霉菌发酵鸭肉制品的蛋白质二级结构相对含量如图7所示。由图7可知,娄地青霉发酵鸭肉制品的蛋白质二级结构中α-螺旋相对含量(40.65%)显著低于纳地青霉发酵鸭肉制品(43.02%),但其β-折叠相对含量(29.78%)显著高于纳地青霉发酵鸭肉制品(27.33%)(P<0.05);两种发酵鸭肉制品的蛋白质二级结构中β-转角和无规则卷曲结构相对含量之和变化不显著(P>0.05)。蛋白质二级结构中α-螺旋减少、β-折叠增多可能与氢键的增加有关,这会导致蛋白质疏水性增强,这一结果与色氨酸和酪氨酸残基微环境的变化一致[22]。

图7 不同霉菌发酵鸭肉制品的蛋白质二级结构相对含量
2.3.3 蛋白质三级结构分析较高强度比(I760 cm-1/I1003 cm-1)的色氨酸残基用于表示疏水环境,随着强度比的降低,色氨酸残基由疏水环境变成亲水环境。酪氨酸残基强度比(I850 cm-1/I830 cm-1)用于确定酪氨酸残基是否被掩埋,当I850 cm-1低于I830 cm-1时,表示酪氨酸残基被掩埋在疏水环境中[23]。因此,色氨酸残基微环境均一化强度(I760 cm-1/I1003 cm-1)越大,疏水性越强;酪氨酸残基微环境均一化强度(I850 cm-1/I830 cm-1)越小,疏水性越强[11]。不同霉菌发酵鸭肉制品中色氨酸和酪氨酸残基微环境均一化强度见表1。由表1可知,娄地青霉发酵鸭肉制品中I760 cm-1/I1003 cm-1(0.713)显著高于纳地青霉制品(0.551)(P<0.05);娄地青霉发酵鸭肉制品中I850 cm-1/I830 cm-1(0.835)显著低于纳地青霉制品(0.958)(P<0.05)。这表明娄地青霉发酵鸭肉制品蛋白质的疏水性基团更易暴露出来,从而导致其疏水性比纳地青霉发酵鸭肉制品更强。

表1 不同霉菌发酵鸭肉制品中色氨酸和酪氨酸残基微环境均一化强度
2.4 LF-NMR分析
不同霉菌发酵鸭肉制品的T2分布和T2分布积分面积分别见表2和表3,其中,T20代表结合水,T21代表不易流动水,T22代表自由水。实际上,在肉制品中,除可以完全自由移动的水分之外,其余水分均被不同程度地束缚着[24]。由表2和表3可知,纳地青霉发酵鸭肉制品的T20和P20均显著小于娄地青霉发酵鸭肉制品(P<0.05),这表明纳地青霉发酵鸭肉制品的结合水含量显著少于娄地青霉发酵鸭肉制品。纳地青霉发酵鸭肉制品的T21显著小于娄地青霉发酵鸭肉制品(P<0.05),而二者的P21变化不显著(P>0.05)。纳地青霉发酵鸭肉制品在T22时均未出峰,因而对自由水变化的参考价值不大。

表2 不同霉菌发酵鸭肉制品的T2分布

表3 不同霉菌发酵鸭肉制品的T2分布积分面积
2.5 GC-MS分析
不同霉菌发酵鸭肉制品中的挥发性风味物质见表4。由表4可知,纳地青霉发酵鸭肉制品中的挥发性风味物质共51种,其中,醛类8种,烃类30种,酯类1种,酸类3种,酮类1种,醇类8种;娄地青霉发酵鸭肉制品中的挥发性风味物质共47种,其中,醛类7种,烃类28种,酯类1种,酸类3种,酮类2种,醇类6种。纳地青霉发酵鸭肉制品中产生了新的醛类(反-2-辛烯醛)和醇类(3,7-二甲基-1-辛醇、1-十六烷醇)物质。其中醛类物质是呈香物质且阈值很低,对风味起重要作用[25]。
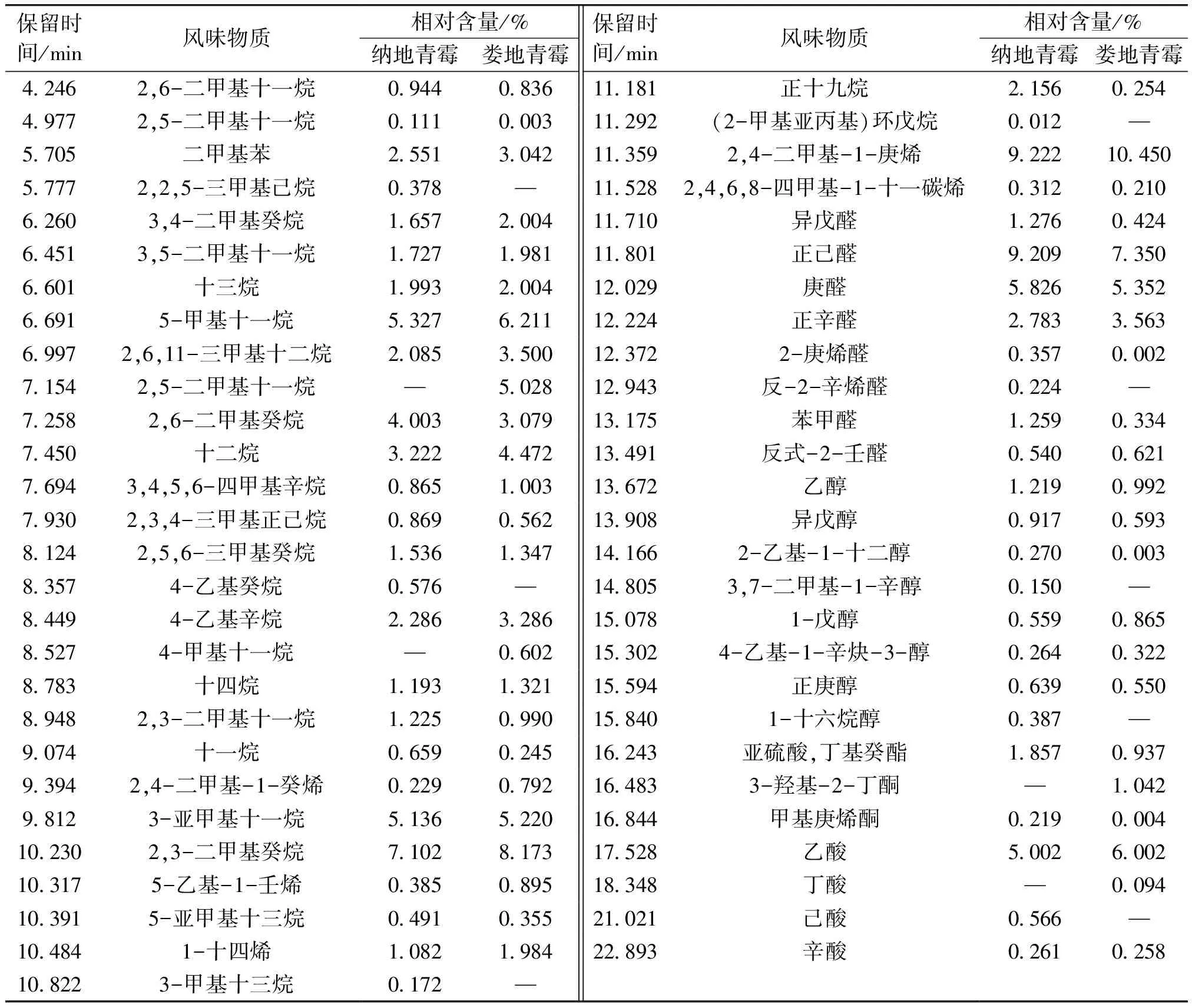
表4 不同霉菌发酵鸭肉制品中的挥发性风味物质
3 结论
本文将娄地青霉和纳地青霉分别接入灭菌处理后的鸭胸肉中,经27 ℃前发酵7 d,30 ℃后发酵13 d制得发酵鸭肉制品,分析了两种霉菌对发酵鸭肉制品的质构、微观结构、蛋白质构象、水分分布和挥发性风味物质的影响,得出如下结论:与娄地青霉鸭肉制品相比,纳地青霉发酵鸭肉制品的硬度更低且弹性下降更快,结合水含量较少,具有更平滑的表面;两种发酵鸭肉制品均无肌原纤维结构,蛋白质二级结构中α-螺旋减少、β-折叠增多;纳地青霉发酵鸭肉制品的挥发性风味物质较娄地青霉发酵鸭肉制品多,且产生了新的醛类和醇类物质。综上所述,纳地青霉更适宜作为发酵剂用于生产特定风味和质地的新型即食发酵鸭肉制品,该结论对提升鸭肉制品的精深加工及综合利用水平具有一定意义。

