无机杂化脂肪酶的制备及其催化性能研究
陈林林, 张佳欣, 李 伟, 王 玲, 宋佳琪, 辛嘉英,2
(1. 哈尔滨商业大学 省高校食品科学与工程重点实验室, 黑龙江 哈尔滨 150076;2. 中国科学院兰州化学物理研究所 羰基合成与选择氧化国家重点实验室, 甘肃 兰州 730000)
脂肪酶属于水解酶, 是最广泛的生物催化剂之一, 具有专一性强、 反应条件温和以及可被生物降解等优点[1-3]. 在食品领域, 脂肪酶常常用于改善食品的风味, 延长食品的货架期等[4]. 然而, 天然的脂肪酶在高温和有机溶剂等非自然环境中稳定性较差, 催化反应存在着不稳定、 难以重复利用等问题[1,5]. 为了克服上述不足, 建立了多种酶的固定化方法用来提高脂肪酶的催化性能和稳定性. 传统的酶固定化的方法主要有吸附法、 共价结合法、 包埋法及交联法等[6]. Galina等[7]通过吸附法制备了多孔碳气凝胶固定化脂肪酶, 在合成脂肪酸酯时表现出高度稳定性, 可运行数百小时. 但传统固定化方法制备过程繁琐, 固定化酶的机械性能较差并且酶易失活[8-9].
因此, 开发一种新型的高效酶固定化方法成为了目前研究的热点[10]. 新型固定化酶方法主要有两种: 一是基于改良酶的固定化开发技术, 如微波辐射辅助固定化技术、 膜固定化技术等[11]; 二是选择优良的载体, 进行固定化酶. 载体材料主要包括无机材料、 有机材料和复合材料[11-12]. 其中无机载体是一种可以直接从自然界中获得或可以通过简单的无机材料固定酶的载体. Xu等[13]制备了铽金属-有机框架@二氧化锰纳米复合材料, 并将由胆固醇氧化酶和磷酸铜自组装制备的杂化纳米花混合, 与游离酶相比, 固定化酶对胆固醇表现出相似的敏感性和特异性. 但无机杂化材料合成的过程相对复杂、在高浓度盐、 高浓度底物和高温的环境下易发生解吸等问题, 如介孔二氧化硅虽具有较大的比表面积和孔隙率, 但却面临着酶易浸出和变性等稳定性的问题[14]. 因此, 通常在对酶进行固定化时需要考虑操作情况、 成本以及是否会破坏酶活和稳定性等方面[15]的问题.
近年来, 随着纳米技术的发展, 纳米无机材料载体因其原料易得、 价格低廉、 不易分解且无毒无害等特点逐渐成为酶固定化的选择. 2012年, 一种创新性杂化纳米花固定化酶被提出[16]. 游离脂肪酶参与形成的脂肪酶杂化纳米花(Lipase Hybrid Nanoflower, Lip-hNF)弥补了固定化酶技术的不足,为酶的固定化技术发展开辟了新的方向[17]. 该方法是由酶分子和金属盐无机自组装形成的, 其合成过程分为3步: 成核、 异向生长和形成花形[16,18]. 与其他固定化方法不同的是, 无机杂化纳米花具有独特的多孔花状结构及较大的表面积, 有利于传质过程的发生[19], 还能够有效地提升酶的利用率, 减少游离酶的浪费, 合成的固定化酶具有易回收可重复使用等优点, 可以降低酶的使用成本, 同时可以改善酶的活性及储存稳定性[18-20]. Zhong等[21]制备了高活性、 可循环利用的磁性活性的杂化酶, 与游离脂肪酶相比, 杂化酶的活性恢复率高达190%, 贮藏稳定性和甲醇耐受性均有提高. Li等[22]研究了不同合成条件对杂化酶形状和活性的影响, 其中用2价金属离子合成的杂化酶活性高于用1价金属离子或3价金属离子合成的杂化酶催化活性. Jia等[23]采用反相微乳液法合成了带有-NH2基团的介孔二氧化硅纳米花并将脂肪酶固定在合成无机纳米材料上,制备的固定化酶表现出良好的稳定性和可回收性.
杂化酶的形成主要是基于金属离子与酶分子胺基之间的相互作用, 不同种类的金属离子会影响酶在杂化酶纳米花中的活性, 能够改变游离脂肪酶的结构和形貌特征, 从而改变杂化酶的稳定性和催化活性[24-25]. 我们利用酶-无机杂化技术对洋葱伯克霍尔德菌脂肪酶进行固定化, 系统考察4种2价金属离子Ca2+、 Zn2+、 Mn2+和Cu2+对合成杂化酶的二级结构、 最佳反应条件下的催化活性、 耐受性和重复性的影响. 目的是制备出催化活性和稳定性好、 耐受性和重复性高的杂化酶, 为探究固定化酶在实际中的应用提供依据.
1 实验部分
1.1 仪器与试剂
洋葱伯克霍尔德菌脂肪酶水解活力为1828 U/mg; 氯化钙, 购自天津市风船化学试剂科技有限公司; 硫酸锌、 磷酸氢二钠、 磷酸二氢钠和无水乙醇,购自天津市天力化学试剂有限公司; 硫酸锰, 购自天津博迪化工股份有限公司; 硫酸铜, 购自汕头市西陇化工厂有限公司; 棕榈酸对硝基苯酯, 购自阿拉丁试剂有限公司; 对硝基苯酚, 购自上海麦克林生化科技有限公司; 甲醇, 购自天津市福晨化学试剂厂; 尿素, 购自天津市光复科技发展有限公司. 所有试剂均为分析纯.
XT 220A 精密电子天平、 Z-16K 冷冻离心机、 UV-2550 紫外-可见分光光度计、 PerkinElmer Spectrum Two傅里叶变换红外光谱仪、 JEM-2100 型透射电子显微镜、 SU1510 扫描电子显微镜、 TGL-16高速台式离心机、 HWS24电热恒温水浴锅.
1.2 杂化脂肪酶制备
10 mL离心管中放入6 mL 100 mmol/L磷酸盐缓冲溶液(PBS, pH=7.5), 加入1 mL 1 mg/mL的脂肪酶和200 μL 200 mmol/L金属盐溶液(CaCl2, ZnSO4,MnSO4, CuSO4), 混匀, 室温下放置24 h. 离心, 蒸馏水洗涤3次, 冻干, 收集杂化脂肪酶[22].
1.3 催化反应条件对杂化脂肪酶活性的影响
1.3.1 反应时间对杂化脂肪酶活性的影响
为了选择合适的反应时间, 称取0.002 g 杂化酶添加到2.8 mL 100 mmol/L PBS(pH=8.0)中, 加入0.2 mL 10 mmol/L棕榈酸对硝基苯酯(P-NPP), 在不同反应时间下(1、 5、 10、 15、 20、 30、 35和40 min)检测反应体系在400 nm处的吸光值, 确定最佳反应时间[26].
1.3.2 反应温度对杂化脂肪酶活性的影响
为了优化反应温度, 称取0.002 g 杂化酶, 添加到2.8 mL 100 mmol/L PBS(pH=8.0)中, 加入0.2 mL 10 mmol/L P-NPP, 在不同反应温度下(25、 30、 40、50、 60和70 ℃)水浴, 检测反应体系在400 nm处的吸光值, 确定最佳反应温度[27-28].
1.3.3 pH值对杂化脂肪酶活性的影响
为了检测pH值对反应的影响, 称取0.002 g 杂化酶, 添加到2.8 mL 100 mmol/L PBS中, 加入0.2 mL 10 mmol/L P-NPP, 在最佳反应温度下, 不同pH值缓冲溶液中(7、 8、 9和10)检测反应体系在400 nm处的吸光值, 确定反应最佳pH值[28].
1.4 杂化脂肪酶包封率
采用紫外分光光度计法测定杂化酶制备过程中游离脂肪酶的包封率[24]. 配制一系列含不同浓度(0.0、 0.1、 0.3、 0.5、 0.8和1.0 mg/mL)游离脂肪酶的PBS标准溶液, 在270 nm下测定吸光度, A270nm为纵坐标, 游离脂肪酶浓度为横坐标绘制标准曲线, 得到线性回归方程:y= 0.2919x+ 0.0683. 分别测定不同金属离子固定化酶反应后上清液在270 nm处吸光度, 根据标准曲线线性方程计算出上清液中游离脂肪酶的浓度, 通过公式(1)计算杂化酶制备过程中游离脂肪酶的包封率.

式中:X为包封率;C0为游离脂肪酶浓度;Csample为上清液中游离脂肪酶的浓度.
1.5 杂化脂肪酶酶活测定
1.5.1 标准曲线的绘制
配置不同浓度(0、 0.03、 0.06、 0.09 和0.12 μg/L)的的对硝基苯酚(P-NP)乙醇溶液, 在紫外分光光度计400 nm下检测, 并记录吸光值. 以P-NP 的浓度为横坐标, A400nm为纵坐标, 得到线性回归曲线:y=13.776x+ 0.036, 用于脂肪酶酶活的计算[29].
1.5.2 对硝基苯酚法测酶活
酶活性测定建立在Zhang等[30]的检测方法上:将0.002 g的杂化酶添加到2.8 mL 100 mmol/L PBS(pH=8.0)中, 加入0.2 mL 10 mmol/LP-NPP, 40 ℃孵育10 min, 加入1.5 mL丙酮以终止反应. 最后, 用紫外分光光度计在400 nm处检测反应溶液, 记录吸光值A400nm, 以100 mmol/L PBS(pH=8.0)为空白溶液,400 nm处检测记录吸光值A0, 记算出酶活. 1个酶活力单位(U)定义为1 min内生成1 μmol/L P-NP所需的脂肪酶的酶量.
1.6 杂化脂肪酶催化性能及反应动力学参数测定
配置不同浓度(6、 8和10 mmol/L)的底物P-NPP,称取0.002 g 杂化酶置于4 mL离心管中, 加入 2.8 mL 100 mmol/L PBS(pH=8.0)和0.2 mL不同浓度的P-NPP, 最适温度下杂化脂肪酶的酶促反应速率, 利用米氏函数拟合数据, 分别以1/V为纵坐标, 1/[S]为横坐标作图, 根据双倒数作图法公式(2)、 公式(3)计算出Vm、Km和Kcat[31].

式中:V为酶促反应速率;Vm为最大反应速率;Km为米氏常数; [S]为底物浓度.

式中:Kcat为催化常数;Vm为最大反应速率; [S]为底物浓度.
1.7 杂化脂肪酶耐受性分析
取0.002 g的游离脂肪酶和杂化酶, 置于4 mL离心管中, 分别向每个离心管中加入1 mL的变性剂溶液(95%无水乙醇、 甲醇和6 mmol/L尿素), 常温下放置30 min后, 按1.5.2的方法直接测定酶活[25].
1.8 杂化脂肪酶重复性分析
取2 mg 杂化酶, 置于4 mL离心管中, 向离心管中分别加入2.8 mL 100 mmol/L的PBS缓冲溶液(pH 8)和0.2 mL的底物, 振荡混匀, 将离心管置于40 ℃的水浴锅中反应10 min后, 离心分离回收杂化酶,上清液用分光光度计在400 nm下读取其吸光值. 回收的杂化酶用蒸馏水清洗3遍后, 加入2.8 mL 100 mmol/L的PBS缓冲溶液(pH=8)和0.2 mL的底物, 重复以上操作过程, 再次测定酶活, 连续测定3次. 将首次测定的杂化酶的酶活定义为100%. 其余次数测定的杂化酶的酶活, 计算其剩余酶活[32].
2 结果与讨论
2.1 杂化脂肪酶表征
2.1.1 杂化脂肪酶红外光谱表征
傅立叶红外光谱图用于表征制备杂化酶化学键的变化. 图1(a)所示游离脂肪酶在1415~1657 cm-1处的3个特征峰, 是肽键及其蛋白质延伸的特征,如-NH2和C=O; 3000~3200 cm-1处的宽而强的特征峰归属于-CH2和-CH3. 图1(b)为Ca脂肪酶杂化纳米花(Ca/hNF), 与游离脂肪酶相比在928~1091 cm-1处观察到多个P-O振动和拉伸特征峰, 相对较小的波段在554~643 cm-1是PO43-的反对称和对称伸缩振动弱吸收峰, 证明了在杂化脂肪酶中磷酸根的存在; Ca/hNF的特征峰在1642和3000~3200 cm-1有所增强, 表明游离脂肪酶被固定在Ca/hNF中, 1538和1425 cm-1处的酰胺特征峰消失, 说明在杂化酶的形成过程中蛋白质二级结构发生了变化. 这些结果表明所制备Ca/hNF中既含有磷酸根, 又含有游离脂肪酶.
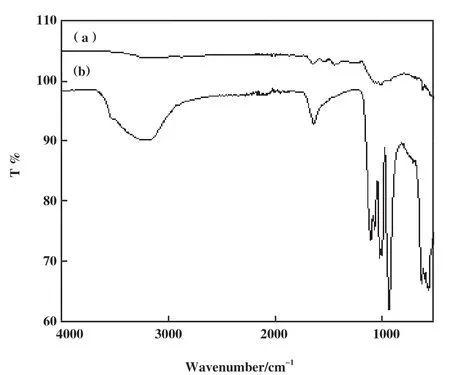
图1 游离脂肪酶和杂化纳米花的傅立叶红外光谱Fig.1 Fourier infrared spectroscopy of free-lipase and Ca/hNF(a): free-lipase; (b): Ca/hNF
采用红外光谱图探究由不同种金属离子形成杂化酶二级结构的影响. 从图2可知, 形成的Lip-hNF均观察到PO43-和蛋白质的特征峰, 证明了Ca2+、Zn2+、 Mn2+、 Cu2+这4种金属离子均能与游离脂肪酶无机杂化, 改变蛋白质的结构, 但其特征峰有着不同程度的增强或削弱, 其中Ca/hNF的磷酸根特征峰,酰胺Ⅰ带特征峰最强, 纳米花结构形成的最为明显,Mn/hNF的磷酸根特征峰要强于Zn/hNF, Cu/hNF的纳米花结构较弱. 以上结果表明, 不同种的金属离子对杂化酶的二级结构有不同程度的改变, 对合成Lip-hNF催化活性的影响不同.
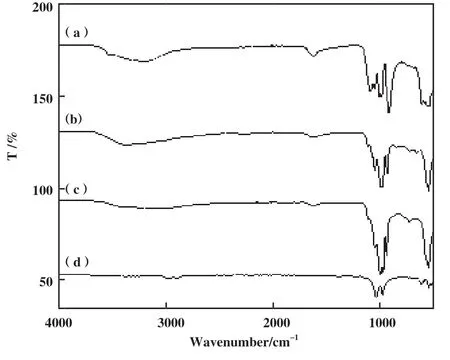
图2 杂化脂肪酶的傅立叶红外光谱Fig.2 Fourier infrared spectroscopy of hybrid lipases(a): Ca/hNF; (b): Zn/hNF; (c): Mn/hNF; (d): Cu/hNF
2.1.2 杂化脂肪酶电镜表征
为了进一步了解脂肪酶杂化的纳米花微观形态, 借助了扫描电镜(SEM)、 透射电镜(TEM)和激光扫描共聚焦显微镜(CLSM)(如图3所示). 从图3(a), (b)可以看到该固定化酶体系的微观结构为花状, 具有层级结构, 每一个纳米花的大小约为1 μm. 透射电子显微镜图3(c)进一步显示出的这种花状结构, Ca/hNF为层级片状结构, 可以看到金属盐离子的存在,具有较大的比表面积, 说明了该结构下的固定化酶相比游离酶会增加酶的活性. 此外, 为了确定脂肪酶分子在杂化酶中的固定情况, 在CLSM图3(d)图像中可以清楚地观察到脂肪酶的荧光成像, 进一步说明脂肪酶在Ca/hNF中成功固定.

图3 Ca/hNF的电镜扫描图Fig.3 Electron microscopic scan of Ca/hNF(a), (b): SEM; (c): TEM; (d): CLSM
2.2 催化反应条件对杂化脂肪酶活性的影响
2.2.1 反应时间对杂化脂肪酶活性的影响
考察反应时间对杂化酶催化活性的影响, 以确定杂化酶的反应速率. 从图4可看出4种Lip-hNF在反应1~10 min内吸光值在反应体系中的浓度均随着时间增长而增加, 呈现显著上升的趋势(P<0.01), 10 min后反应速率开始降低, 并趋于平稳. 其中Ca/hNF的水解速率要大于Zn/hNF、 Mn/hNF和Cu/hNF. 因此, 杂化酶催化水解反应的最优反应时间为10 min.

图4 不同反应时间对杂化酶酶活的影响Fig.4 Effects of different reaction times on enzyme activity of hybrid enzymes
2.2.2 反应温度对杂化脂肪酶活性的影响
反应温度会影响杂化酶的催化活性和热稳定性, 它是影响化学平衡常数的一个重要参数. 结果如图5所示, 4种Lip-hNF在反应温度为25~40 ℃时吸光值在反应体系中的浓度均随着温度的增长而增加, 呈现显著上升的趋势(P<0.01), 40 ℃后温度升高, 反应速率开始下降. 总体呈现出反应速率均随温度的增高而先升高后降低的趋势, 与Li等[22]其自组装制备的Ca/hNF变化趋势一致. 这是因为随着温度升高, 会加快杂化酶的催化反应进程, 但随着温度的持续升高, 酶的活性中心结构会被破坏, 导致杂化酶的水解活性下降或失活. 其中Ca/hNF在50 ℃时其水解活性为游离脂肪酶的197%, Mn/hNF的水解活性在50 ~70 ℃时要低于Cu/hNF. 表明了杂化酶的纳米花结构对脂肪酶有保护作用, 展示出良好的热稳定性. 因此, 杂化酶的最优反应温度为40 ℃.

图5 不同反应温度对杂化酶酶活的影响Fig.5 Effects of different reaction temperatures on enzyme activity of hybrid enzymes
2.2.3 pH值对杂化脂肪酶活性的影响
考察pH值分别为7、 8、 9、 10的缓冲溶液对杂化酶催化水解能力的影响. 从图6可知, 杂化酶在碱性条件下水解效果最佳, 在pH值为7~8范围内,杂化酶的水解产物在反应体系中的浓度随着pH值的增加, 呈现显著上升的趋势(P<0.01). Ca/hNF、 Zn/hNF在缓冲溶液pH值为10时的水解活性分别为最佳水解活性的84.75%和78.86%, 能较好地维持杂化酶水解活力的稳定性. Mn/hNF、 Cu/hNF在缓冲溶液pH值变化时, 其稳定性为最佳反应pH的57.49%和58.98%. 可以得出不同种金属离子不会改变水解反应的最佳pH值, 与Zhang等[30]制备Zn/hNF呈现相同的趋势. 可以看出, 当pH值为8时杂化酶的活力最大, 并在极端碱性的pH条件下, 其纳米花结构仍能保护脂肪酶不被破坏, 维持一定的酶活力. 实验结果表明, 杂化酶在催化环境变化下, 4种杂化酶的催化活性变化趋势相近. Lip-hNF的最优pH值为8.

图6 不同反应pH对杂化酶酶活的影响Fig.6 Effects of different pH on enzyme activity of hybrid enzymes
2.3 杂化脂肪酶包封率
根据公式(1)计算出杂化酶中游离脂肪酶的包封率如图7 所示. 其中Ca/hNF的包封率为95.78%,大于其余3 种Lip-hNF, Mn/hNF中固定脂肪酶的含量要大于Zn/hNF, Cu/hNF的固定化效率最低为91.89%. 杂化酶的包封率根据金属离子的不同, 包封率无显著差异(P<0.01), 均大于90%, 体现出良好的固定化效率.
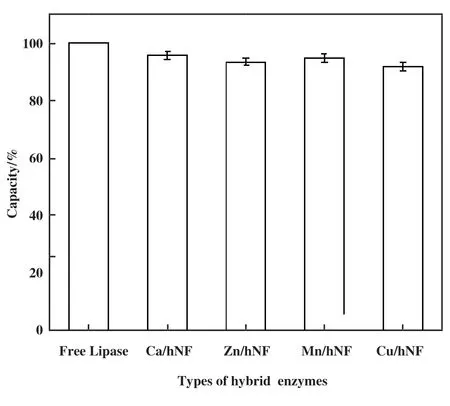
图7 杂化脂肪酶包封率Fig.7 Encapsulation rate of hybrid lipases
2.4 杂化脂肪酶酶活测定
固定化酶会与底物接触受到限制, 通常游离脂肪酶被固定化后活性会下降, 活性是评价固定化酶的一个重要指标. 结果如图8所示, 杂化酶的水解活性均大于游离脂肪酶, 活性从高到低的顺序依次为:Ca/hNF >Zn/hNF >Mn/hNF >Cu/hNF. 其中Ca/hNF的酶活为游离脂肪酶活性的187%, Zn/hNF的酶活为游离脂肪酶活性的148% , Mn/hNF的酶活为游离脂肪酶活性的137% , Cu/hNF的为游离脂肪酶活性的108%. 从生长机理来讲, 金属离子能通过协调相互作用与酶分子形成复合物, 这是杂化酶形成的关键.不同金属离子杂化酶活性增强的原因可以归于较高的比表面积和二级结构的改变, 其中Ca2+作为生物体中一种重要的元素, 参与整个生命的新陈代谢.对于脂肪酶有激发作用, 使得酶分子更容易与底物接触, 进一步提高杂化酶的催化活性.
2.5 杂化脂肪酶催化性能及反应动力学参数
为了进一步了解杂化酶的性质, 测定了游离脂肪酶和Ca/hNF、 Zn/hNF、 Mn/hNF、 Cu/hNF的动力学参数, 结果如表1所示.
Km值通常用于评估亲和力. 表1 显示游离脂肪酶的Km值小于杂化酶, 表明底物和脂肪酶之间的扩散阻力较高, 从而导致杂化酶的Km增大. 其中Ca/hNF的Km要小于其它3 种Lip-hNF. 然而, 较高的Vmax表明杂化酶相对于游离脂肪酶具有较高的催化效率.Kcat/Km常用来衡量酶的催化效率, 被称为特异性常数, 能够综合反映酶对底物的亲和力和催化能力[29]. 4 种Lip-hNF的反应速率Kcat/Km从高到低的顺序依次为: Ca/hNF >Zn/hNF >Mn/hNF >Cu/hNF. 与游离脂肪酶相比, 杂化酶的Vm/Km值高于游离脂肪酶, 说明杂化酶的催化效率要强于游离脂肪酶, 杂化酶的Km值和催化效率与Li等[22]和Talbert等[33]制备的杂化纳米花呈现相同的趋势, 固定化酶的Km大于游离脂肪酶, 但杂化酶的Kcat/Km高于游离脂肪酶, 这可能与脂肪酶纳米花独特的花状结构所具有的高比表面积有关[34], 表明纳米花状的杂化酶使酶分子朝着有利于催化水解反应速率的方向而改变.

表1 游离脂肪酶和杂化脂肪酶的动力学参数Table 1 Kinetic parameters of free lipase and Lip-hNF
2.6 杂化脂肪酶耐受性
杂化酶对于变性剂耐受性如图9所示, 对于甲醇的耐受性由大到小为: Ca/hNF > Zn/hNF > Mn/hNF >Cu/hNF; 对乙醇的耐受性由大到小为: Ca/hNF >Cu/hNF > Mn/hNF > Zn/hNF; 在尿素中的酶活均保持在90%以上, 对尿素的耐受性由大到小为Ca/hNF >Zn/hNF > Cu/hNF > Mn/hNF. 结果显示, 杂化酶在变性剂中维持着良好的水解活性, 对于这3种变性剂的耐受性由高到低的排序为: 尿素 > 乙醇 > 甲醇, 在尿素中的水解活性显著高于其余3种杂化酶(P<0.01).

图9 杂化脂肪酶在不同变性剂下的耐受性Fig.9 Tolerance of hybrid lipases to different denaturing agents
2.7 杂化脂肪酶重复利用性
脂肪酶被开发利用, 良好的重复次数可以极大地降低使用成本, 扩大在工业上的应用, 杂化酶可通过离心的方法重复使用. 如图10所示, 在重复使用3次后, 4种Lip-hNF的活性仍能保持在60%以上,具有良好的重复使用性.

图10 杂化脂肪酶的重复利用性Fig.10 Reusability of hybrid lipases
制备的杂化酶催化活性与其他新型固定化酶方法的比较见表2. 与文献报道的其它固定化酶方法相比, 本法制备出的杂化酶包封率高, 催化活性高,具有良好的重复性和耐受性.

表2 不同方法固定化酶催化性能比较Table 2 Comparison of catalytic performance of immobilized enzymes by different methods
3 结论
采用Ca、 Mn、 Zn、 Cu 4种金属盐对游离脂肪酶进行固定化, 讨论了反应时间、 反应温度、 pH值对杂化酶水解活性的影响, 得到最优反应体系: 杂化酶在10 min, 40 ℃, pH=8时的反应条件下, 催化水解活性最佳, 为游离脂肪酶催化活性的187%. 经红外光谱及电镜的表征结果证明金属盐离子改变游离脂肪酶的结构为片状层级, 增大了比表面积, 有效地提高脂肪酶催化水解活性. 杂化酶的催化活性从大到小的排序为: Ca>Zn>Mn>Cu, 对其动力学参数进行研究后发现, 4种Lip-hNF的反应速率常数Kcat/Km大于游离脂肪酶, 表现出更高的催化效率. 杂化酶对甲醇、 乙醇、 尿素的耐受性和重复性的考察结果表明, 在4种Lip-hNF中Ca/hNF具有更高的耐受变性剂能力; 在重复使用3次后, 杂化酶的活性仍能保持在60%以上, 可以看出杂化纳米花具有良好的重复使用性. 经过4种金属盐修饰后脂肪酶的性能均得到有效改善, 其中Ca杂化酶因Ca2+良好的生物相容性对于脂肪酶催化水解性能的改善更佳. 我们制备的杂化纳米花状脂肪酶固定化方法简单, 绿色高效, 包封率高, 具有良好的应用前景.

