腹腔镜袖状胃切除术治疗超级肥胖症的疗效与评价
玉苏普江·伊明江,伊尔潘江·库尔班,马永斌,依力汗·依明,买买提·依斯热依力,皮尔地瓦斯,阿力木江·麦斯依提,邓秀丽,艾克拜尔·艾力,克力木·阿不都热依木
(1.新疆维吾尔自治区人民医院微创、疝和腹壁外科,新疆 乌鲁木齐,830001;2.新疆医科大学研究生学院;3.喀什地区第一人民医院胃肠外科)
由于社会经济的发展及人们饮食习惯的改变,国内超重及肥胖人群数量呈现明显上升趋势,且肥胖程度也越来越严重[1-2],超级肥胖症—体重指数(body mass index,BMI)超过50 kg/m2的患者也日益增多;这不但对人们身心健康产生了强大压力,也增加了一系列慢性病的潜在危险因素,如高血压、2型糖尿病、骨关节病、阻塞性睡眠呼吸暂停综合征、脂肪肝等。传统的饮食控制、运动甚至药物治疗都不能有效地将体重降至理想状态,尤其超级肥胖症的病态肥胖患者[3]。近年,腹腔镜袖状胃切除术(laparoscopic sleeve gastrectomy,LSG)由于操作简单、对生理结构损伤小、安全性高、疗效明显等优点,已迅速普及,成为最常用的减重与代谢手术方法,约占所有减重与代谢手术的50%[4]。目前,国内外专家对于超级肥胖症治疗术式的选择持不同意见。Gonzalez-Heredia等[5]认为,胃旁路手术对于超级肥胖症的疗效明显高于LSG;Han等认为,与接受胃旁路手术的患者相比,接受LSG的患者术后并发症发生率、再手术率较低[6];也有部分国外学者发现,LSG作为一期术式即达到了所需的治疗效果[7]。但目前国内对于独立LSG治疗超级肥胖症的相关研究较少,本研究旨在分析与评价独立LSG治疗超级肥胖症的临床疗效。
1 资料与方法
1.1 临床资料 回顾分析2013年5月至2019年5月在新疆维吾尔自治区人民医院接受LSG且随访满12个月的66例超级肥胖症患者的临床资料,其中男29例,女37例,20~60岁,平均(37.95±11.3)岁;BMI 50.1~69.9 kg/m2,平均(53.11±5.7)kg/m2。患者术前合并高血压病28例(42.42%)、高尿酸血症31例(46.97%)、2型糖尿病26例(39.39%)、高甘油三酯血症13例(19.70%)、高胆固醇血症14例(21.21%)、阻塞性睡眠呼吸暂停综合征49例(74.24%)、胃食管反流病31例(46.97%)、食管裂孔疝9例(13.64%)、胆囊结石13例(19.70%)。术前患者均被详细告知手术风险并签署知情同意书,手术均由同一位外科医师完成。
1.2 纳入与排除标准 纳入标准:(1)18~60岁;(2)BMI≥50 kg/m2;(3)系统的内科减重失败;(4)排除继发性肥胖;(5)无主要精神疾病,并具有较好的依从性;(6)无主要器官功能严重异常等手术禁忌;(7)知情同意本研究并能完成术后1、3、6、12个月的定期随访。排除标准:(1)不符合肥胖与T2DM外科治疗诊断标准;(2)有减重手术史、对脂代谢有影响的药物服用史;(3)继发性肥胖;(4)主要器官功能严重异常;(5)精神疾病、依从性差、不同意参加本研究。
1.3 治疗方法
1.3.1 术前准备 检测患者身高、体重,计算BMI,询问病史与基本信息并详细记录。检测生化、血脂、血糖、胰岛素释放、C肽水平,完善腹部B超、胃镜、肾上腺CT、垂体磁共振成像等常规检查,请心内科、呼吸科、内分泌科、临床心理科、营养科及麻醉科等相关科室会诊协助评估病情,明确手术指征、排除手术禁忌。准备超声刀、切割闭合器、支撑胃管及相关手术器械并检查其清洁性、可操作性。
1.3.2 手术步骤 全身麻醉后,患者取“大”字位,采用四孔法置入腹腔镜、超声刀、无创抓钳。自制“7”形粗铁丝肝叶牵开器,经剑突下3 mm皮肤切口置入,头端覆盖乳胶管,悬吊拉动肝左叶。距幽门约4 cm处用超声刀切断胃结肠韧带、胃脾韧带、胃底短血管,使大网膜、脂肪组织与胃大弯、胃底、胃后壁分离,见图1。如探查见贲门滑入食管裂孔内,则游离食管贲门右侧,使腹段食管上方周围完全游离,并使两侧膈肌脚充分显露,将食管下移复位,于食管前方两侧膈肌脚用2号无损伤不可吸收线间断缝合2针。行保留小部分胃底的胃大弯侧袖状切除术。胃镜或36F胃管引导至靠近胃小弯侧的位置,距幽门约3 cm至胃底1 cm处,即位于贲门His角左侧,用切割闭合装置沿胃大弯切断大部分胃大弯侧、胃底,见图2,使剩余的胃小囊呈“香蕉状”,见图3。残胃缘及分离的大网膜用可吸收线连续缝合固定,防止出血与渗漏,见图4。切除的胃标本置入标本袋后由扩大的右锁骨中线切口取出,送病理检查。术区进行冲洗。胃边缘后放置一根橡胶引流管,手术完成。
1.3.3 术后饮食指导 严密监护患者的生命体征,一般情况下,于术后第2天,肛门排气后取下鼻胃管,开始适当予以无糖、无咖啡因、低热量或无热量的清淡流食,每15 min进一次清淡流食,每日摄入水分量建议≥2 000 mL。术后3周至3个月予以低糖、低脂、无咖啡因半流质及软性食物,每次总量不宜超过80~100 mL,同时注意补充足量的维生素与微量元素,切记避免碳酸饮料、含高热量饮料(红酒、可乐等)。术后3个月开始逐渐添加固体食物,直至恢复正常进食,注意进食低糖、低脂及富含蛋白质的食物,并坚持少量多餐、细嚼慢咽的进食习惯。
1.4 随访及观察指标 采取住院复查的方法进行随访,术后1、3、6、12个月复查患者体重及代谢相关指标的变化,包括体重、BMI、额外体重减少百分比(percentage of excess weight loss,EWL%)、腰围、臀围,血压、糖化血红蛋白(glycated hemoglobin A1c,HbA1c)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、血尿酸(serum uric acid,SUA)等;EWL%=[体重下降值/(术前体重-标准体重)]×100%),标准体重按男(身高-80)×70%、女(身高-70)×60%计算;观察患者术前合并症的改善和(或)治愈情况,胃食管反流病症状评价采用相关调查问卷。随访截至2020年5月。

图1 分离网膜 图2 用切割闭合装置切割
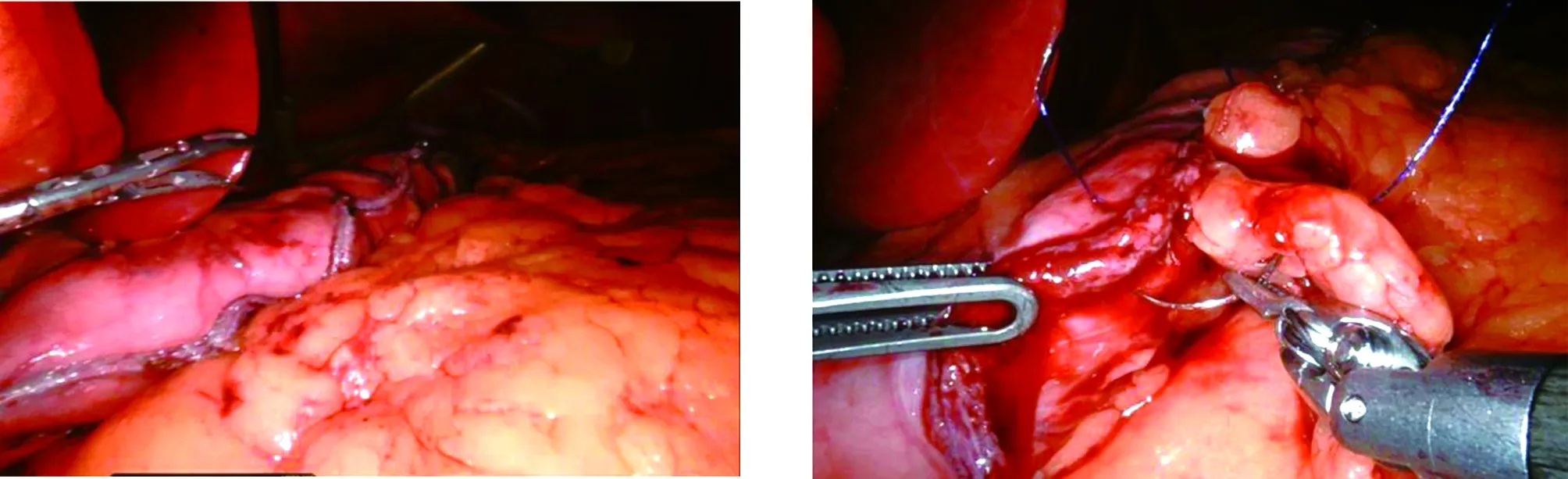
图3 “香蕉状”残余胃 图4 残胃缘与分离大网膜缝合
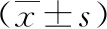
2 结 果
2.1 一般情况 66例超级肥胖患者均成功完成LSG,13例合并胆囊结石于LSG术中联合行胆囊切除术;9例食管裂孔疝患者接受LSG联合食管裂孔疝修补术。手术时间90~240 min,平均(140.87±39.88)min,术中出血50~200 mL,平均(91.30±35.46)mL,无中转开腹、术后死亡及其他严重并发症发生。患者均顺利康复,术后住院8~17 d,平均(11.35±2.92)d。患者均接受术后营养、饮食指导,并完成术后12个月的定期随访。
2.2 物理指标的变化情况 LSG术后1、3、6、12个月患者体重、BMI、腰围、臀围均低于术前,且随时间呈不断降低趋势,EWL%随时间呈升高趋势,差异有统计学意义(P<0.05),见表1。
表1 超级肥胖症患者术后物理指标的变化情况
2.3 代谢指标变化情况 术后1、3、6、12个月,患者HbA1c、TC、LDL-C随时间呈不断降低趋势(P<0.05);患者SUA于术后1个月较术前升高后逐渐下降(P<0.05);TG、HDL-C于术后1个月较术前无明显变化,但随后逐渐变化,术后3个月、6个月均有所改变,尤其术后12个月TG较术前下降(P<0.05);术后12个月,HDL-C较术前升高(P<0.05),见表2。
表2 超级肥胖症患者术后代谢指标的变化情况
2.4 合并症的改善和(或)治愈情况 术后12个月,高血压、2型糖尿病、高甘油三酯血症、高胆固醇血症、阻塞性睡眠呼吸暂停综合征、高尿酸血症、胃食管反流病等合并症相关指标均显著改善或治愈,见表3。
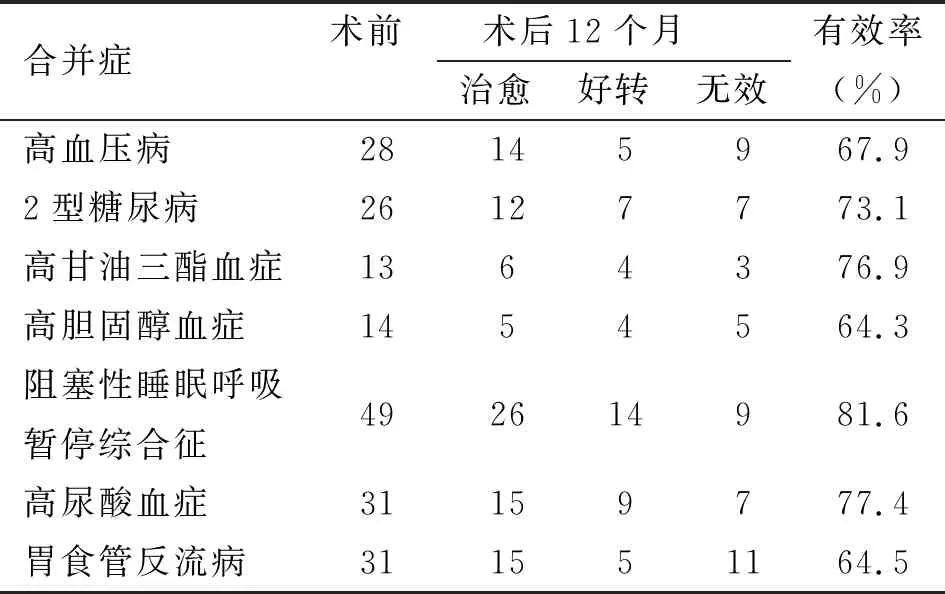
表3 超级肥胖症患者相关合并症的改善和(或)治愈情况(n)
3 讨 论
肥胖以体内脂肪细胞的数量与体积过度增加、体脂占体重的百分比异常增高、体脂在体内某些部位过多沉积为特点,可引起体内动态平衡的破坏与组织生化、生理功能的障碍,从而导致高血压、2型糖尿病、血管硬化、非酒精性脂肪肝病、高脂血症、泌尿系疾病、阻塞性睡眠呼吸暂停、肿瘤等合并症的发生[8-10]。近年,LSG以操作简单、对生理结构损伤小、安全性高、疗效显著等优点逐渐成为流行的减肥方法。LSG的减肥机制不仅与其限制作用(减少胃容积)有关,还与激素、代谢相关细胞因子水平的变化有关[11-13],如LSG术后饥饿素、瘦素等激素水平大幅下降,胰高血糖素样肽-1、酪酪肽等激素水平升高[14]。LSG最初被提议作为高危患者包括超级肥胖患者分期手术的一部分,以减少并发症、病死率[15]。而随着LSG的普遍应用,国外诸多专家发现,对于超级肥胖症的治疗,仅LSG的一期手术即可达到所需的治疗效果[16-17],然而,超级肥胖患者由于心肺功能较差、腹腔脂肪堆积影响操作,行LSG技术难度较高。因此,需术前多学科联合评估患者围手术期风险、严格指导改变饮食习惯并控制热量摄入、术中使用加长器械等,以降低手术难度。
本研究中,术后12个月时,患者BMI由术前的(53.53±3.82)kg/m2降至(30.89±2.10)kg/m2,体重由(151.70±13.98)kg降至(86.44±5.50)kg,差异均有统计学意义(P<0.05);患者腰围与臀围于术后1、3、6、12个月均呈逐渐下降趋势,这与国外学者的报道一致[18]。Hong等[19]发现,超级肥胖患者LSG术后12个月的EWL%为(59.7±26.3)%;本研究中EWL%呈逐步升高趋势,术后12个月时为(65.58±10.09)%,笔者认为这可能与本中心术后合理的营养、运动管理,对患者的严格随访与指导密切相关。此前Zhang等[20]发现,LSG可使肥胖患者血脂水平得到显著改善;本研究中,术后TC、LDL-C逐渐下降,并于术后12个月时分别降至(3.98±0.64)mmol/L、(2.02±0.43)mmol/L,这与既往研究结果基本一致;TG与HDL-C于术后1个月时较术前无明显变化,但随后逐渐变化,TG于术后12个月降至(1.13±0.26)mmol/L,HDL-C升高至(1.38±0.29)mmol/L;术前合并高甘油三酯血症、高胆固醇血症的患者,术后改善和(或)治愈有效率分别为76.9%与64.3%。此外,笔者还关注了手术前后患者的糖化血红蛋白的变化情况,发现于术后逐渐下降,26例术前合并2型糖尿病的患者,术后1年改善和(或)治愈有效率为73.1%。术后6、12个月时,SUA水平低于术前,31例高尿酸血症患者,LSG术后1年的改善和(或)治愈有效率为77.4%,与以往的研究一致[21]。有趣的是,我们发现术后1个月患者SUA水平高于术前。笔者认为,这种现象与以下因素有关:(1)由于手术、麻醉的影响,患者的肾功能暂时受到影响,导致肾小管分泌受到抑制,肾小球滤过率降低,肾小管重吸收增加,导致尿酸排泄减少;(2)由于术后胃容积明显减少,饮水不足,体内尿酸未被稀释;(3)术后患者未充分注意从全流质清淡饮食到正常饮食的缓慢转变,并且过早食用高嘌呤食物。Pallati等[22]发现,LSG术后6个月时,41%的肥胖合并胃食管反流病患者反流症状明显缓解。本研究中,我们通过术前完善胃食管反流病调查问卷、上消化道造影、上消化道内窥镜、食管测压、24 h食管pH值监测等,严格筛出术前合并食管裂孔疝与胃食管反流病的患者,术中仔细检查是否存在食管裂孔疝。如果发现,立即修复,同时保留部分胃底与一定的His角起抗反流作用。笔者的经验是,切割胃底时,与胃角左侧保持1 cm的距离,缝合切割线时尽量保持胃的形状、角度不变。残胃缘加固并与大网膜缝合固定,不易移动。此外,术后应积极指导患者养成健康饮食的习惯,并建议口服胃黏膜保护药物、抑酸药物以保护创面、预防残胃溃疡。Graham等[23]的研究显示,肥胖合并高血压患者LSG术后在平均5.35年的随访中,62.17%的患者高血压得到缓解;本研究中,LSG对超级肥胖患者高血压病的有效率为67.9%;肥胖是导致阻塞性睡眠呼吸暂停综合征的重要因素[24],超级肥胖更是如此,本研究中49例患者术前合并阻塞性睡眠呼吸暂停综合征,LSG术后得到显著改善,12个月时有效率达81.6%。
综上所述,LSG可有效减轻超级肥胖患者的体重,显著改善其糖脂代谢水平及高血压病、2型糖尿病、高甘油三酯血症、高胆固醇血症、阻塞性睡眠呼吸暂停综合征、高尿酸血症、胃食管反流病等合并症。然而,由于本研究为单中心研究,样本量相对较小,随访时间相对较短,因此可能无法真实反映LSG对超肥胖患者体重与代谢的长期疗效。因此,仍有必要在多中心、大样本、长期观察队列研究中进一步验证其安全性及长期有效性。

