离子反应选择题的考查形式与备考对策
张 峻
(河北省沧州渤海新区中捷产业园区高级中学)
以元素及其化合物知识为载体的离子反应是高中化学的重点和难点,离子共存、离子反应方程式的判断和书写是高考选择题的必考题型,本文例析2021年高考中常见的有关离子反应的考查形式与备考对策,希望能使我们的复习更为有效.
1 离子方程式的正误判断与分析
例1(2021年广东卷)宏观辨识与微观探析是化学学科核心素养之一.下列物质性质实验对应的反应方程式书写正确的是( ).


Na2O2与水反应的化学方程式应该是2Na2O2+2H2O=4NaOH+O2↑,选项A中氧元素不守恒,错误.H2O(g)通过灼热铁粉应生成Fe3O4和H2,选项B错误.铜丝插入热的浓硫酸中生成的气体不是H2,应是SO2,选项C 错误.SO2通入酸性KMnO4溶液中,SO2被氧化为被SO2还原为Mn2+,再根据得失电子守恒、电荷守恒和元素守恒可得离子方程式为5SO2+2H2O++4H++2Mn2+,选项D 正确.答案为D.
备考对策明确离子方程式常见的错误类型.
1)违背反应事实,臆造离子方程式.如过量的氨水加入AlCl3溶液中,错写成Al3++4NH3·H2O=
2)拆分错误.如氯气溶于水,错写成Cl2+H2O=2H++Cl-+ClO-.
3)违背电荷守恒或原子守恒等守恒关系.如Cu溶于FeCl3溶液,错写成Cu+Fe3+=Cu2++Fe2+;过氧化钠加水,错写成Na2O2+H2O=2Na++2OH-+O2↑.
4)漏写部分参与反应的离子.如向(NH4)2SO4溶液中加入Ba(OH)2溶液因忽视了OH-与反应而写成Ba2++=BaSO4↓.
5)忽视发生的氧化还原反应.忽视氧化还原反应是离子方程式的常见出错形式,当离子方程式中涉及HNO3、Na2O2、ClO-等强氧化性物质或离子与SO2、、I-、Fe2+等强还原性物质或离子时要特别引起注意.如向次氯酸钙溶液中通入SO2,错写成Ca2++2ClO-+SO2+H2O=2HClO+CaSO3↓.
变式(2021年湖北卷)对于下列实验,不能正确描述其反应的离子方程式是( ).


向氢氧化钡溶液中加入盐酸,反应方程式为Ba(OH)2+2HCl=BaCl2+2H2O,离子方程式为H++OH-=H2O,选项A 正确.向硝酸银溶液中滴加少量碘化钾溶液,反应方程式为AgNO3+KI=AgI↓+KNO3,离子方程式为Ag++I-=AgI↓,选项B正确.向烧碱溶液中加入一小段铝片,反应的方程式为2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑,离子方程式 为2Al+2OH-+6H2O =2[Al(OH)4]-+3H2↑,选项C 正确.向次氯酸钙溶液中通入少量CO2气体发生反应生成CaCO3和HClO,离子方程式为Ca2++2ClO-+CO2+H2O=2HClO+CaCO3↓,选项D 错误.答案为D.
2 离子能否大量共存的判断与分析
例2(2021年福建卷)室温下,下列各组离子一定能与指定溶液共存的是( ).
A.0.2 mol·L-1的NH4Cl 溶 液:Na+、K+、
B.0.1 mol·L-1的FeCl3溶 液:、Ca2+、Br-、SCN
C.0.2 mol·L-1的H2SO4溶液:Mg2+、Fe2+、、Cl-
D.0.1mol·L-1的Ba(OH)2溶液:Na+、K+、Cl-、ClO-

NH4Cl是强酸弱碱盐,0.2 mol·L-1的NH4Cl溶液显酸性,H+与生成硅酸沉淀不能大量共存,选项A 不符合题意.0.1 mol·L-1的FeCl3溶液中,Fe3+与SCN-生成Fe(SCN)3不能大量共存,选项B 不符合题意.0.2 mol·L-1的H2SO4溶液,H+、Fe2+、共同作用发生氧化还原反应,不能大量共存,选项C 不符合题意.0.1mol·L-1的Ba(OH)2溶液,Ba2+、OH-、Na+、K+、Cl-、ClO-能大量共存,选项D 符合题意.答案为D.
备考对策熟记常见的离子不能大量共存的类型(如表1).

表1
变式1(2021年天津卷)常温下,下列各组离子在给定溶液中能大量共存的是( ).


变式2(2021年湖南卷)对下列粒子组在溶液中能否大量共存的判断和分析均正确的是( ).__
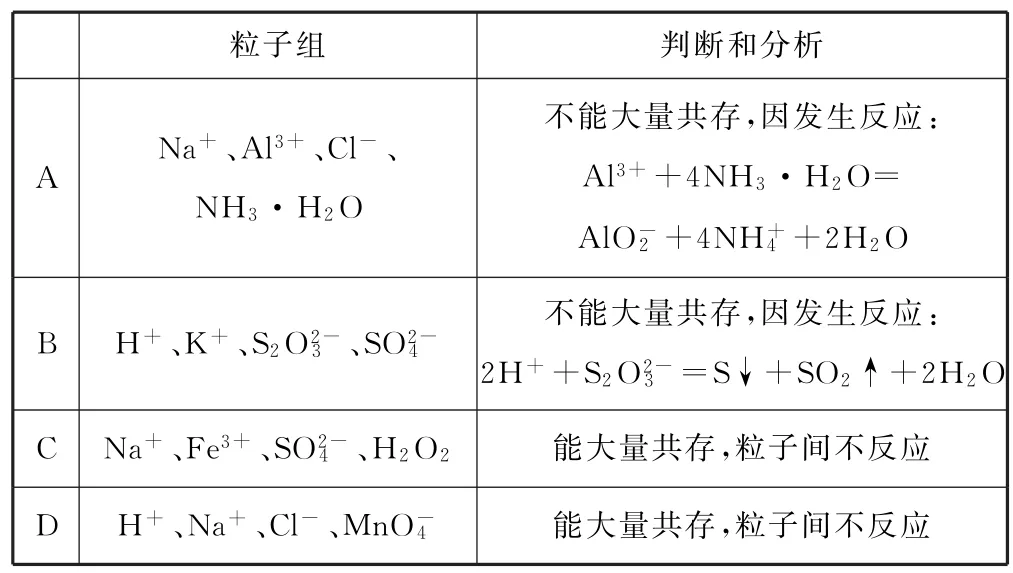

综上所述,针对高考化学选择题中的离子共存、离子方程式的判断等离子反应的考查形式,只要强化元素及化合物、氧化还原反应等基础知识,掌握基本技能、明晰常见陷阱,就一定能提高该类试题的解题准确率.
(完)

