用“交点”打开分布系数曲线图
茆建军
(江苏省滨海中学)
近几年,全国及各地自主命题省份高考试题经常出现分布系数曲线图(由物质的量分数δ(X)到的分布分数δ再到A2-的分布系数),通常考查电解质溶液中粒子成分及其量的关系,以及离子电离程度和水解程度的大小,不仅让考生感到很棘手,也让不少教师感到难以讲透,其原因是这类试题在中学知识内容基础上进行了一定拓展,其考查方式也较多.
1 思维模型认知——用好“交点”
1.1 分布系数与分布系数曲线的定义
分布系数一般是指达到平衡时溶液中某种粒子的浓度占总浓度的分数,也叫分布分数.用δ表示:,各种粒子的分布系数之和为1.
当溶液的pH 发生变化时,平衡随之移动,溶液中存在的各种形式的粒子分布情况也发生变化.分布系数δ与溶液pH 间的关系曲线称为分布系数曲线.以一元弱酸醋酸为例,图1 为CH3COOH 的分布系数曲线图.

图1
对于总浓度为c的CH3COOH 溶液,溶液中与CH3COOH 相关的只有CH3COOH 和CH3COO-2种粒子,则c=c(CH3COOH)+c(CH3COO-),δ(CH3COOH)+δ(CH3COO-)=1.δ1随着pH 的升高而增大,δ0随着pH 的升高而减小,则δ0曲线对应的粒子是CH3COOH,δ1曲线对应的粒子是CH3COO-.
1.2 分布系数曲线图中交点的含义及关键作用
由图1可看出:图中曲线的交点,δ0和δ1相等,则说明CH3COOH 和CH3COO-浓度相等.
关键点1:利用交点的横坐标值(通常是pH)可以计算电离常数Ka或pKa(电离常数的负对数).推导过程如下.图中交点对应的pH=4.76,对于反应

当c(CH3COO-)=c(CH3COOH)时,Ka=c(H+)=10-pH=10-4.76,所以,pKa=pH=4.76.
关键点2:由电离常数Ka(或pKa)可计算水解常数Kh,推导过程如下.对于反应

由①②式可得出:Ka×Kh=Kw.

关键点3:由Ka和Kh的相对大小进而可以判断c(CH3COOH)∶c(CH3COO-)=1∶1时溶液的酸碱性,以及比较溶液中粒子浓度的大小关系或等量关系.
图2为二元弱酸H2C2O4的分布系数曲线.

图2

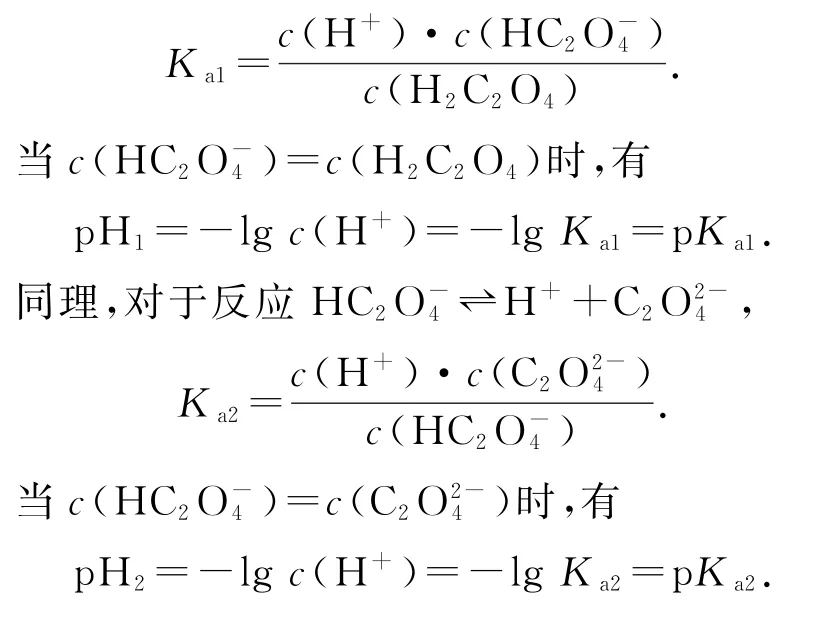
2 思维模型的应用
2.1 一元弱酸
例1(2017年浙江卷)25℃时,在含CH3COOH和CH3COO-的溶液中,CH3COOH 和CH3COO-二者中各自所占的物质的量分数(α)随溶液pH 变化的关系如图3所示.下列说法不正确的是( ).

图3
A.在pH<4.76的溶液 中,c(CH3COO-)<c(CH3COOH)
B.在pH=7 的溶液中,α(CH3COOH)=0,α(CH3COO-)=1.0
C.在pH>4.76的溶液中,c(CH3COO-)与c(OH-)之和大于c(H+)
D.在 pH =4.76的溶液中加盐酸,α(CH3COOH)与α(CH3COO-)之和保持不变

根据图中交点,当溶液的pH =4.76 时,c(CH3COOH)=c(CH3COO-),pH 越小,CH3COOH的比例越高,所以当pH <4.76 时,c(CH3COOH)>c(CH3COO-),选项A 说法正确.溶液中CH3COO-因水解而呈碱性,pH=7的溶液呈中性,说明是CH3COOH 和CH3COO-的混合溶液,α(CH3COOH)>0,α(CH3COO-)<1.0,选项B 说法错误.假设溶液中另一阳离子为R+,由电荷守恒有:c(R+)+c(H+)=c(CH3COO-)+c(OH-),则有c(H+)<c(CH3COO-)+c(OH-),选项C 说法正确.当溶液pH =4.76 时,c(CH3COO-)=c(CH3COOH),加入盐酸或碱,溶液中α(CH3COOH)+α(CH3COO-)=1 始终保持不变,选项D 说法正确.答案为B.
类比25 ℃时,往HA 溶液中滴加NaOH 溶液,溶液中HA 和A-二者中各自所占的物质的量分数(α)随溶液pH 变化的关系如图4 所示.下列说法正确的是( ).

图4
A.在pH=5.0 的溶液中,c(A-)=c(HA),c(OH-)=c(H+)
B.pH=7的溶液中,α(HA)=0,α(A-)=1.0
C.25 ℃时,Ka(HA)=1×10-5
D.pH=5.0时,溶液中水电离产生的c(H+)=1×10-5mol·L-1
答案C.
2.2 二元弱酸(一元弱酸的拼接)
例2常温下,0.1mol·L-1的H2C2O4溶液中H2C2O4、三者所占物质的量分数(分布系数)随pH 变化的关系如图5所示.下列表述不正确的是( ).


图5


类比(2017年全国Ⅱ卷)改变0.1mol·L-1二元弱酸H2A 溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH 的变化如图6所示[已知δ(X)=.下列叙述错误的是( ).

图6
A.pH=1.2时,c(H2A)+c(HA-)
B.lg[K2(H2A)]=-4.2
C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D.pH=4.2时,c(HA-)=c(A2-)+c(H+)
答案D.
2.3 三元弱酸(一元弱酸的两次拼接)
例3常温下,H3PO4与NaOH 溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图7所示[已知Ca3(PO4)2难溶于水].下列有关说法不正确的是( ).

图7
A.H3PO4的Ka3=10-12.2,的水解平衡常数为10-6.8
B.Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性
C.为获得尽可能纯的NaH2PO4,pH 应控制在4~5.5
D.pH=13 时,溶液中各微粒浓度大小关系为c(Na+)>)>c(OH-)>c(H+)


图8
答案C、D.
2.4 一元弱碱(一元弱酸迁移)
例4常温下,向100mL0.2mol·L-1氨水中逐滴加入0.2mol·L-1盐酸,所得溶液的pH、和NH3·H2O 的物质的量分数φ与加入盐酸的体积V的关系如图9所示,下列说法错误的是( ).

图9
A.表示NH3·H2O 物质的量分数变化的曲线是M
B.NH3·H2O 的电离常数为10-4.74mol·L-1
C.当加入盐酸体积为50mL时,溶液中



2.5 二元弱碱(一元弱碱的拼接)
例5室温下,某二元碱X(OH)2水溶液中相关组分的物质的量分数随溶液pH 变化的曲线如图10所示,下列说法不正确的是( ).

图10
A.Kb2的数量级为10-8
B.X(OH)NO3水溶液显碱性
C.等物质的量的X(NO3)2和X(OH)NO3混合溶液中:c(X2+)<c[X(OH)+]
D.在X(OH)NO3水溶液中:c[X(OH)2]+c(OH-)=2c(X2+)+c(H+)


选项D 错误.答案为D.
3 思维模型构建与完善
关键点:用分布系数图中的交点求Ka1、Ka2及pH.
例如,H2A为二元弱酸.20 ℃时,配制一组c(H2A)+c(HA-)+c(A2-)=0.100 mol·L-1的H2A 和NaOH 的混合溶液,溶液中部分微粒的物质的量浓度随pH 的变化曲线如图11所示.

图11
例6(2020 年全国Ⅰ卷)以酚酞为指示剂,用0.1000mol·L-1的NaOH 溶液滴定20.00 mL 未知浓度的二元酸H2A 溶液.溶液中,pH、分布系数δ随滴加NaOH 溶液体积V(NaOH)的变化关系如图12 所示.[比如A2-的分布系数:δ(A2-)=

图12
下列叙述正确的是( ).
A.曲线①代表δ(H2A),曲线②代表δ(HA-)
B.H2A 溶液的浓度为0.2000mol·L-1
C.HA-的电离常数Ka2=1.0×10-2
D.滴定终点时,溶液中c(Na+)<2c(A2-)+c(HA-)

曲线①代表的粒子的分布系数随NaOH 溶液的滴入逐渐减小,曲线②代表的粒子的分布系数随NaOH 溶液的滴入逐渐增大,粒子的分布系数只有1个交点,没有加入NaOH 时,pH 约为1,说明H2A 第一步完全电离,第二步部分电离,曲线①代表δ(HA-),曲线②代表δ(A2-),选项A 错误.当加入40mLNaOH 溶液时,溶液的pH 发生突变,且曲线②代表的粒子的分布系数达到最大值接近1,说明恰好完全反应,根据反应2NaOH+H2A=Na2A+2H2O,c(H2A)=0.1000mol·L-1,选项B 错误.根据曲线中的交点,当δ(HA-)=δ(A2-)时溶液的pH=2,则HA-的电离平衡常数Ka==c(H+)=1×10-2,选项C 正确.用酚酞作指示剂,酚酞变色的pH 范围为8.2~10,终点时溶液呈碱性,c(OH-)>c(H+),溶液中的电荷守恒为c(Na+)+c(H+)=2c(A2-)+c(HA-)+c(OH-),则c(Na+)>2c(A2-)+c(HA-),选项D 错误.答案为C.
通过思维模型的构建,形成具体的解题策略,用好“交点”可以快速打开分布系数曲线图,尝试运用模型解决问题,并完善解决高阶问题思维模型的构建:弄清图像→寻找交点→计算常数→守恒推理.
(完)

