基于径向基人工神经网络遗传算法的长寿老人源益生菌微胶囊工艺探索及其特性测评
李锐定,王文萱,张雨荷,周 樊,郑文轩,张钦任,孟 宁,时凤翠,李全阳
(广西大学轻工与食品工程学院,广西南宁 530004)
联合国粮食及农业协会(FAO)以及世界卫生组织(WHO)将益生菌定义为在适量条件下可以对宿主健康有益的活体微生物[1]。它们可以通过改善肠道微生态系统间接参与代谢、免疫反应以及疾病,从而影响人体健康[2]。乳杆菌属作为一类益生菌在人体肠道中广泛分布[3],研究表明,乳杆菌属中的发酵乳杆菌具有降解胆固醇、抗氧化以及抑制病原体的功效[4-5]。同时,乳杆菌属作为长寿老人的优势菌群[6-7],也开始受到人们的广泛关注。长寿老人源乳杆菌已经被证明了具有延缓衰老[8]、抑制基因毒性[9]、调节炎症健康[10]以及改善免疫调节[11]等功效,说明长寿老人源乳杆菌具有良好的潜在开发价值。
发酵乳杆菌LTP1332 是本课题组从广西巴马长寿老人粪便筛选分离得到的一株优良肠道益生菌,体外实验已经证明了其具有良好的益生性能[12]。兰海静等[13]和黄燕婷等[14]等将发酵乳杆菌LTP1332添加至小鼠优化饲料中喂养衰老小鼠,使小鼠的运动协调能力和学习记忆能力等得到明显改善。以上研究结果说明了发酵乳杆菌LTP1332 有良好的益生特性,具有开发成益生菌产品的潜力。
由于益生菌在储存以及肠道运输过程中的活性明显降低,因此可能无法实现自身潜在的益生特性[15-16]。微胶囊化作为一种新型的保护技术,可以增强益生菌抵御不良环境的能力,保证益生菌顺利到达肠道定殖并更好地发挥自身益生特性[17-18]。选择合适的壁材是微胶囊包埋技术的关键,由于用海藻酸盐与Ca2+交联制备凝胶具有无毒、成本低、操作简单等特点[15],使得海藻酸盐也成为了目前最广泛使用的益生菌微胶囊凝胶壁材[19]。然而,单一的海藻酸盐凝胶体系通常具有较强的半透性,这使得当酸性过低或者Ca2+过量时,形成的凝胶会发生一定的降解甚至崩塌[20]。将海藻酸盐与其他材料复合可以有效克服这种困难,从而提高胶囊的护菌效果[21-23]。在食品工业中应用较多的益生菌微胶囊化方法有三种:挤压法[24-25]、乳化法[16,26]和喷雾干燥法[27-29]。挤压法相比于另外两种方法,它具有对设备材料要求不高、胶囊大小均匀成球以及菌体包埋率高的特点[30]。选择合适的工艺条件可以更好地增加微胶囊对益生菌的包埋率[31],但包埋率和微胶囊的工艺条件之间存在着一种非线性关系,所以使用传统的回归模型优化,可能效果不佳。人工神经网络对输入、输出样本进行反复训练学习后,可以有效逼近任意复杂的非线性函数,所以在针对非线性系统的建模、预测问题上受到了许多研究者的关注[32-34]。将径向基函数人工神经网络与遗传算法相结合可以通过自然选择和群体遗传机理,对复杂性形态的非线性函数进行全局优化,这也正适合用来解决益生菌微胶囊工艺条件探索的问题。
为此,本研究以广西巴马百岁老人粪便样品中分离筛选鉴定的发酵乳杆菌LTP1332 为试验菌种。采用挤压法制备益生菌微胶囊,选择海藻酸钠、明胶作为复合壁材,并通过壳聚糖进行二次包埋。利用RBF-GA 模型探究了发酵乳杆菌LTP1332 微胶囊的最佳制备工艺。最后分析微胶囊的形态结构、胃液耐受性以及肠液释放性等特性,以此来测评微胶囊化对发酵乳杆菌LTP1332 的护菌效果。以期能为发酵乳杆菌LTP1332 在食品工业上的应用提供技术支撑,也为益生菌微胶囊产品的开发提供理论依据。
1 材料与方法
1.1 材料与仪器
发酵乳杆菌LTP1332(Lactobacillus fermentum,LTP1332)由本团队分离筛选自广西巴马瑶族自治县健康百岁老人的粪便,已保藏于中国典型培养物保藏中心(保藏号:CCTCC M 2019029);海藻酸钠、壳聚糖、蔗糖 上海源叶生物科技有限公司;海藻糖河南万邦化工科技有限公司;胰蛋白酶(1:250)、胃蛋白酶(1:10000)美国Sigma 公司;明胶 成都金山化学试剂有限公司;无水氯化钙 国药集团化学试剂有限公司;乙二胺四乙酸二钠 天津市凯通化学试剂有限公司;其它试剂 均为国产分析纯试剂。
GR85DP 立式自动压力蒸汽灭菌锅 致微(厦门)仪器有限公司;DHP-9272D 电热恒温培养箱 上海齐欣科学仪器有限公司;ZWYR-240 恒温培养振荡箱 上海智城分析仪器制造有限公司;AC2-4S1生物安全柜 新加坡艺思高;ME104/02 分析天平梅特勒-托利多仪器(上海)有限公司;日立S-3400N型扫描电镜 日本日立电子有限公司。
1.2 实验方法
1.2.1 菌种活化及菌悬液的制备 将发酵乳杆菌LTP1332 接种于MRS 液体培养基中,37 ℃恒温振荡培养24 h 后,进行活化传代。将扩大培养的发酵乳杆菌LTP1332 通过离心(4500 ×g,4 ℃,15 min)获取菌泥[35],弃去上清液后,将菌泥沉淀重悬于20 mL NaCl 溶液(8.5 g/L)并在相同条件下再次离心。然后将洗涤的菌泥重新悬浮在NaCl 溶液中以获得活菌数约为108CFU/mL 菌悬液。
1.2.2 微胶囊的制备
1.2.2.1 CS-SA-微胶囊 将配制好的海藻酸钠溶液,经过0.22 μm 滤膜除菌后,与制备好的菌悬液按2:1比例混合。用无菌注射器将混合液滴入无菌CaCl2固化剂中,形成微囊。用磁力搅拌器充分搅拌,使微囊,均匀成球,以无菌纱布过滤,并用无菌水冲洗胶囊表面残留的Ca2+以及未被包埋的益生菌[36]。取10.0 g过滤后的颗粒添加到90 mL 新鲜制备的壳聚糖溶液(0.1%,w/v)中[20]。磁力搅拌5 min,使颗粒均匀包裹一层壳聚糖,用无菌纱布过滤并经无菌水冲洗表面残留的Ca2+及过量壳聚糖等多余物质,即可得到湿胶囊。
1.2.2.2 CS-GEL-SA-微胶囊 将配制好已知的明胶溶液,使用磁力搅拌器搅拌悬浮1 h,经过0.22 μm孔径滤膜进行过滤后以备用[36]。将明胶、海藻酸钠、菌悬液按照1:1:1 比例混合后按照1.2.2.1 节中的方法制备湿胶囊。
1.2.3 湿胶囊真空冷冻干燥 将所得的湿胶囊平铺于培养皿中,加入适量冻干保护剂溶液(5%蔗糖、5%海藻糖),于-20 ℃预冻2 h,经真空干燥,干燥压力600 Pa,干燥时间约18 h,得到干胶囊。
1.2.4 包埋率的计算 冷冻干燥结束后,采用EDTA溶液(pH8.0)解囊,破坏胶囊结构使胶囊内包埋菌液得以释放,通过平板菌落计数法确定胶囊中包埋活菌数。微胶囊包埋率(Microencapsulation efficiency,ME,%)计算公式如下所示:
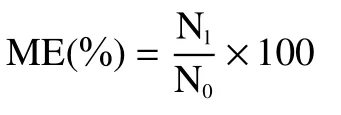
式中:ME 表示微胶囊包埋率,%;N1表示微胶囊中所含活菌数,CFU/g;N0表示未形成微胶囊前原始菌液活菌数,CFU/g。
微胶囊解囊:取0.1000±0.0020 g 微胶囊颗粒,溶解于30 mL EDTA 溶液中,于180 r/min 振荡处理5 min,待胶囊充分解囊,吸取混合液梯度倍数稀释后涂布。
1.2.5 胶囊制备工艺参数单因素的筛选 以微胶囊包埋率为参数,固定条件为:固化剂浓度3.3%、固化剂时间15 min、明胶浓度0.2%、海藻酸钠浓度2%。测定固化剂浓度(2.1%、2.7%、3.3%、3.9%、4.5%)、固化时间(5、10、15、20、25 min)、明胶浓度(0%、0.1%、0.2%、0.3%、0.4%)、海藻酸钠浓度(1%、1.5%、2%、2.5%、3%)对发酵乳杆菌LTP1332 微胶囊包埋率大小的影响,以确定单因素的最佳条件。
1.2.6 微胶囊制备工艺BBD 模型设计 基于单因素实验所得到的结果,选取固化剂浓度(A)、固化时间(B)和海藻酸钠浓度(C)为自变量,并固定明胶添加量为0.1%,发酵乳杆菌LTP1332 微胶囊的包埋率作为响应值进行BBD 模型设计,响应面因素与水平编码设计见表1。

表1 响应面因素与水平编码设计Table 1 Factors and levels used in Box-Behnken design
1.2.7 RBF 径向基函数神经网络的构建 RBF 径向基函数神经网络从输入到隐藏层的是非线性映射,从隐藏层到输出的是线性映射,可以很大程度上加快神经网络学习训练的速度并避免产生局部极小值[37],具体实现过程如图1 所示。利用BBD 模型设计中的3 个因素(固化剂浓度、固化时间、海藻酸钠)作为输入层,最终包埋率设置为输出层。选取数据集中的70%为训练集,30%为测试集,最大训练次数为100次,学习精度为10-5,学习步长为0.05[38],以此来构建RBF 人工网络模型。
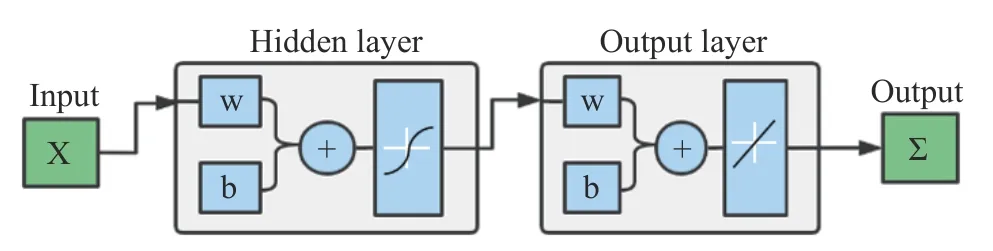
图1 RBF 神经网络实现过程Fig.1 Implementation process of RBF neural network
1.2.8 RBF-GA 模型寻优设计 将RBF 神经网络训练后的预测结果作为个体适应度值,变量的上下限对应BBD 模型设计因素的最高及最低值,设置最大递代次数为60 次、代沟为0.25、交叉概率0.8、变异概率0.01。以此来模拟生物的选择、交叉和变异等现象,寻找函数的全局最优值及对应输入值[38],RBFGA 模型寻优的基本流程图如图2 所示。
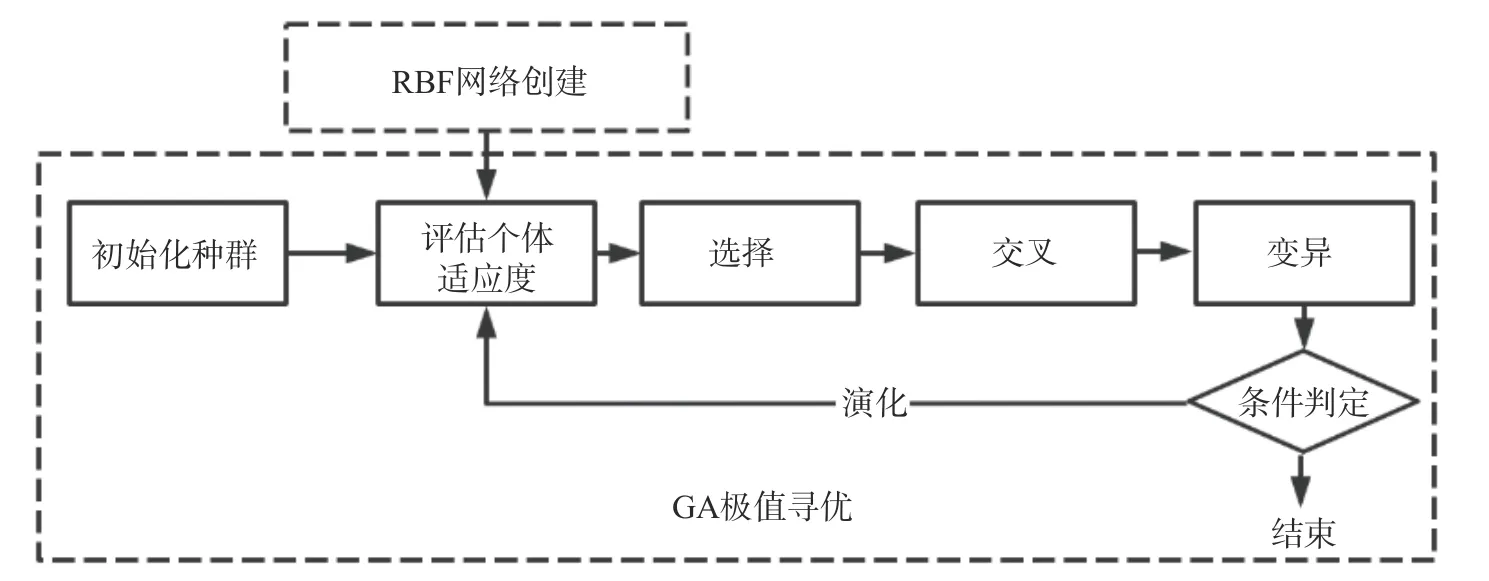
图2 RBF-GA 寻优的基本流程Fig.2 Basic flow of RBF-GA
1.2.9 BBD 与RBF-GA 模型比较 参考文献[39]中的方法,以均方根误差(Root mean square error,RMSE)、平均绝对偏差(Mean Absolute Error,MAE)和绝对系数(R2)大小作为评价预测微胶囊工艺优化模型的指标。其中RMSE 和MAE 的取值的越低,R2取值越高,则表示构建的模型越稳定,且具有一定的优势。
1.2.10 微胶囊扫描电镜(SEM)分析 用导电胶将制备好的干微胶囊平铺固定在样品台上,氧气吹去表面残留杂质后,15 mA 离子化电流喷金2 min,通过扫描电镜观察发酵乳杆菌LTP1332 微胶囊内部的结构特征。
1.2.11 微胶囊在模拟胃液中的耐受性试验 准确称取0.1000±0.0020 g 冰箱储存的干微胶囊样品,加入3 mL 人工模拟胃液(0.002 g/mL NaCl、0.0032 g/mL胃蛋白酶,用稀盐酸调整pH 为2.0,过滤除菌后以备用)[12],混匀15 s,设置摇床转速为200 r/min,振荡处理,在0、30、60、90、120 min 时,取处理液中的微胶囊,经EDTA 解囊后,梯度取适量解囊液进行稀释涂布,测定菌落数。并取0.1 mL 制备好的菌悬液,加入到3 mL 人工模拟胃液中做对照试验。
1.2.12 微胶囊在模拟肠液中的释放性试验 参考周莉[21]、石月[40]的实验方法,并稍做改进。准确称取0.1000±0.0020 g 冰箱储存的干微胶囊样品,加入3 mL 人工模拟肠液(0.0068 g/mL KH2PO4、0.01 g/mL胰蛋白酶、0.003 g/mL 胆盐,用0.4% NaOH 调pH至8.0)[12],混匀15 s,设置转速为200 r/min,摇床振荡,在30、60、90、120、150 min 时,取1 mL 混合液于离心管中,经过500 r/min 离心5 min,取上清液,稀释涂布,测定菌落数。
1.3 数据处理
试验均设置 3 次重复。利用Design-Expert V10.0.7 软件进行响应面设计;Excel 2016 软件、Graph-Pad Prism V8.0.2 软件、Origin 2019 软件进行数据分析及绘图;MATLAB R2019b 软件构建人工神经网络模型及运行遗传算法寻优。
2 结果与分析
2.1 微胶囊制备工艺单因素实验
2.1.1 固化剂浓度对微胶囊包埋率的影响 选择合适的工艺参数可以有效提高发酵乳杆菌LTP1332 微胶囊的包埋率。按照1.2.2.2 中的方法制备发酵乳杆菌LTP1332 微胶囊,由图3 可知,固化剂用量由2.2%增加到3.9%时,包埋率快速上升。随着Ca2+含量逐渐增多,整个体系能够与壁材发生交联反应的Ca2+相对减少,导致反应受到限制,无法包埋更多数量的发酵乳杆菌LTP1332,同时,局部钙离子的浓度过大,滴入的混合液很快被固化,从而导致制备的微胶囊壁材不稳定,不能更好得保护菌液,因此,在固化剂浓度3.9%时包埋率达到最大值,之后整体出现了下降的趋势。综上所述,选择固化剂浓度3.9%为最适单因素条件。
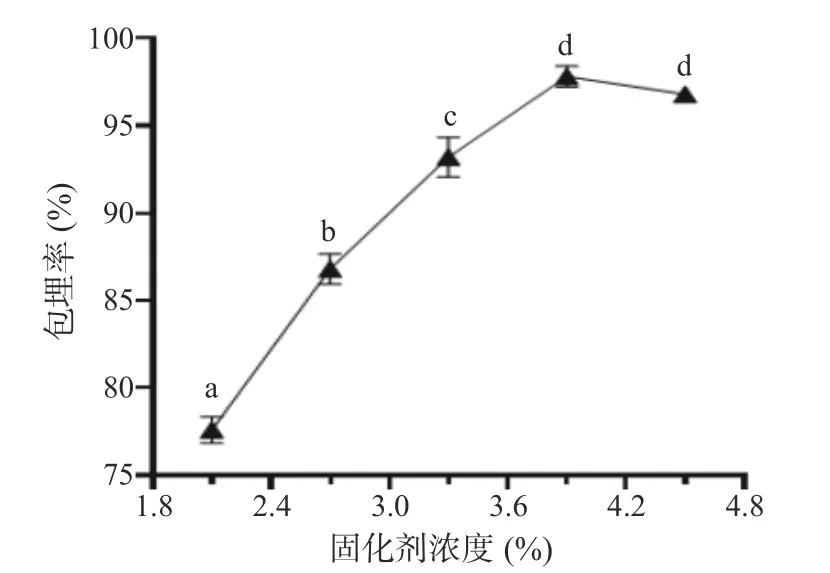
图3 固化剂浓度对LTP1332 微胶囊包埋率的影响Fig.3 Effect of curing agent concentration on the encapsulation rate of LTP1332 microcapsules
2.1.2 固化剂时间对微胶囊包埋率的影响 从图4可以看出,随着固化剂作用的时间增加,发酵乳杆菌LTP1332 微胶囊的包埋率在逐渐上升,当固化时间超过15 min 后整体呈下降趋势,此时包埋率最大可达94.8%±0.41%。壁材间交联反应达到饱和后,随着固化时间的延长会导致胶囊的脆性增加,从而导致包埋率降低[40]。因此,选择固化时间15 min 作为发酵乳杆菌LTP1332 微胶囊的最佳单因素制备条件。
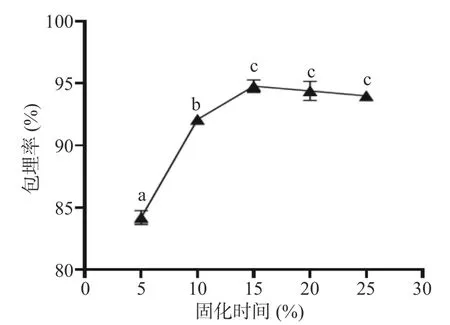
图4 固化剂时间对LTP1332 微胶囊包埋率的影响Fig.4 Effect of curing time on the encapsulation rate of LTP1332 microcapsules
2.1.3 海藻酸钠浓度对微胶囊包埋率的影响 由图5可知,海藻酸钠过低时,形成的凝胶颗粒机械强度低,在搅拌时很容易被搅散,因此不能有效地包埋菌体,导致包埋率相对较低;在海藻酸钠浓度从1%提高到2%的过程中,随着海藻酸钠溶液浓度的增加,更多的Ca2+可以与海藻酸钠相结合,导致混合液粘度增大,菌液不容易分散,微胶囊的包埋率也在逐渐增加;当浓度超过2%后,海藻酸钠与Ca2+的结合位点增多,导致海藻酸钠中ɑ-L-古洛糖醛酸(ɑ-L-guluronic,G)单元上的Na+不能够完全与Ca2+发生离子交换反应,从而不能结合成密集的网状结构[23]。因此将2%海藻酸钠作为发酵乳杆菌LTP1332 微胶囊的最佳单因素制备条件。
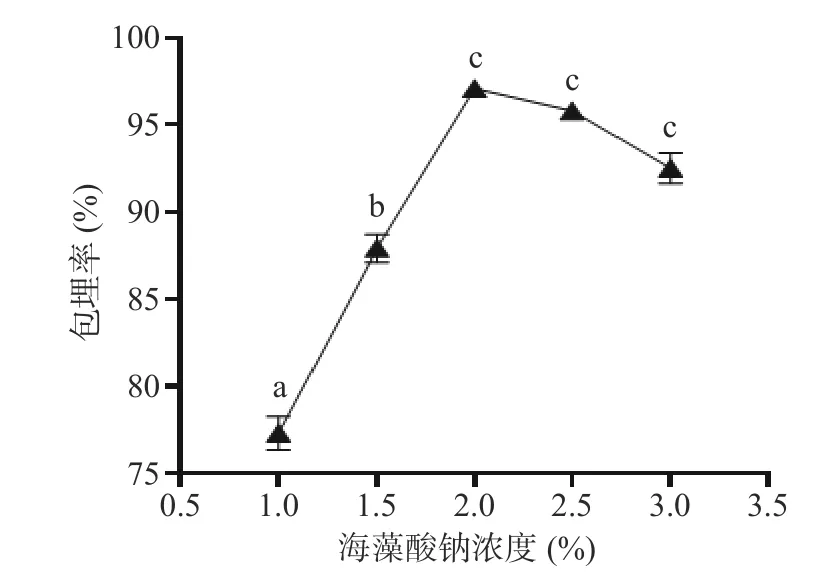
图5 海藻酸钠浓度对LTP1332 微胶囊包埋率的影响Fig.5 Effect of sodium alginate concentration on the encapsulation rate of LTP1332 microcapsules
2.1.4 明胶浓度对微胶囊包埋率的影响 由图6 可知,加入明胶后可以显著提高发酵乳杆菌LTP1332微胶囊的包埋率(P<0.01),但当明胶添加量超过0.1%后,微胶囊包埋率的变化不显著(P>0.05),因此不将其作为今后的优化条件,后续条件优化过程中固定添加0.1%的明胶。
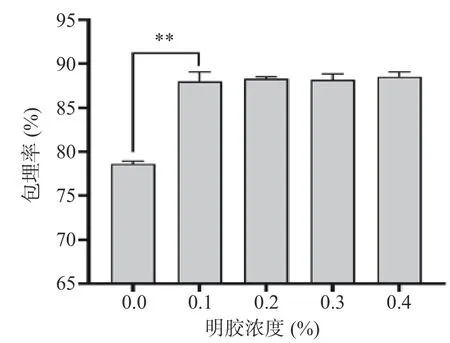
图6 明胶浓度对LTP1332 微胶囊包埋率的影响Fig.6 Effect of gelatin concentration on the encapsulation rate of LTP1332 microcapsules
2.2 微胶囊工艺BBD 模型设计
2.2.1 Box-Behnken 响应面试验 以发酵乳杆菌LTP1332 微胶囊的包埋率为响应值,按照表1 中的因素水平进行响应面试验,试验结果如表2 所示。根据表2 的结果进行多元回归拟合得到二元多项方程为:
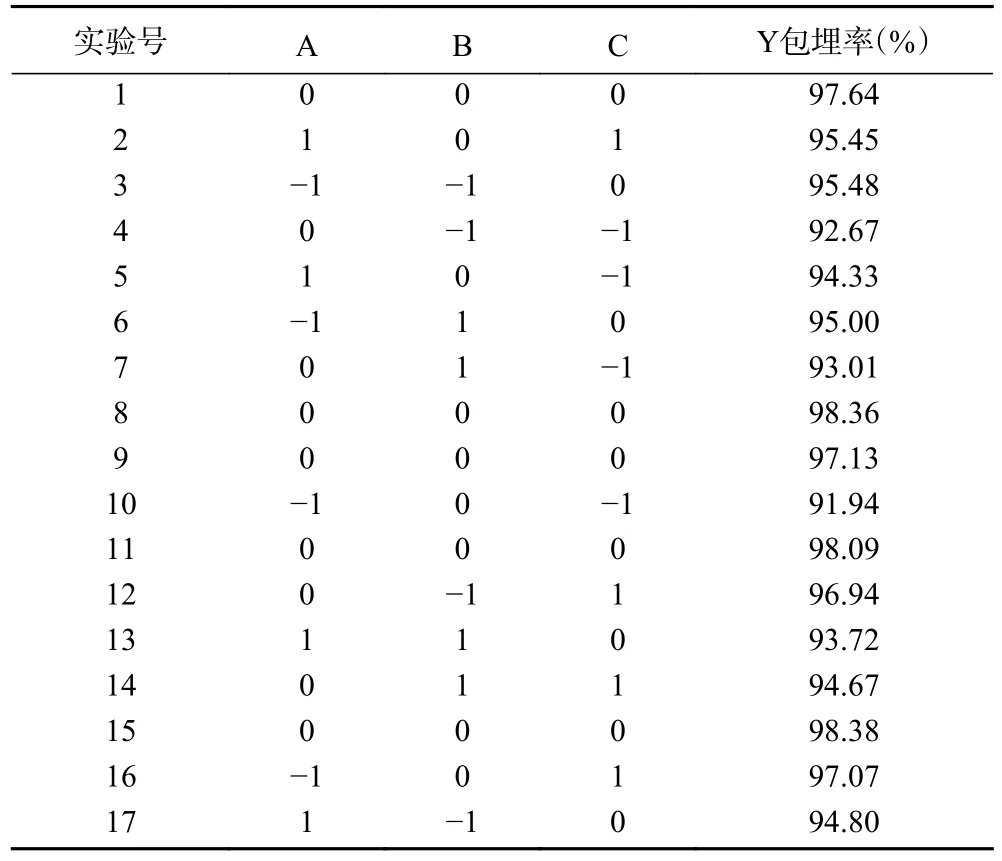
表2 响应面试验设计方案及结果Table 2 Design scheme and results of response surface test

式中:Y 表示益生菌微胶囊的包埋率,%;A 表示固化剂浓度,%;B 表示固化时间,min;C 表示海藻酸钠浓度,%。
2.2.2 方差分析 根据表3 可知,响应面模型极显著(P<0.01),失拟项不显著(P>0.05),表明了BBD 模型的试验结果和数学模型拟合良好,没有产生失拟现象,模型可用。在二元多项式的方程决定系数R2为0.9690,校正决定系数R2adj为0.9292,说明了BBD模型与试验数据以及方程的拟合度良好,所得到的二元多项式方程可靠性高。同时,交互项AC、BC,二次项A2、B2、C2对发酵乳杆菌LTP1332 微胶囊的包埋率影响显著(P<0.05),而交互项AB 表现为不显著(P>0.05),这表明了各个影响因素与微胶囊的包埋率之间存在着一种非线性关系,图7 更直观地反映了3 个影响因子对微胶囊包埋率的影响。模型中的F值可以反映出各因素对所设参数影响程度的大小,一般F值越大,因素对参数的影响程度就越大[41]。根据F值可知,对发酵乳杆菌LTP1332 微胶囊包埋率影响程度由大到小的排序为C>B>A,即海藻酸钠的浓度影响程度最大,固化剂时间其次,固化剂浓度影响程度最小。
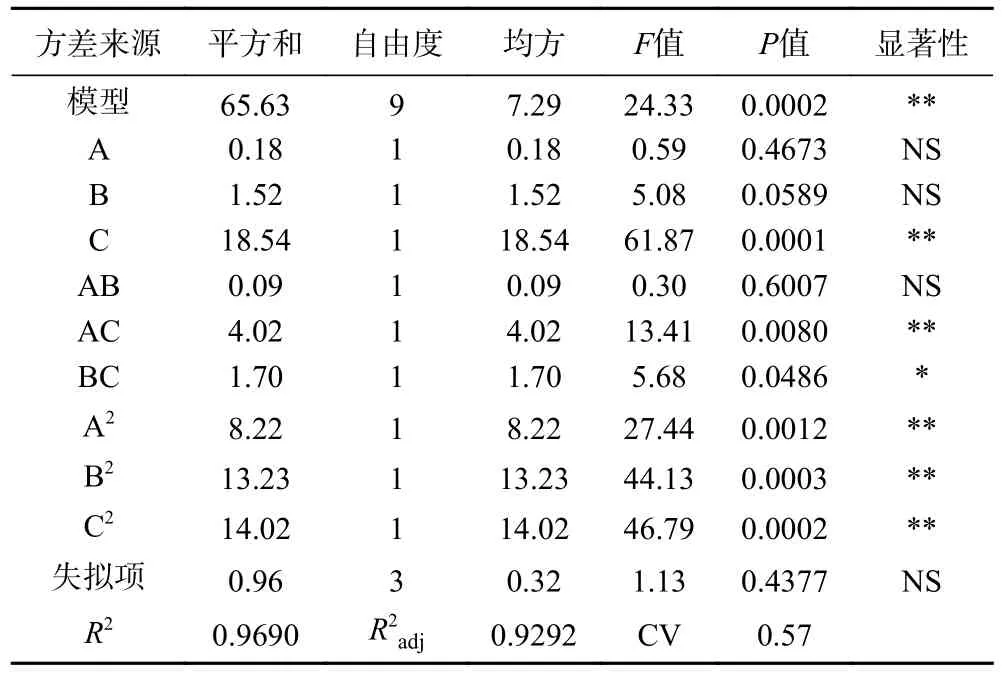
表3 以包埋率为响应值的回归模型及方差分析Table 3 Regression model and analysis of variance with embedding rate as response value
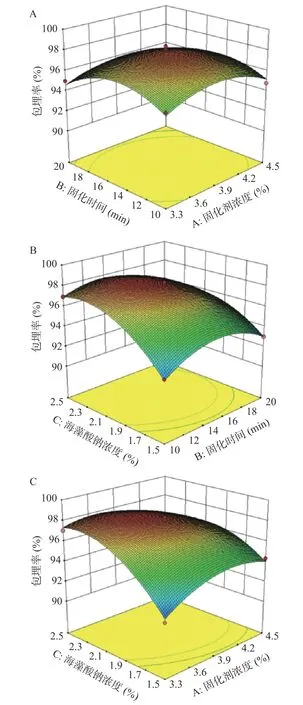
图7 各因素交互作用对包埋率的响应曲面Fig.7 Response surface of interaction of various factors to embedding rate
2.3 RBF-GA 模型预测
2.3.1 RBF 神经网络建模 RBF 神经网络具有最佳逼近和全局最优的性能,基本方式是用径向基函数构建隐藏层,将输入的低维矢量变换至高维空间内,从而可以使低维空间内线性不可分的问题在高维空间内线性可分[37]。将表2 作为RBF 人工神经网络模型的训练和测试样本数据集,该模型的训练及预测效果如图8 所示。

图8 RBF 模型的训练样本和测试样本中的实际值和预测值对比Fig.8 Comparison of actual and predicted values in training samples and test samples of RBF model
图8A 反映对训练集的训练情况,预测值和实际值的重合程度越高说明训练效果越好,本研究的训练集经过100 次以后,R2达到0.9836,说明经训练后神经网络模型的拟合度较高,可用于之后的测试。图8B 反映了测试结束后程序自动将剩余的测试集带入模型进行测试的结果,除第二个样本略微出现偏离外,整体测试趋势良好,可以用来对发酵乳杆菌LTP1332 微胶囊包埋率的后续模拟。
2.3.2 RBF-GA 模型寻优结果 设定的最大遗传代数60,变量的二进制位数为8,利用GA 对RBF 径向基神经网络进行递代寻优。由图9 可知,随着递代次数的不断增加,个体适应度所处的平稳期逐渐增长,这说明个体的适应能力会随着适应函数的减小而逐渐增大[37]。通过MATLAB R2019b 软件运行GA 算法程序,模拟生物进化过程中的选择、交叉、变异等自然选择情形,经过约24 次的迭代,适应度曲线趋于平稳,寻找到最优值,迭代结束。由GA 迭代程序运行结束的输出结果可得,包埋率的最大预测值为94.919%。对应的海藻酸钠浓度,固化剂浓度和固化时间的最优值分别为4.451%,2.210%和13.529 min。此时包埋率实测平均值为95.08%±0.25%,相对标准差(RSD)为3.28%,且预测值与实际值基本吻合,说明RBF-GA 模型的寻优结果及各参数可靠。
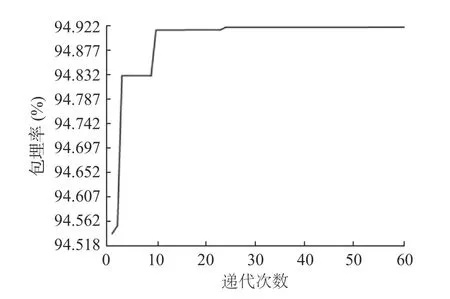
图9 RBF-GA 模型60 次迭代寻优结果Fig.9 Result of optimization with 60 iterations of the RBF-GA model
2.4 两种优化模型比较
2.4.1 RBF-GA 和BBD 预测结果对比 表4 为BBD和RBF-GA 模型所提供的发酵乳杆菌LTP1332 微胶囊包埋率预测值。结合表4 中两种优化模型的实测值及预测结果,分别计算出BBD 和RBF-GA 模型的RMSE、MAE 以及R2值,分别为0.3513、0.3307、0.9690 和0.2586、0.1259、0.9832。BBD 和RBF-GA模型对发酵乳杆菌LTP1332 微胶囊包埋率预测值的评估结果如图10 所示。将二者的RMSE、MAE、R2进行对比,并结合图10 可以发现RBF-GA 模型比BBD 模型具有更为准确的评估预测能力。由于微胶囊工艺参数与包埋率的非线性较强,RBF-GA与BBD 模型相比具有更好的拟合效果,这与神经网络遗传算法模型在其它领域的应用效果类似[42-43]。
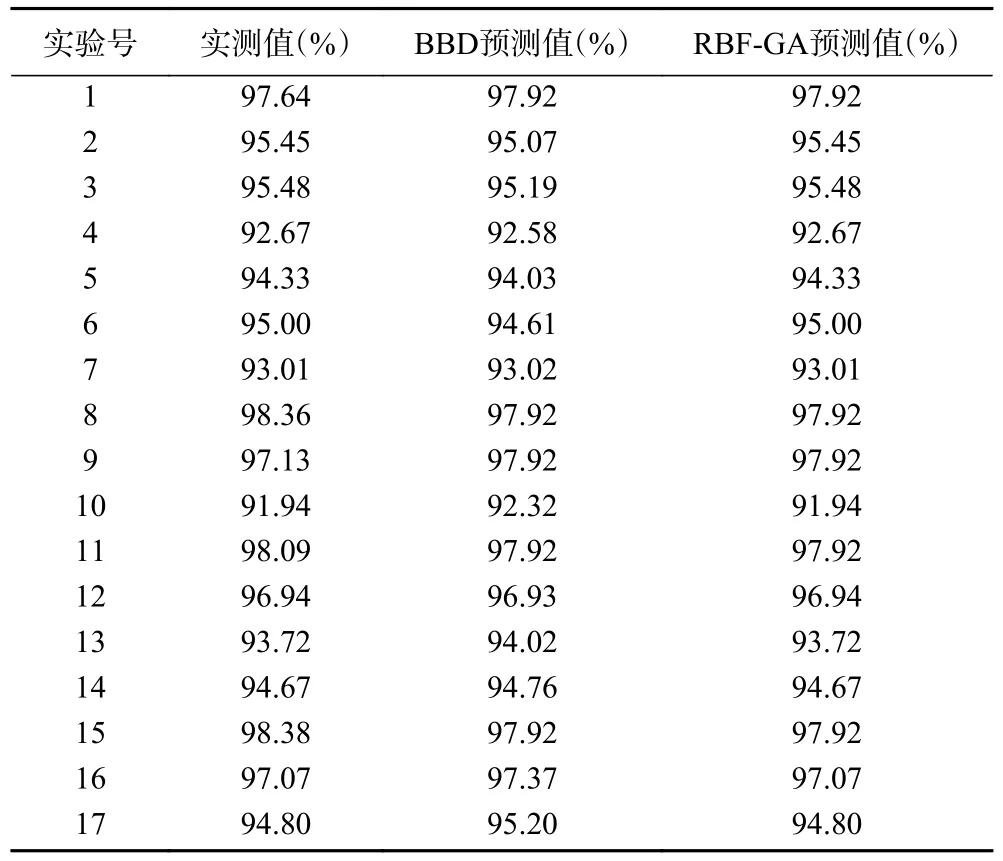
表4 BBD 和RBF-GA 模型的预测值Table 4 Predicted values of BBD and RBF-GA models

图10 对比包埋率的实测值和预测值Fig.10 Comparison of measured value and predicted value of embedding rate
2.4.2 RBF-GA 和BBD 优化结果对比 RBF-GA 和BBD 模型优化各项参数、预测值以及实际值的对比如表5 所示。就发酵乳杆菌LTP1332 微胶囊包埋率的平均实测值与预测值而言,RBF-GA 模型较BBD模型分别提高了0.76%和0.471%。由图11 可知,RBF-GA 模型的RMSE 和MAE 均小于BBD 模型,说明RBF-GA 模型具有更好的预测性能。单从包埋率的优化结果看,尽管本文优化结果显著性不高(P=0.0197<0.05),但依旧表明该法具有可行性。因为RBF-GA 模型在优化的过程中并不需要其它额外的试验,方法较为简单,这也与许多研究者的方法相似,在BBD 试验数据的基础上进行优化,使BBD 作为人工神经网络遗传算法目标函数的二阶模型,最终在优化中均取得了更好的结果[44-45]。因此,可以认为RBF-GA 模型在发酵乳杆菌LTP1332 微胶囊制备工艺探究中已对BBD 的二阶模型进一步优化。
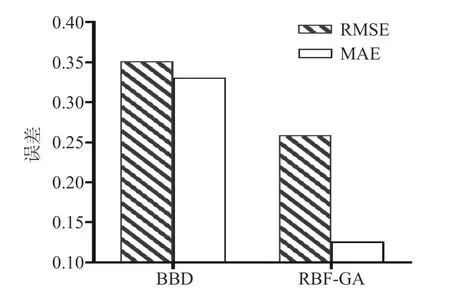
图11 不同模型RMSE 和MAE 比较Fig.11 Comparison of RMSE and MAE of different models
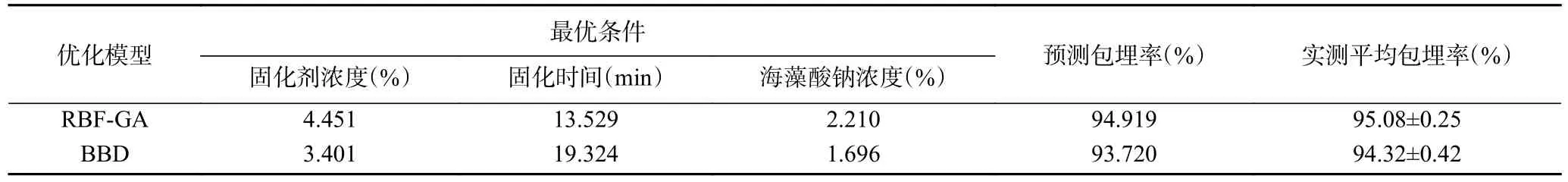
表5 RBF-GA 模型与响应面优化模型下的预测值和实际值比较Table 5 Comparison of optimization results of RBF-GA and BBD for protectants
2.5 微胶囊质构分析结果
2.5.1 微胶囊外观 一般来说,通过挤压法制得的微胶囊,平均粒径在2~5 mm[46],且粒径在2~4 mm 范围内的藻酸盐水凝胶颗粒对包裹在其中的益生菌具有更好的保护作用[47]。按照1.2.2.2 方法,本研究制备的RBF-GA 优化条件下的湿胶囊平均粒径为2.76±0.43 mm,干胶囊的平均粒径为1.25±0.26 mm,粒径大小在前人探索的优质范围之内,具体效果如图12 所示。

图12 发酵乳杆菌LTP1332 微胶囊效果图Fig.12 Effect diagram of Lactobacillus fermentum LTP1332 microcapsule
2.5.2 扫描电镜(SEM)本研究通过SEM 扫描电镜观察RBF-GA 优化工艺条件下发酵乳杆菌LTP1332干微胶囊形态。经过冷冻干燥后,微胶囊的形态会发生变化[48],发酵乳杆菌LTP1332 微胶囊形状由规范球体变为不规则球形。这可能是由于壳聚糖的沉积,在海藻酸盐表面形成聚电解质膜,从而导致胶囊壁材的外表面出现了一定的褶皱现象。图13A 为发酵乳杆菌LTP1332 胶囊的部分截面图,可以发现微胶囊的内部为多孔状,应该是海藻酸盐上的G 单位与Ca2+形成离子桥导致的,这也证明了海藻酸钠和CaCl2之间很好地发生了离子性凝胶化[20]。图13B~D 为图13A中红框部分的逐步放大图,从中可以发现,在微胶囊壁材上表面附着杆状的发酵乳杆菌LTP1332,这显示着微胶囊化可以对发酵乳杆菌LTP1332 进行包埋和保护。
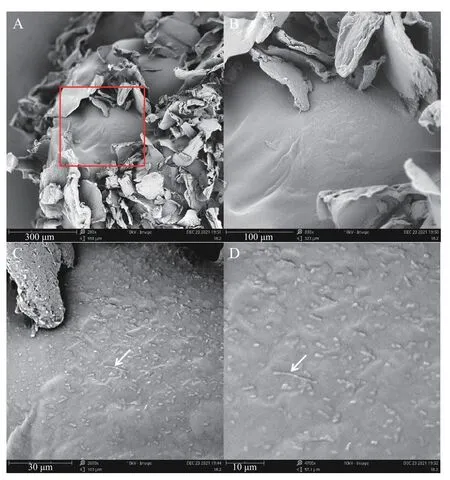
图13 发酵乳杆菌LTP1332 微胶囊扫描电镜图Fig.13 SEM of the Lactobacillus fermentum LTP1332 microcapsule
2.6 模拟胃肠道消化试验结果
2.6.1 模拟胃液耐受性试验结果 只有保证益生菌能够在胃肠道中大量健康存活,才能使其更好地发挥出自身益生特性。因此,研究了RBF-GA 最优工艺下的发酵乳杆菌LTP1332 微胶囊(CS-GEL-SA-微胶囊)在人工模拟胃液中的生存力,并与未添加明胶的CS-SA-微胶囊进行对比(如图14 所示)。在食品中,每克或每毫升产品中活菌数要大于106~107才被认为是有效的[49],在刚开始进行模拟胃作用时,三组的活菌数都可达4×107CFU/g 以上,组间无显著差异(P>0.05),符合食品要求。在模拟胃液120 min时,两组微胶囊的活菌数都发生了明显下降,对此结果解释是,微胶囊颗粒表面存在一些相对较大的孔径,这有利于有机酸、氧气和消化酶等小分子扩散到微胶囊中,从而使包埋的发酵乳杆菌LTP1332 失活[20]。此时CS-GEL-SA-微胶囊与CS-SA-微胶囊的益生菌存活率分别为22.48%±0.78%和14.33%±0.32%,相比之下CS-GEL-SA-微胶囊益生菌存活率更高,说明添加明胶复合后能有效改善微胶囊表面的孔径大小,增强菌体的存活率。CS-GEL-SA-微胶囊相比于未包埋的发酵乳杆菌LTP1332 在模拟胃液中的存活率提高了18.71%±1.76%,说明了按照优化工艺制备的CS-GEL-SA-微胶囊,在胃液中可以表现出良好的护菌效果。在初始活菌数为4.377×107±0.388×107CFU/g情况下,经人工模拟胃液处理后活菌数仍可达0.984×107±0.034×107CFU/g,这与国内外的研究相比已经到达较高水平[31]。

图14 胃液耐受性模拟评估试验结果Fig.14 Gastric fluid tolerance simulation assessment test results
2.6.2 模拟肠液释放性试验结果 在肠液中由于pH 偏碱性,在阴离子的作用下,导致益生菌微胶囊的体积开始膨大,最终导致体系破裂,从而保证益生菌微胶囊可以更好地解囊,释放出益生菌[21]。从图15可知,随着微胶囊在人工模拟肠液中的处理时间延长,按照RBF-GA 优化工艺条件下制备的CS-GELSA-微胶囊中的发酵乳杆菌LTP1332 会连续释放,到90 min 时释放率即可达到最高,90 min 之后出现下降趋势,但不显著(P>0.05),此时测得菌体存活率为94.324%±2.034%,活菌数在108CFU/g 左右,这说明了该CS-GEL-SA-微胶囊具有较好的肠溶性。食品在肠道中一般3 h 左右就能完成消化[50],CSGEL-SA-微胶囊在人工肠模拟液中处理90 min 时,菌体的释放率即可达到最大值,这也为其能更好的在人体中发挥益生作用提供了保障。

图15 肠液释放性模拟评估试验结果Fig.15 Results of the simulated evaluation test for the release of intestinal fluid
3 结论
本研究采用RBF-GA 模型等系列方法确定了发酵乳杆菌LTP1332 微胶囊的最优制备工艺为2.210%海藻酸钠,4.451% CaCl2,0.1% 明胶,固化时间13.529 min。RBF-GA 模型的RMSE、MAE、R2值分别为0.2586、0.1259、0.9832,经验证,RBF-GA 模型的预测性能及包埋率优化结果均好于BBD 模型,此时微胶囊平均包埋率为95.08%±0.25%。CS-GELSA-微胶囊显著提高了发酵乳杆菌LTP1332 在模拟胃肠液中的存活率(P<0.05),在模拟胃液处理120 min后,包埋菌体的存活率仍可达22.48%±0.78%的较高水平,相比于未包埋的发酵乳杆菌LTP1332 存活率提高了18.71%±1.76%,说明本研究开发的微胶囊具有较好的护菌效果。在肠液释放性试验中,CS-GELSA-微胶囊中在人工模拟肠液处理90 min 时,菌体的释放率即可达到最高,具有较好的肠溶性。因此认为,本研究获得的发酵乳杆菌LTP1332 CS-GELSA-微胶囊工艺,为其在食品工业中走向实际应用提供了一定的理论基础,此外,RBF-GA 模型的应用也为其它益生菌产品的工艺探究优化提供了新的手法。

