云南大叶种茶树花生化成分及体外抗氧化活性研究
师梦楠,彭 云,张 杰,熊昌云,
(1.云南农业大学茶学院,云南昆明 650000;2.云南农业大学热区健康饮料研究中心,云南普洱 665000;3.宜宾市茶产业研究院,四川宜宾 644000)
茶树是我国重要的经济作物,一直以来都是以收获芽叶为主[1]。而茶树花作为茶树的重要部分的开发利用却非常有限[2]。茶树花为茶树的生殖器官,是两性花,由花萼、花柄、花冠、雄蕊以及雌蕊组成[3]。茶树每年5 月开始花芽分化,开花时间一般在9~12 月[4],具有“寿命短、花期长、开花多、结实少”的特点[5]。而且实验表明,茶树花内含可溶性糖、茶多酚、氨基酸、黄酮等[6-8]多种有益成分和活性物质,具有杀菌、延缓衰老、增强免疫等功效[9-12]。
茶树花主要内含成分种类与茶叶相似,但含量和组成比例存在一定差异[13]。对盛开茶树花朵和花蕾的研究中发现其总黄酮和总皂甙含量均显著高于茶叶[14-15]。不同品种茶树花露白期、破绽期、初开期和全开期内的内含化学成分也存在一定差异[16]。茶树花中茶多酚被誉为天然的抗氧化剂[17],对自由基有较好的清除作用[18]。更有学者将茶树花和VC的抗氧化对比研究,发现被研究的11 个样品中10 种总的抗氧化能力都强于VC,同时一半以上样品清除DPPH 或ABTS+自由基能力比VC强[19]。已有研究表明云南群体种与云抗10 号具有较好的抗氧化活性[20]。云南省是产茶大省,茶树花资源丰富,所以本文通过对云南地区13 个样品茶树花进行生化成分、体外抗氧化及其相关性进行研究,旨在找出体外抗氧化活性强的品种,以及相关性强的指标,为发展利用云南茶树花资源以及加工成健康化产品等方向提供理论依据。
1 材料与方法
1.1 材料与仪器
茶树花 采摘于云南省主要产茶区健康无病虫害的茶树上,选取了具有代表性的古茶树资源以及人工选育的优良品种,详见表1。采摘标准均为全开花,鲜花经微波固样,匀堆分成三等份于无菌袋中,置于4 ℃冰箱贮存待测;甲醇、乙腈 均为色谱纯,昆明美博科技有限公司;茚三酮 分析纯,天津市大茂化学试剂厂;氯化亚锡 分析纯,天津市科密欧化学试剂有限公司;磷酸氢二钠、磷酸二氢钾、氯化镁均为分析纯,天津市风船化学试剂科技有限公司;三氯化铝、乙酸 均为分析纯,国药集团化学试剂有限公司;咖啡碱(caffeine,CA)标准品,纯度≥99%,四川维克奇生物科技有限公司;没食子儿茶素(catechin,C)、表没食子儿茶素(epigallocatechin,EGC)、儿茶素(catechin,C)、表儿茶素(epicatechin,EC)、表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)、没食子儿茶素没食子酸酯(gallocatechin gallate,GCG)、表儿茶素没食子酸酯(epicatechin gallate,ECG)、儿茶素没食子酸脂(catechin gallate,CG)、没食子酸(gallic acid,GA)标准品,纯度≥99%,成都普思生物科技有限公司;ABTS、DPPH、羟自由基清除能力、超氧阴离子清除能力试剂盒及FRAP 法试剂盒 苏州格锐思生物科技有限公司。
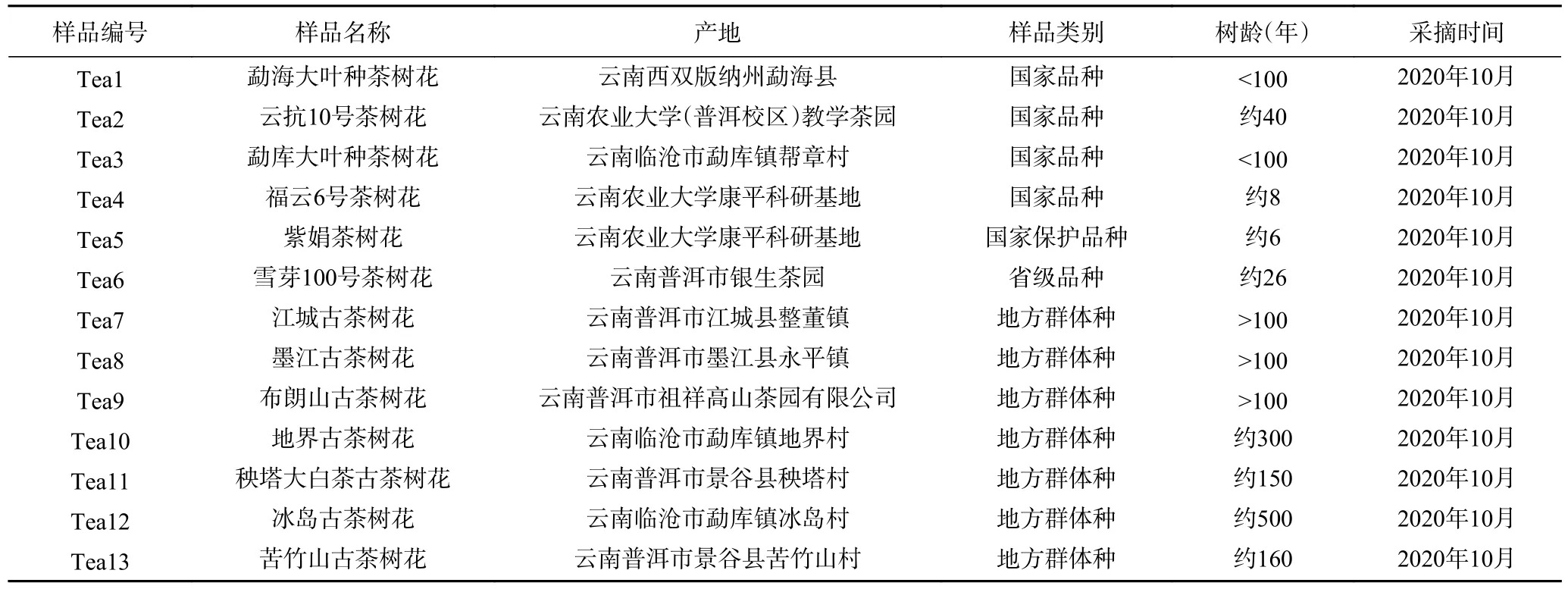
表1 茶树花试验样品及来源地Table 1 Tea tree flower test sample and origin
1260 型高效液相色谱系统、C18色谱柱(250 mm×4.6 mm,5 μm)美国Agilent Technologies 公司;UV-5500 型紫外可见分光光度计 上海元析仪器有限公司;Heraeus Fresco17 型离心机 美国赛默飞世尔公司;明澈D24 UV 型纯水仪 默克(Merck Millipore)公司;MD190 酶标仪、Nunc 系列96 孔板 美国赛默飞世尔公司。
1.2 实验方法
1.2.1 生化成分测定 参照GB/T 8303-2013[21]对试验样品进行处理;水浸出物含量参照GB/T 8305-2013[22]全量法进行测定;游离氨基酸含量参照GB/T 8314-2013[23]茚三酮比色法进行测定;茶多酚含量参照GB/T 8313-2018[24]进行测定;总黄酮测定[25]:采用三氯化铝比色法测定。称取茶叶磨碎干样1.00 g于100 mL 三角瓶,加沸蒸馏水40 mL,置沸水浴中提取30 min,过滤到50 mL 容量瓶并定容,摇匀即为供试液。吸取供试液0.5 mL,加1%三氯化铝水溶液至10 mL,摇匀,10 min 后移入1 ml 比色皿中,利用分光光度计在420 nm 波长处比色,蒸馏水做空白,测定吸光度(A)。
儿茶素(GC、EGC、C、EC、EGCG、GCG、ECG、CG)、咖啡碱(CA)、没食子酸(GA)应用HPLC[26]方法测定。样品提取:称取1 g 样品,加入40 mL 甲醇和4 mL 盐酸,85 ℃水浴90 min,用脱脂棉花过滤至50 mL 容量瓶中,最后用甲醇定容至刻度线得到待测液。HPLC 检测方法:应用1260 型高效液相色谱系统测定,色谱柱为C18色谱柱(250 mm×4.6 mm,5 μm);流动相A 为0.261%磷酸,5%乙腈;流动相B 为0.261%硫酸,80%乙腈。流速为1 mL/min,进样量为10 μL,波长设置为278 nm。洗脱梯度程序:在0~22 min 内,A 相由95%到65.5%,B 相从5%到34.5%;22~22.5 min,A 相由65.5%到0%,B 相从34.5%到100%;22.5~27.8 min,A 相由0%到95%,B 相从100%到5%;28 min 程序停止,后运行6 min。并根据峰面积使用外标法进行定量分析。
1.2.2 体外抗氧化活性测定 ABTS+自由基清除能力、DPPH 自由基清除能力、超氧阴离子清除能力、羟自由基清除能力及总抗氧化能力(TAC)测定均采用苏州格锐思生物科技有限公司相关试剂盒测定。试验设置三次重复,按照样本质量计算结果。
1.2.2.1 ABTS+自由基清除能力测定 参照ABTS+自由基清除能力试剂盒说明书进行操作。称取0.1 g样品,加入1 mL 的80%甲醇提取液,冰浴匀浆,匀浆后在12000 r/min,4 ℃条件下离心10 min,取上清液,置冰上待测。将酶标仪波长设置为734 nm,上机检测读取吸光值A。


式中:V 表示加入提取液体积,mL;V1表示反应中样品体积,mL;W 表示样品质量,g;D 表示稀释倍数。
1.2.2.2 DPPH 自由基清除能力测定 参照DPPH自由基清除能力试剂盒说明书进行操作。称取0.1 g样品,加入1 mL 的80%甲醇提取液,冰浴匀浆,匀浆后在12000 r/min,4 ℃条件下离心10 min,取上清液,置冰上待测。将酶标仪波长设置为517 nm,取200 μL 转移至96 孔板内,于517 nm 处读取吸光值A。

式中:V 表示加入提取液体积,mL;V1表示反应中样品体积,mL;W 表示样品质量,g;D 表示稀释倍数。
1.2.2.3 超氧阴离子清除能力测定 参照超氧阴离子清除能力试剂盒说明书进行操作。称取0.1 g 样品,加入1 mL 提取液,冰浴匀浆,匀浆后在12000 r/min,4 ℃条件下离心10 min,取上清液,置于冰上待测,等待上机检测。将酶标仪波长设置为570 nm,取200 μL 转移至96 孔板内,于570 nm 处读取吸光值A。
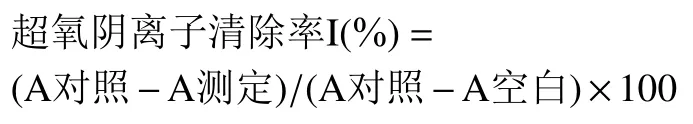
1.2.2.4 羟自由基清除能力测定 参照羟自由基清除能力试剂盒说明书进行操作。称取0.1 g 样品,加入1 mL 蒸馏水,冰浴匀浆,匀浆后在12000 r/min,4 ℃条件下离心10 min,取上清液,置冰上待测。将酶标仪波长设置为510 nm,上机检测读取吸光值A。

1.2.2.5 总抗氧化能力测定 参照FRAP 法试剂盒说明书进行操作。称取0.1 g 样品,加入1 mL 的80%乙醇进行匀浆,匀浆后转入离心管中;60 ℃,200~300 W 条件下超声提取30 min(间隔5 min 振荡混匀一次),之后在12000 r/min,4 ℃条件下离心10 min,取上清液,置冰上待测。将酶标仪波长设置为590 nm,待测液上机检测读取吸光值A。
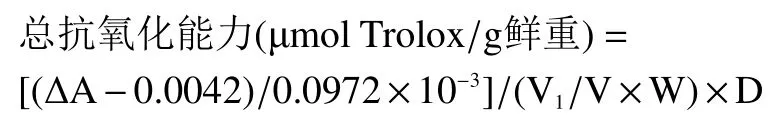
式中:△A=A 测定-A 空白;V 表示加入提取液体积,mL;V1表示反应中样品体积,mL;W 表示样品质量,g;D 表示稀释倍数。
1.3 数据处理
试验设计包括3 次重复,数据采用平均值±标准差(Mean±SD)表示,试验样品中的理化成分含量使用软件IBM SPSS Statistics26、Duncan 检验方法进行P<0.05 水平上的多重比较,对样品间差异进行显著性分析,使用Origin 进行作图。
2 结果与分析
2.1 茶树花生化成分分析
2.1.1 不同茶树花样品中主要生化成分含量 对13 个茶树花样品的水浸出物、游离氨基酸、茶多酚、总黄酮、咖啡碱和没食子酸进行检测,具体结果见表2。
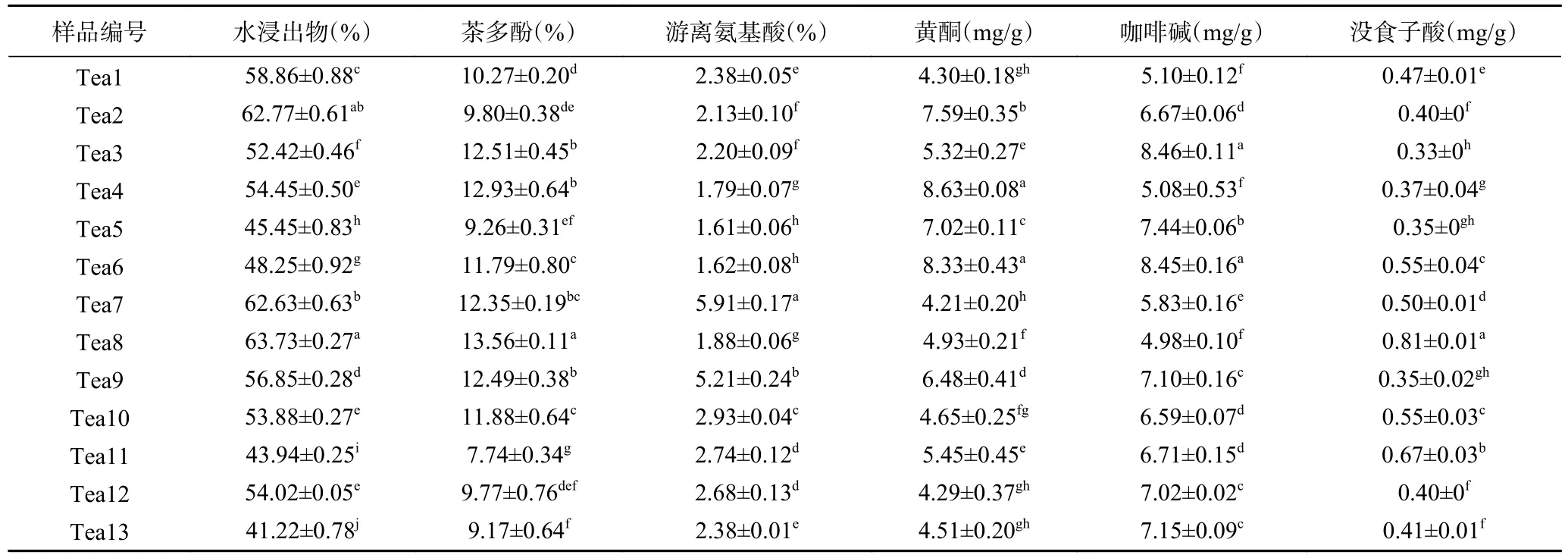
表2 茶树花主要生化成分分析Table 2 Analysis of the main biochemical components of tea tree flowers
结果所示,样品水浸出物含量在41.22%~63.73%之间,高于国家标准中对普洱茶(晒青茶)规定的标准要求(≥35%)[27]。13 个样品中,墨江古茶树花含量最高为63.73%,苦竹山古茶树花含量最低为41.22%。其中,地界、冰岛古茶树花、福云6 号无显著差异(P>0.05),其他样品均有显著差异(P<0.05)。对比发现,古茶树花水浸出物含量41.22%~63.73%,波动范围大于非古茶树花水浸出物含量45.45%~62.77%范围。推测可能是因为非古茶树的样品多为国家级、省级良种,性状比较稳定;而古茶树大多为地方群体种,种间变异性较大,具体原因还需要深入研究。
实验测得样品茶多酚含量范围为7.74%~13.56%,最高的是墨江古茶树花,秧塔大白茶古茶树花茶多酚含量最低。实验结果高于学者对江浙地区5 个茶树花茶多酚含量6.35%~8.19%的研究[28]。这可能是样品受处理方式以及品种差异的影响。各茶树花样品的游离氨基酸含量在1.61%~5.91%之间,江城古茶树花和布朗山古茶树花明显高于其他样品,而紫娟、雪芽100 号含量则比较低。对比发现,游离氨基酸含量除江城、布朗山古茶树花含量较高外,其他样品含量处于1.61%~2.93%之间,与石兴云等[29]通过常规法测得云南大叶种茶树花中游离氨基酸的含量相近。这可能也和加工方式[30]以及树龄、栽培条件等有关[31]。咖啡碱是重要的活性物质[32],测得样品含量范围为4.98~8.46 mg/g,勐库大叶种、雪芽100 号含量最高,墨江古茶树花含量最低。黄酮类物质具有抗菌消炎等生物活性[33],被测样品中黄酮含量为4.21~8.63 mg/g,其中福云6 号、雪芽100 号茶树花黄酮含量较高,江城古茶树花、冰岛古茶树花、勐海大叶种茶树花黄酮含量较少。与此同时,测得的13 个茶树花样品没食子酸含量均表现出差异性,墨江古茶树花含量最高,含量最低的为勐库大叶种。13 个样品在生化成分上均表现出一定的差异性,可结合具体成分合理开发和利用茶树花资源。
2.1.2 茶树花中儿茶素组成成分分析 儿茶素是茶叶中抗氧化、抗增殖等功效的关键活性物质[34],特别是EGCG 和EGC[35]。对样品中的儿茶素类物质用HPLC 进行测定,利用外标法处理数据,具体结果见表3。
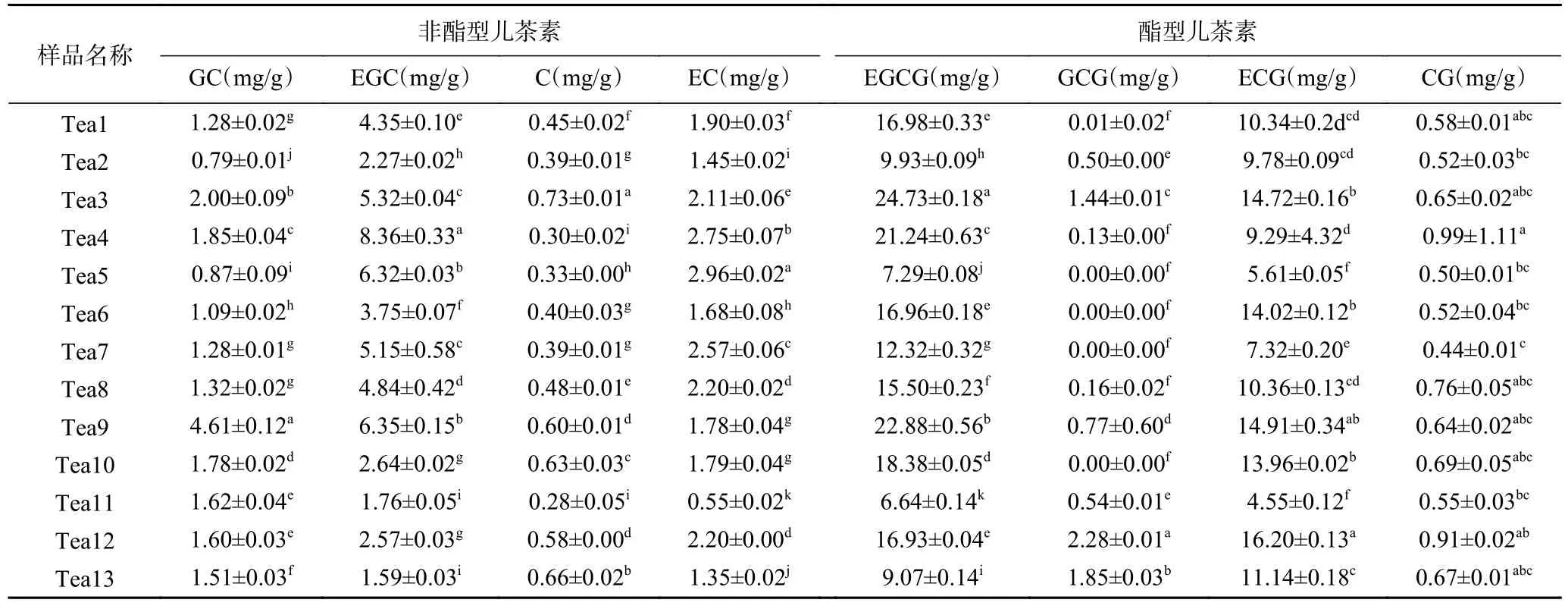
表3 儿茶素类物质含量Table 3 Contents of catechins
试验共检测出8 种儿茶素单体化合物,分别为没食子儿茶素(GC)、表没食子儿茶素(EGC)、儿茶素(C)、表儿茶素(EC)、表没食子儿茶素没食子酸酯(EGCG)、没食子儿茶素没食子酸酯(GCG)、表儿茶素没食子酸酯(ECG)、儿茶素没食子酸酯(CG),其中酯型儿茶素含量12.28~41.54 mg/g 显著(P<0.05)高于非酯型儿茶素4.17~13.34 mg/g。不同于学者对“黄金桂”茶树品种的研究结果:茶树花儿茶素含量以非酯型儿茶素为主[36]。推测可能是加工工艺等因素导致酯型儿茶素和非酯型儿茶素含量的不同。13 个样品儿茶素中EGCG 含量最高,其次是ECG、EGC;含量最少的是GCG,在江城古茶树、地界古茶树、雪芽100 号、紫娟4 个样品中并没有检测到该单体。茶树鲜叶中EGCG 在儿茶素含量上也占较大比重[37]。就总酚含量而言,布朗山古茶树花、勐库大叶种茶树花明显高于其他样品,福云6 号、冰岛古茶树花次之,秧塔大白茶古茶树花含量最少。综上,不同样品茶树花在各组分含量、酯型儿茶素、非酯型儿茶素和儿茶素总量上均存在显著差异(P<0.05)。
本试验根据测得的儿茶素指标进行层次聚类分析,以期评估13 个样品之间的相似性。结果表明(图1):在类间距离为10 时,可划分为3 类:第1 类聚集了勐海大叶种、墨江古茶树花、江城古茶树花、云抗10 号、苦竹山古茶树花、雪芽100 号、地界古茶树花、冰岛古茶树花,这一类群的特点是儿茶素含量处于较高水平,样品间波动较小;第2 类聚集了勐库大叶种、布朗山古茶花、福云6 号,该类群中的EGCG 含量是各品种间最高,直接与儿茶素的总量呈现出高度正相关。第3 类聚集了低含量的样品,分别是秧塔大白茶、紫娟。结果表明,通过聚类分析可以将指标水平相近的品种聚在一起,有利于对不同目标的筛选。

图1 茶样间儿茶素组分聚类分析Fig.1 Cluster analysis of catecin components in the samples
2.2 茶树花体外抗氧化活性测定
对13 个茶树花样品检测发现,云南大叶种茶树花存在抗氧化能力,但不同样品存在一定差异性。具体结果如下(图2)。茶树花样品对DPPH 自由基的清除能力显著[38],所有检测样品茶树花的DPPH 抗氧化值变幅范围为144.40~272.79 mg Trolox/g 鲜重。DPPH 抗氧化能力最强的是布朗山古茶树花,清除率为80.98%±0.51%,最弱的是秧塔大白茶古茶树花,清除率仅为41.85%±0.32%。不同茶树花样品抗氧化活性表现出一定的差异性,可能是不同茶树花的生物活性成分在含量与组成结构上的不同导致对茶树花清除自由基能力的强弱不一样[39]。
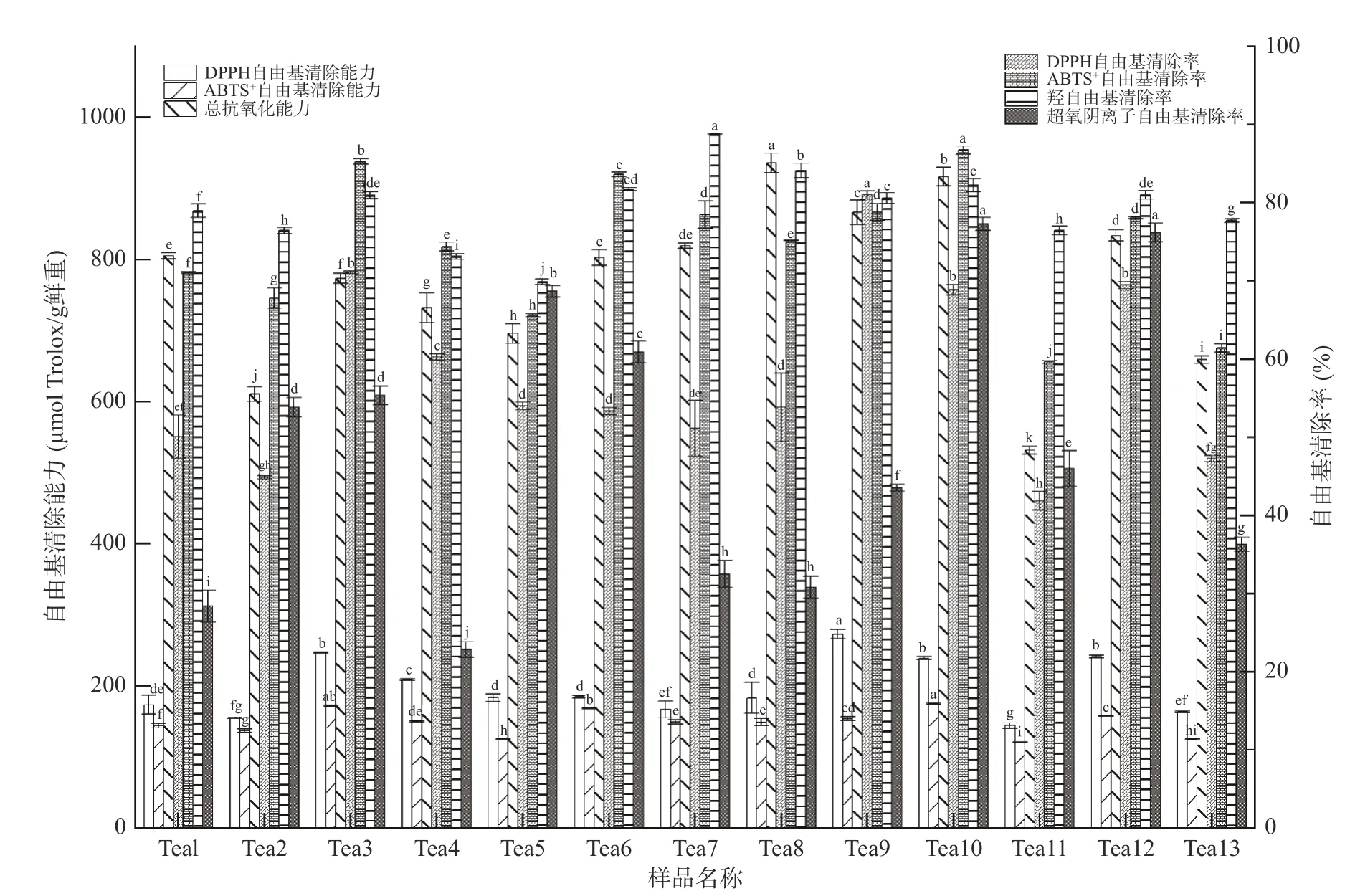
图2 不同品种茶树花的抗氧化活性Fig.2 Antioxidant activity of different varieties of tea tree flowers
茶树花样品对ABTS+自由基有一定的清除能力,13 个被检测茶树花样品的ABTS+抗氧化值的变幅为121.07~174.81 mg Trolox/g 鲜重。其中,清除能力最强的是地界古茶树花,清除率为86.73%±0.53%,其次是勐库大叶种茶树花、雪芽100 号茶树花,清除率都达80%以上。秧塔大白茶古茶树花清除率最低为59.63%±0.19%。
各个被测样品清除羟自由基效果都较好,呈现出显著性差异(P<0.05),13 个茶树花样品的羟自由基清除率变幅介于69.89%~88.77%之间。其中,江城古茶树花对·OH 的清除率最高,为88.77%±0.11%,紫娟茶树花最低,为69.89%±0.37%。云抗10 号茶树花和秧塔大白茶古茶树花对·OH 的清除能力无显著性差异,勐库大叶种茶树花和冰岛古茶树花对·OH的清除能力也无显著性差异(P>0.05)。
试验分析发现,相较其他几种自由基清除率而言,超氧阴离子清除率相对较低。被测样品清除能力范围为22.83%~77.25%。其中超氧阴离子自由基清除活性最强的是地界古茶树花,清除率为77.25%±0.84%,其次是冰岛古茶树花,清除率为76.16%±1.2%,两者无显著差异。福云6 号清除率最低,为22.83%±1.01%。对比发现,勐库大叶种茶树花与云抗10 号茶树花清除能力无显著差异,江城古茶树花与墨江古茶树花清除能力差异也不显著。
此次检测样品FRAP 值的变化范围为531.75~935.61 μmol Trolox/g 鲜重。其中FRAP 还原能力最强的是墨江古茶树花,FRAP 还原能力最弱的是秧塔大白茶古茶树花。
对比不同检测方法发现,茶树花对羟自由基的清除作用最强,ABTS+自由基、DPPH 自由基稍次之,而对超氧阴离子自由基的清除作用则较弱。在各个抗氧化测定中,古茶树花都表现出较好的自由基清除能力,在抗氧化上可能会有更好的发展[40]。通过多种方法对茶树花抗氧化能力进行测定比较,这一结果说明用多种试验方法进行抗氧化能力测定是必要的,只有通过多种实验对比,才可以得到较为全面、可信的结果[41],从而筛选出高抗氧化能力的品种,为充分开发茶树花抗氧化活性提供切实可行的帮助。
2.3 生化成分与抗氧化活性相关性分析
为探讨各个样品生化成分指标与体外抗氧化活性的相关性,本次试验用Pearson 相关性分析进行研究,结果见表4。DPPH 自由基清除率和EGCG、ECG、GC 存在极显著相关性,分别是EGCG(R2=0.807,P<0.01)>ECG(R2=0.739,P<0.01)>GC(R2=0.738,P<0.01)。而且,其与C 有显著相关性,R2=0.610,P<0.05。ABTS+自由基清除能力与EGCG(R2=0.700,P<0.01)存在极显著正相关,与茶多酚含量(R2=0.625,P<0.05)存在显著相关性。超氧阴离子自由基清除率仅与咖啡碱(R2=0.647,P<0.05)存在显著相关性。总抗氧化能力与茶多酚含量(R2=0.754,P<0.01)呈极显著相关性,与EGCG、ECG 相关性显著,其中,EGCG(R2=0.634,P<0.05)>ECG(R2=0.595,P<0.05)。邓宇杰[39]以6 个茶树花品种为研究材料,发现茶树花中EGCG 的含量对抗氧化活性贡献很大,与本实验研究结果基本一致。但暂未发现羟自由基清除率与某成分有显著相关性。黄酮也未表现出明显的相关性,与茶叶抗氧化活性结果相似[42]。
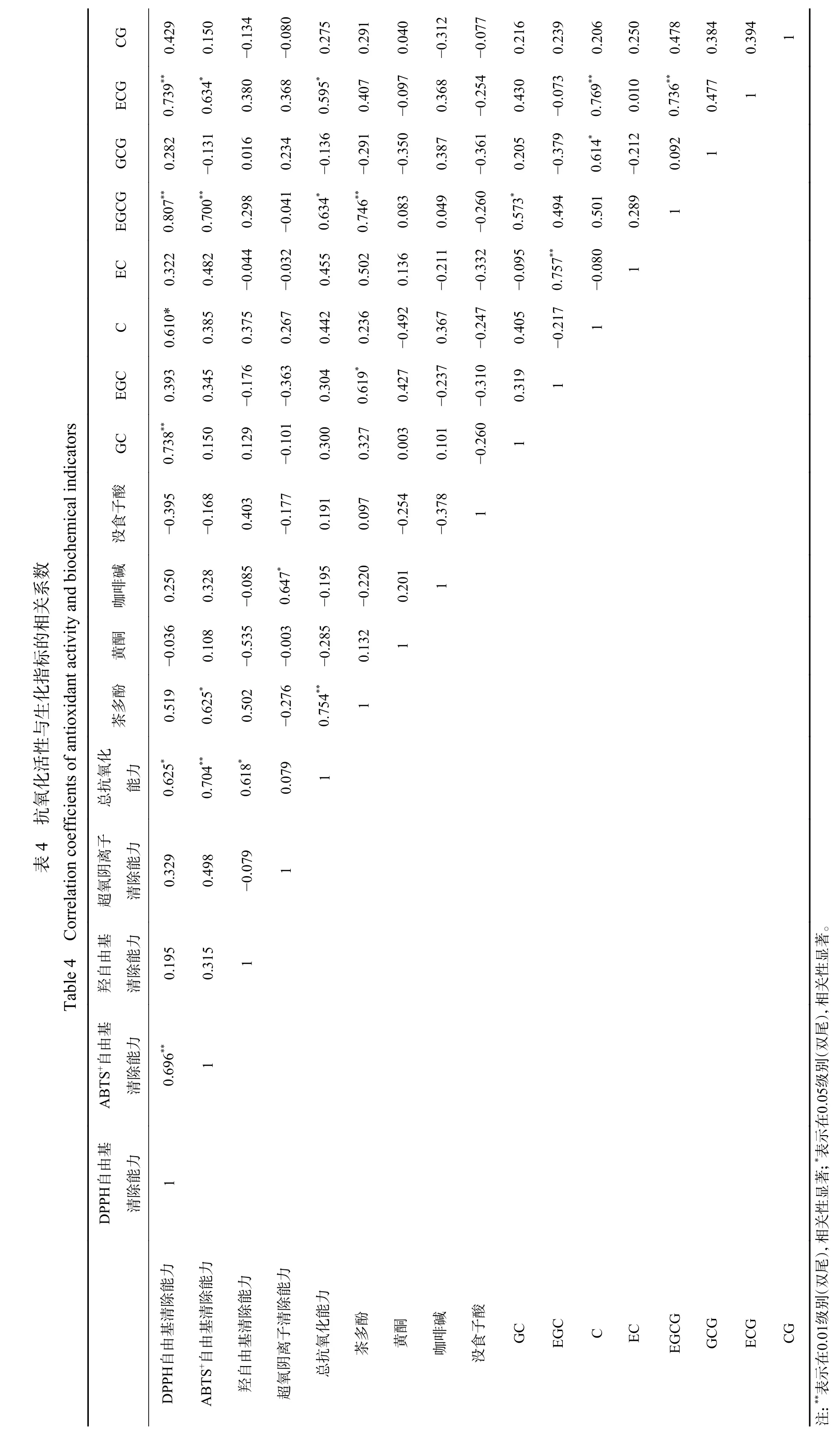
由此可以说明多酚类物质无论是总量还是单体对茶树花的抗氧化活性都起着不同程度的相关作用,是茶树花抗氧化活性的主要物质基础。此外,各种生化成分的含量间也存在一定相关性,最为显著的就是茶多酚与各儿茶素单体以及儿茶素各单体之间的相关性。
3 结论
本次实验测得不同茶树花样品的主要化学成分含量存在差异,其中墨江古茶树花茶多酚、水浸出物含量最高,分别为13.56%、63.73%,江城古茶树花氨基酸含量最高为5.91%,福云6 号茶树花总黄酮含量最高为8.63 mg/g,咖啡碱含量最高的为勐库大叶种茶树花8.46 mg/g,而布朗山古茶树花的儿茶素总量最高为52.54 mg/g。实验表明,各个样品间具有一定的差异性,而且除了黄酮和咖啡碱含量,其它成分含量古茶树花的变化幅度大于现代无性系茶树花,这可能是古茶树花更具有遗传多样性和可变异性的特点。
研究发现,不同茶树花总抗氧化能力上表现出不同,墨江古茶树花总抗氧化能力最强,为935.61±13.55 μmol Trolox/g 鲜重,秧塔大白茶古茶树花最弱,为531.75±5.23 μmol Trolox/g 鲜重。江城古茶树花对羟自由基的清除最强,地界古茶树花有较强的超氧阴离子清除能力和ABTS+自由基清除能力,布朗山古茶树花对DPPH 自由基清除作用比较强。可根据样品自由基清除能力的不同,选用最优的样品材料,来达到最佳的抗氧化结果。同时,数据显示,茶多酚和儿茶素单体中的EGCG、ECG 与抗氧化活性呈现显著相关性(P<0.05),可作为预测茶树花抗氧化活性的重要指标。本文通过分析云南大叶种茶树花生化成分含量及抗氧化能力,发现未来可根据生化成分、抗氧化活性筛选所需茶树花,应用于现代产业化加工,从而提升茶农经济收入,延长产业链。

