二甲双胍对脊髓损伤小鼠的神经修复作用
王大昊,闫 鹏
(锦州医科大学 附属第一医院骨科,锦州 121000)
0 引言
脊髓损伤(Spinal Cord Injury,SCI)是由交通事故及慢性脊柱疾病急性发作等多种病因引起的突发性中枢神经系统、脊髓组织严重损伤的一类临床疾病,常引起患者的感觉、运动和自主神经功能障碍、严重感染和多器官衰竭的临床表现,对社会发展及患者家庭造成极大的不良影响[1]。脊髓损伤主要的病理学机制有Ca2+内流增加,促炎性炎症因子过载和自噬等[1-4],靶向相关分子机制成为目前临床和基础研究脊髓损伤的治疗热点[4]。白介素(interleukin,IL)家族与中枢神经系统疾病密切相关[5]。白介素-6(interleukin-6,IL-6)已被证实,其在病灶微环境及细胞自噬的病理生理过程中起到重要的调节作用[5]。已有研究发现,自噬在脊髓损伤的发展过程起到保护作用。脊髓损伤后应用雷帕霉素(Rapamycin)治疗,可引起脊髓组织的自噬活动增强,并降低神经元的死亡率,减少脱髓鞘的面积,促进神经功能的恢复[6-7]。综上所述,经推测,脊髓损伤后神经细胞功能与白介素-6之间可能存在一定关联,但是具体的机制仍不明确。既往研究表明,二甲双胍(Metformin)可以降低脊髓损伤后IL-6的表达,促进运动功能恢复[8]。因此,本研究通过研究二甲双胍治疗后小鼠脊髓损伤病灶中炎症因子IL-6以及自噬特异蛋白雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)的表达变化,以探讨二甲双胍促进脊髓损伤小鼠运动功能恢复的可能机制。
1 材料与方法
1.1 实验动物
选取成年雌性C57BL/6小鼠48只,清洁级,8周龄,体重22~28 g,由锦州医科大学SPF动物实验中心提供。所有实验小鼠均进行封闭、分笼饲养,饲养环境温度22~24℃。
1.2 分组及模型制备
将48只成年雌性C57BL/6小鼠按随机数字表法分为假手术组(Sham组)、脊髓损伤组(SCI组)和二甲双胍治疗组(Metformin组),每组16只。各组腹腔注射20%乌拉坦(5 mL/kg),充分麻醉后进行消毒并备皮,以T10棘突为中心行纵向切口,充分暴露脊柱后切除T10棘突及椎板,充分暴露完整的小鼠脊髓组织;Sham组行椎板切除术,不做其他处理。SCI组及Metformin组小鼠采用修改重锤打击法即Allen’s法构建脊髓中度挫伤模型:下端直径2 mm的10 g重锤自50 mm高度落体。术后用生理盐水冲洗脊髓,消毒切口周围,完全缝合切口。术后7 d内,腹腔注射适量青霉素以预防小鼠全身感染。术后每天轻柔、挤压膀胱三次,直到小鼠恢复自主正常排尿。Metformin组于术后2 h腹腔注射二甲双胍50 mg/(kg·d) 进行干预,每天一次,持续一周。Sham组和SCI组注射等量的生理盐水。
1.3 行为学检测
各组随机选取7 只造模小鼠,分别在手术前(0 d),手术后第1 d、3 d、5 d、7 d、10 d、14 d 及28 d,采用 BMS(Basso Mouse Scale)评分标准进行评估。0 分为“无踝关节活动”,9 分为功能正常。根据每组小鼠的平均得分绘制一个折线图,据此来观察和比较不同处理组对脊髓损伤后运动功能的恢复状况。
1.4 免疫印迹
术后7 d,随机取各组3只小鼠处死,收集以损伤点为中心上下各0.5 cm的小鼠脊髓组织。将组织用组织剪切成小块,然后使用超声振动仪充分破碎,使蛋白质充分溶解在RIPA(Radio Immunoprecipitation Assay)裂解缓冲液中。测定蛋白样品浓度后制备样品,在95℃加热5 min使蛋白质变性稳定。在聚丙烯酰胺凝胶(SDS-PAGE)中每孔分别加入40 μg的等量蛋白质样品,电泳完毕后通过转膜,将蛋白质转移到PVDF[Poly(vinylidene fluoride)]膜上,然后充分浸没于封闭液(5%脱脂奶粉),室温摇床孵育封闭2 h。洗涤三次后,应用兔抗IL-6抗体(1∶1000), 兔抗mTOR抗体(1∶1000),小鼠抗GAPDH抗体(1∶1000)于4℃孵育过夜。第二日,将洗涤后的PVDF膜应用HRP(Horse radish peroxidase)标记的山羊抗兔IgG抗体(1∶10 000)以及HRP标记的山羊抗小鼠IgG抗体(1∶10 000)室温摇床上孵育2 h,再次充分洗涤后,在凝胶成像系统上显影。
1.5 免疫组化染色检测
随机取各组3只小鼠麻醉、灌流、固定后,提取以T10脊髓损伤处为中心上下各0.25 cm的脊髓组织,切成厚度为10 μm冰冻组织切片。将各组切片置于室温充分晾干后,用3 %过氧化氢孵育30 min以达到充分灭活组织内内源性过氧化物酶的实验目的。应用正常山羊血清封闭非特异性抗原2 h后,滴加兔抗IL-6抗体(1:200)或兔抗mTOR抗体(1∶100),4℃冰箱过夜后,PBS充分洗涤3次,每次5 min滴加HRP标记的山羊抗兔IgG二抗(1∶100) 37℃恒温孵育60 min。加入DAB(diaminobezidin)-过氧化氢显色液,待显微镜下观察到室温显色充分后立即漂洗。采用苏木素复染,按70%、80%、95%、100%乙醇逐级脱水2次,每次5 min,二甲苯透明20 min,中性树胶封片,挤压盖玻片以防气泡产生。于显微镜下观察目的蛋白的表达,染色阳性的组织/细胞呈现棕黄色。
1.6 统计学分析
2 结果
2.1 二甲双胍治疗可促进脊髓损伤小鼠功能恢复
3组小鼠在脊髓损伤前BMS评分均为9.00分;脊髓损伤后不同时间点SCI组和Metformin组小鼠BMS评分均明显小于Sham组,BMS评分在1~28 d内呈明显升高趋势。脊髓损伤后7 d 起,Metformin组小鼠BMS高于SCI组,差异具有统计学意义(P<0.05)。提示二甲双胍促进脊髓损伤小鼠功能恢复(表1)。

表1 各组小鼠的行为学评分
2.2 二甲双胍治疗抑制mTOR表达
在各组行为学评分出现统计学差异的时间点(术后二甲双胍治疗第7 d),行免疫印迹及免疫组化实验。免疫印迹结果显示,与Sham组相比,SCI组及Metformin组小鼠脊髓mTOR蛋白的表达降低(P<0.05);与SCI组相比,Metformin组小鼠mTOR蛋白的表达也明显降低(P<0.05),差异具有统计学意义。免疫组化结果显示,mTOR蛋白染色阳性颗粒呈棕褐色,主要位于神经元中,Sham组小鼠mTOR蛋白的表达量较高。与Sham组比较,SCI组及Metformin组小鼠损伤脊髓mTOR蛋白的表达显著下降,差异有统计学意义(P<0.05);与SCI组相比,Metformin组小鼠mTOR蛋白的表达也明显降低,差异具有统计学意义。提示二甲双胍促进脊髓损伤后的自噬(图1)。

图1 二甲双胍治疗脊髓损伤小鼠的mTOR蛋白表达情况aP<0.05,与Sham组比较;bP<0.05,与SCI组比较
2.3 二甲双胍治疗抑制IL-6表达
在术后二甲双胍治疗第7 d,行免疫印迹及免疫组化实验。免疫印迹结果显示,与Sham组相比,SCI组及Metformin组小鼠脊髓IL-6蛋白的表达升高(P<0.05);与SCI组相比,Metformin组小鼠IL-6蛋白的表达明显降低(P<0.05),差异具有统计学意义。免疫组化结果显示,IL-6蛋白染色阳性颗粒呈棕褐色,主要位于小胶质细胞中,Sham组小鼠损伤脊髓IL-6蛋白的表达量较低。与Sham组比较,SCI组小鼠损伤脊髓IL-6蛋白的表达量显著升高,差异有统计学意义(P<0.05);与SCI组相比,Metformin组小鼠IL-6蛋白的表达量也明显降低,差异具有统计学意义。提示二甲双胍抑制脊髓损伤后的炎症反应(图2)。
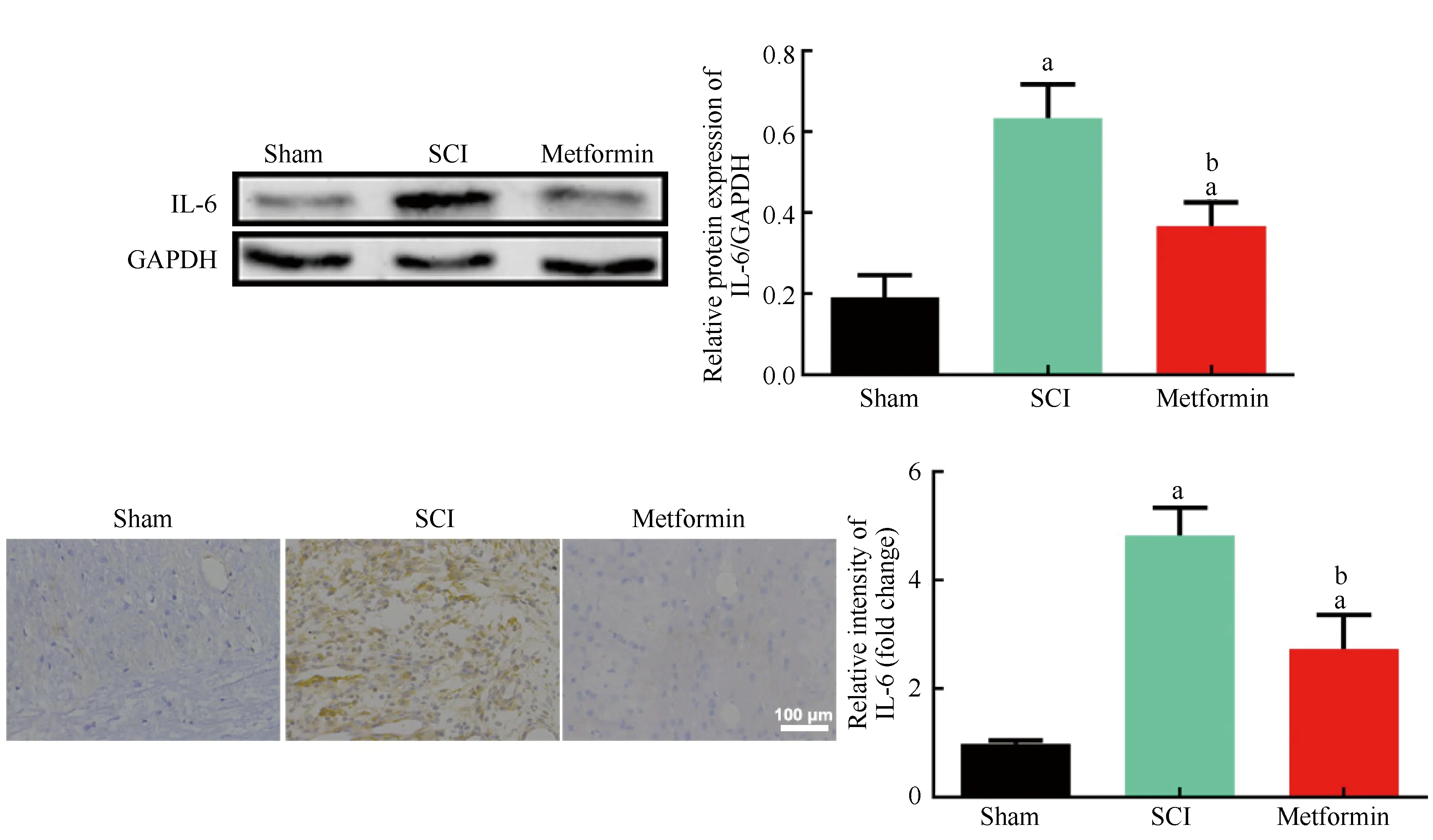
图2 二甲双胍治疗脊髓损伤小鼠的IL-6蛋白表达情况aP<0.05,与Sham组比较;bP<0.05,与SCI组比较
3 讨论
脊髓损伤是严重的中枢神经创伤性疾病,常导致携带电信号的神经根或有髓神经束的重大损伤[9]。SCI包括原发性和继发性损伤两个病理过程,而后者在脊髓损伤后的运动神经功能恢复过程中起到更加重要的作用,多由炎症反应、兴奋性神经递质释放增加、Ca2+过载与细胞自噬异常等因素引起[10-11]。而神经细胞自噬的调控和脊髓微环境的炎症应答更是影响着脊髓损伤后运动功能的恢复进程及预后结局[12-13]。但是,目前靶向脊髓损伤病理过程的相关分子机制还没有阐明。
自噬(autophagy)是细胞吞噬自身胞内蛋白或细胞器,被囊泡包裹后降解其所包含内容物的过程,通过这一降解过程以实现细胞本身的代谢需要并进行胞内特定细胞器的更新[14]。此外,自噬也是细胞调节自身稳态的重要病理的生理过程,不仅参与细胞死亡,还有细胞保护性作用[15]。自噬通路分为特异性自噬通路与非特异性自噬通路[16],而mTOR 蛋白是自噬的一种特异性经典蛋白,生理病理过程中抑制 mTOR 的活性,最终激活自噬,并促进自噬小体的生成[17-20]。本研究表明,给予二甲双胍可以明显抑制mTOR的表达,激活神经元自噬而促进功能恢复。
自噬通过参与蛋白质转换在神经元突触形成过程中发挥着重要的作用,异常的自噬活动会导致突触功能的失调[19]。生理条件下,突触可保证神经元有条不紊地接收传递储存信息,是神经环路的“枢纽”。同时,突触结构内的废物需及时清理才能维持正常的突触功能,但这样就会使得突触结构区域有着高耗能以及高蛋白更新率的状态[21]。神经炎症导致的神经元自噬形成不足,会造成许多蛋白降解的不完全和炎症反应过载反馈,常导致许多神经系统相关疾病,如自闭症、阿尔兹海默病和衰老等[21]。缺血后神经炎症通常被认为是神经功能的有害因素,并导致腹角运动神经元的进行性退化[2]。小胶质细胞是神经炎症反应中的主要效应细胞,负责清除死亡细胞及碎片,并与神经信号转导突触的消除和维持有关[18]。当被直接机械损伤等刺激触发时,活化的小胶质细胞在脊髓病灶中表达高水平的IL-6,并造成神经元的死亡[5]。研究证实,IL-6可以进一步增强局灶微环境的炎症水平,并加剧神经元死亡和功能障碍[5]。尽管已经有许多研究报道了自噬的激活和炎症的抑制可以促进中枢神经系统疾病的恢复,但到目前为止,在SCI 疾病中,炎症和自噬的相关性还没有阐明。
二甲双胍是一种临床应用的降糖药,已被证明可有效治疗阿尔兹海默症、脑中风及心血管等多种疾病[22]。研究发现,二甲双胍还可以降低IL-6的表达,并促进脊髓损伤恢复[8]。然而,二甲双胍对脊髓损伤的自噬作用尚未确定。鉴于脊髓损伤的预后在很大程度上是由神经元细胞和小胶质细胞主导的,并且二甲双胍已被证明对小胶质细胞的炎症激活具有抑制的作用。基于以上研究基础推测,脊髓损伤后二甲双胍可能通过抑制炎症促进神经元自噬和神经功能恢复。本实验研究中,小鼠脊髓损伤后7 d mTOR表达下调和IL-6表达上调,可以说明,急性期炎症和自噬参与了脊髓损伤的病理过程。术后腹腔注射二甲双胍7 d后,BMS评分升高,mTOR和IL-6表达明显下调,结果可知,二甲双胍可以促进自噬活动和抑制神经炎症,进而促进脊髓损伤后小鼠运动功能的好转。

