CLDN18.2在消化系统恶性肿瘤中作用的研究进展
王俏丽 综述;杜娟,2 审阅(.南京中医药大学中西医结合鼓楼临床医学院 肿瘤中心,江苏 南京 20000;2.南京大学医学院附属鼓楼医院 肿瘤中心,江苏 南京 20000)
消化系统肿瘤是最常见的一类恶性肿瘤,其发现时大多均已是中、晚期[1]。目前,除传统的化疗外,人表皮生长因子受体2(HER2)、表皮生长因子受体(EGFR)等靶点是消化系统恶性肿瘤靶向治疗的研究热点[2-3]。近年来,紧密连接蛋白claudin 18.2(CLDN18.2)在肿瘤靶向治疗中显现出一定的潜力,尤其是对胃癌、胰腺癌等实体瘤的治疗[4-6]。CLDN18是细胞旁紧密连接结构中的膜蛋白,人类CLDN18基因位于3q22 染色体上,全长35 kb,由于第一个外显子存在两个等位基因,蛋白表达有两个剪接变异体,分别是CLDN18.1(肺型)和CLDN18.2(胃型)[7]。其中,CLDN18.2 在正常组织中几乎不表达,仅在胃黏膜上皮细胞中表达,而在能分化出胃肠上皮细胞的胃干细胞区不表达,具有高度特异性。CLDN18.2 在多种人类恶性肿瘤中被激活,包括胃癌、食管癌和胰腺癌等,并且可以被单克隆抗体(monoclonal antibody,mAb)特异性靶向[8]。因此,对CLDN18.2在消化系统恶性肿瘤中的表达、作用机制,以及针对CLDN18.2阳性的靶向治疗等的认识,有助于为消化系统恶性肿瘤的治疗提供新的思路。
1 CLDN18.2在消化系统肿瘤组织中的表达分布
CLDN18.2在正常胃黏膜上皮细胞中呈高表达,在胃组织细胞的恶性转化过程中并未丢失[8],其在原发性胃腺癌中的表达情况在不同的研究中存在差异。COATI 等[9]在对523 例胃癌和胃-食管交界癌组织标本的研究中发现,CLDN18.2的表达差异与肿瘤位置、Lauren分类和EB病毒感染有关,胃体部肿瘤中表达水平高于胃窦部肿瘤(36.7%vs25.3%,P<0.05),弥漫型肿瘤中表达水平高于肠型(36.7%vs28.9%,P<0.01),EB 病毒阳性患者表达水平高于阴性患者(70%vs29%,P<0.01)。有研究结果[10-11]显示,CLDN18.2的表达还与年龄(<70岁)、肿瘤分期高、腹膜转移和肝转移发生率低,以及其他黏附连接分子有关;另有一些研究结果[9,12]显示,未发现CLDN18.2表达与种族、年龄、性别和肿瘤分期有关。
CLDN18.2经常在胰腺、食管和胆管癌变过程中异常激活。CLDN18在胰腺上皮内肿瘤、导管内状黏液肿瘤、黏液囊性肿瘤和胰腺导管腺癌中的表达,其中在胰腺导管腺癌中的表达率高达70%。而在正常胰管和腺泡细胞中未见CLDN18 的表达[13]。WÖLL等[14]研究显示,CLDN18.2 在胰腺导管癌中高表达,65.7%的胰腺癌肝转移病灶中表达CLDN18.2,69.4%的胰腺癌淋巴结转移病灶中表达CLDN18.2,说明在肿瘤转移过程中CLDN18.2表达并未减弱。
MOENTENICH 等[15]通过免疫组化检测发现,在485 例原发性食管腺癌中,18.4%的患者CLDN18.2蛋白表达阳性,且淋巴转移病灶与原发病灶中CLDN18.2表达水平相近;此外还发现,在HER2阳性肿瘤中CLDN18.2的表达显著降低(P<0.05)。目前,HER2阳性与CLDN18.2表达降低之间的关联及机制并不清楚,可能与肿瘤细胞紧密连接缺失有关。
目前尚不清楚CLDN18.2是否会对消化系统恶性肿瘤预后产生影响。WÖLL等[14]报道了CLDN18.2的激活和高表达与胰腺导管癌淋巴结转移阳性的不良因素呈正相关。然而,在一项大型的队列研究[10]和一项真实世界研究[16]中发现,CLDN18.2的表达与预后无关。研究结果的差异可能与样本种类、肿瘤分期等有关,还需进一步随机化研究,以明确其相关性。
2 CLDN18.2在消化系统恶性肿瘤组织中的表达调节
CLDN18.2在食管癌、胰腺癌等消化系统恶性肿瘤中表达上调,而其在胃癌组织中表达下调,但与其他类型的肿瘤相比,其表达水平仍然很高[17]。CLDN18.2的异常表达在肿瘤发生过程中的作用仍未完全清楚,目前认为其影响细胞旁的紧密连接、离子通透性以及致癌途径中的某些信号分子。在HAGEN等[18]构建的感染幽门螺杆菌的小鼠模型中,CLDN18表达下调增加了H+通透性、炎性细胞浸润和胃化生,从而导致上皮内瘤变与侵袭性肿瘤的发生。在食管正常鳞状上皮转变为Barrett食管柱状上皮的过程中,CLDN18表达上调能选择性地减少细胞旁阳离子(Na+和H+)的通透性,提高Barrett食管柱状上皮的耐酸性,从而促进肿瘤的形成[19]。CLDN18.2的表达还与整合素αvβ5、EpCAM细胞外结构域EpEX和溶菌酶呈正相关,而这些分子被证实能调节细胞生长周期、促进细胞迁移和增殖,CLDN18.2通过这种细胞依赖的方式参与肿瘤细胞的侵袭和转移[16,20-21]。CLDN18.2在肿瘤细胞中的表达可能受多种机制调节。目前的研究[21]发现,在胃癌细胞中PKC激活剂PMA可通过PKC/MAPK/AP-1通路激活CLDN18.2基因启动子,从而调控CLDN18.2蛋白表达。而在人胰腺癌细胞中,主要通过与正常胰腺细胞不同的PKC 信号通路对CLDN18.2在转录水平上进行调控,甲基化试剂5-aza-CdR可增强PKC激活剂TPA对CLDN18的上调作用,表明其表达过程还受到DNA甲基化的修饰[22]。
CLDN18 基因除异常表达外,还有可能与ARHGAP26基因之间的染色体易位,形成融合基因,诱导肿瘤的形成。融合基因阳性的上皮细胞表现出上皮-间质转化、细胞屏障受损、RHOA通路抑制,这可能导致胃H+渗漏,促进肿瘤细胞的侵袭性[23]。TANAKA等[24]研究发现,在CLDN18-ARHGAP融合基因阳性的肿瘤中,CLDN18也存在过度表达的现象,但该融合基因是否与CLDN18.2蛋白表达相关,是否适用CLDN18.2靶向治疗,还需要进一步研究[25]。
3 针对CLDN18.2阳性肿瘤的靶向治疗
CLDN18.2在消化系统恶性肿瘤中常异常激活并高表达,因此CLDN18.2被认为是消化系统恶性肿瘤治疗中的一个潜在靶点。目前,针对CLDN18.2阳性肿瘤的靶向治疗主要集中在个体化免疫治疗,包括mAb、CAR-T细胞、双特异性抗体(bispecific antibody,BsAb)和抗体药物偶联物(antibody-drug conjugate,ADC)等,研究结果令人欣喜,现已有多项研究进入临床试验阶段。
3.1 mAb
2008年,Ganymed 公司[8]首次报道了CLDN18.2作为mAb治疗靶点的可行性,同时研发出了能与CLDN18.2特异性结合的mAb,这一单抗在小鼠异种移植瘤模型中表现出强大的杀伤作用。后续的研究[5]证明,zolbetuximab(IMAB362)通过诱导抗体依赖性细胞毒(antibody-dependent cellular cytotoxicity,ADCC)和补体依赖性细胞毒(complement dependent cytotoxicity,CDC)发挥杀伤作用。同时,在一项Ⅰ期剂量递增的临床研究[26]中,15 例患者中有13 例(87%)至少出现过一次不良反应,其中有3 例(20%)患者出现3 级不良反应,不良反应可控,最常见的是消化系统毒性(如恶心、呕吐),但均未观察到剂量限制性毒性。以CLDN18.2 为靶点的mAb 治疗在消化系统恶性肿瘤中表现出的良好效果,使其成为研究热点,有力地推动了该单抗的后续临床研究。
一项关于zolbetuximab 的名为MONO 的Ⅱ期临床试验结果[27]显示,zolbetuximab 单药治疗的耐受性良好,疾病控制率达30%,在19 例CLDN18.2表达率≥70%的晚期胃癌或胃-食管交界腺癌患者中,有4 例患者(14%)部分缓解,5 例患者(17%)为病情稳定,证实了zolbetuximab的抗肿瘤活性及安全性。在一项临床前研究[5]中发现,化疗药如吉西他滨可增强zolbetuximab诱导的ADCC作用。之后的临床研究[28]也证实了这一点,受试者在接受zolbetuximab 联用EOX(表柔比星、奥沙利铂和卡培他滨)治疗后,中位无进展生存期达7.5 个月(EOX 组为5.3 个月),中位总生存期达13 个月(EOX 组为8.3 个月),结果表明,zolbetuximab可能是化疗的有效补充。此外,还有两项比较zolbetuximab 联合化疗与单独使用一线化疗疗效的临床试验已经启动;一项是比较zolbetuximab联合mFOLFOX6(5-氟尿嘧啶、亚叶酸钙和奥沙利铂)和安慰剂联合mFOLFOX6 在CLDN18.2 阳性、HER2阴性、局部晚期不可切除或转移性胃或胃-食管交界腺癌受试者中的疗效(NCT03504397);另一项是评估zolbetuximab与AG(白蛋白结合型紫杉醇+吉西他滨)联用在CLDN18.2 阳性、转移性胰腺癌受试者中的疗效和安全性(NCT03816163)。zolbetuximab通过CDC 和ADCC 作用发挥其抑制肿瘤生长的作用。因此,除与化疗药物联用外,zolbetuximab 与免疫检查点抑制剂联用也值得深入研究。
Zolbetuximab与抗肿瘤药物联用影响疗效外,还受肿瘤CLDN18.2的表达水平对zolbetuximab的疗效有一定影响,在CLDN18.2高表达(CLDN18.2表达率≥70%,强度≥2+)患者的无病生存期(7.2vs5.6 个月;HR=0.36;P<0.01)和总生存期(9.0vs16.7 个月;HR=0.45,P<0.01)可显著获益[29]。除zolbetuximab外,目前还有多个针对CLDN18.2 阳性肿瘤患者的mAb 已进入临床研究试验阶段(表1)。
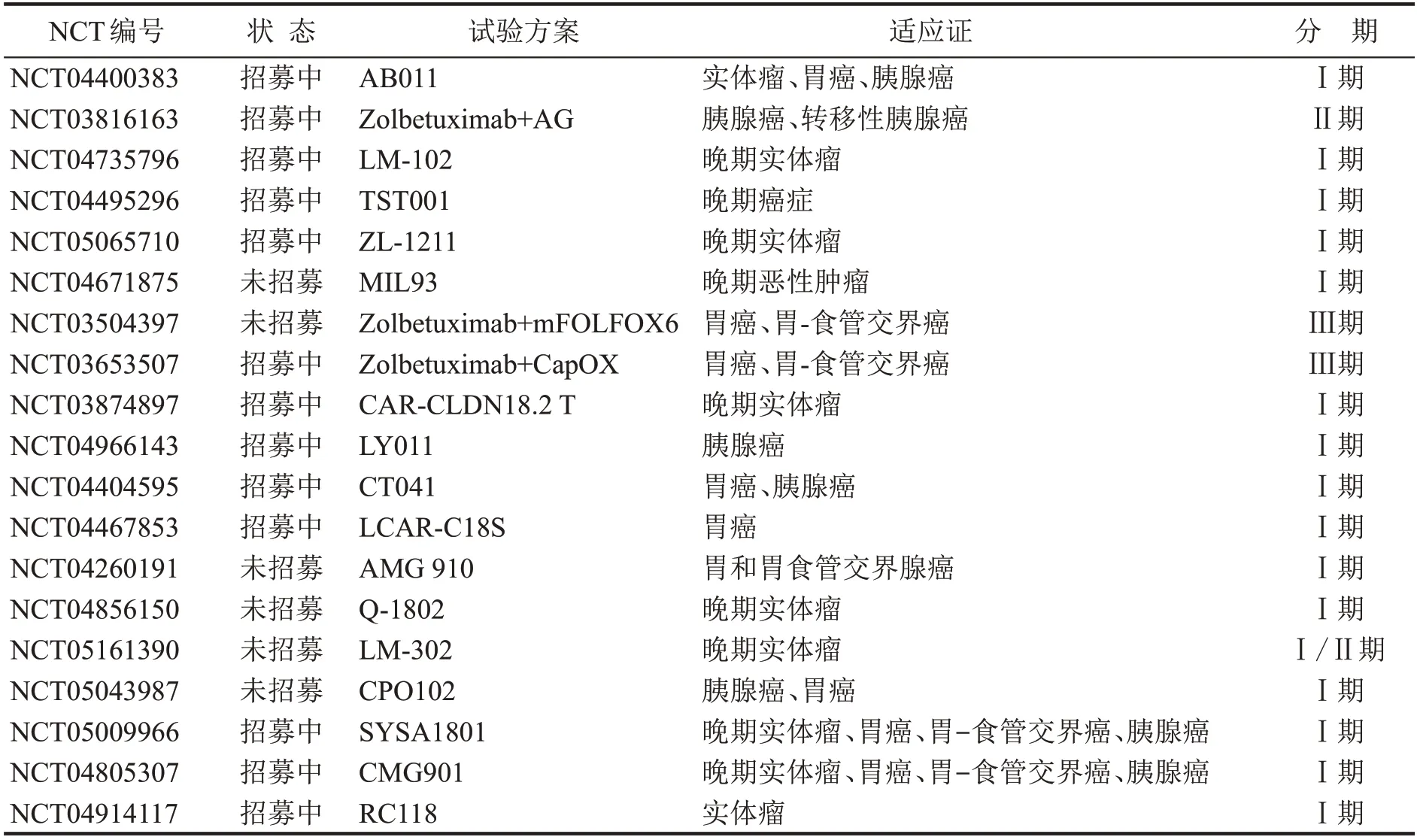
表1 目前正在进行的针对CLDN18.2阳性消化系统恶性肿瘤的临床试验*
3.2 CAR-T细胞治疗
CAR-T细胞治疗在血液系统恶性肿瘤中取得显著疗效,在部分实体瘤的研究中也表现出良好的治疗效果[30],其中包括CLDN18.2 阳性的消化系统恶性肿瘤。JIANG 等[31]成功开发了人源化CLDN18.2特异性hu8E5和hu8E5-2i单链片段(ScFv),并制备了CLDN18.2特异性CAR-T细胞,研究发现其能有效地抑制异种移植瘤小鼠模型的肿瘤生长,且对其他正常组织无明显损伤。除在T 细胞上进行CLDN18.2特异性识别位点的改造外,还有研究者[32]在CLDN18.2 特异性CAR-T 细胞加入细胞因子IL-7 和CCL-21,以提高CAR-T 细胞的抗肿瘤活性。QI 等[33]已公布的Ⅰ期临床试验数据显示,在接受CAR-T细胞治疗的37例CLDN18.2阳性消化系统恶性肿瘤患者中,客观缓解率高达48.6%,其中18例胃癌患者均出现3级以上的血液学毒性,但均未观察到剂量限制性毒性,显示了CAR-T细胞在治疗CLDN18.2阳性消化系统恶性肿瘤的抗肿瘤活性和安全性。目前,多项不同方法改造的CAR-T细胞治疗的临床试验正在进行中。因此,CAR-T细胞治疗有望成为包括胃癌、胰腺癌等实体肿瘤的有效治疗策略。
3.3 BsAb和ADC
BsAb是指具有两种特异性抗原结合位点的抗体,可以将T细胞重定向到肿瘤靶抗原并诱导T细胞介导的细胞杀伤作用[34]。ZHU等[35]设计的靶向CLDN18.2的CD3 BsAb,对胃癌和胰腺癌细胞具有体外杀伤作用,并能抑制胰腺和胃源性移植瘤的生长,此外研究者合成的靶向CLDN18.2 ADC也具有相似的抗肿瘤作用。LIANG等[36]设计合成了抗CLDN18.2-CD28 BsAb,体内外实验结果均说明抗CLDN18.2-CD28的治疗可以减轻肿瘤负荷,增加肿瘤浸润的T细胞,减少免疫抑制细胞,且无全身不良反应。虽然,目前关于不同BsAb的研究均表现出抗肿瘤活性,也有研究[37]指出CD3 BsAb缺乏对肿瘤抗原特异性T细胞的选择,且有报道部分CD3 BsAb可诱导严重的细胞因子释放综合征和其他副作用,因此对于CLDN18.2 BsAb的设计及安全性还需进一步研究。
3.4 其他
KLAMP等[38]设计嵌合的乙型肝炎病毒核心抗原(hepatitis B virus core antigen,HBcAg)-VLP,标记有特异性CLDN18.2的表面表位,两侧有一个增加流动性的连接子。在小鼠和兔中使用嵌合HBcAgCLDN18.2-VLP,可免疫诱导自身产生抗体,通过CDC和ADCC有效地杀伤表达CLDN18.2的细胞,其在诱导自身抗体方面明显优于肿瘤细胞表面CLDN18.2蛋白诱导的自身抗体。因此,预防性接种CLDN-Link-VLP对高度恶性/致瘤性CT26-CLDN18.2细胞具有部分保护作用。肿瘤疫苗是近年来新兴的研究热点,但针对CLDN18.2的重组病毒疫苗的研究还十分有限。此外,还有一项针对CLDN18.2阳性肿瘤的mRNA疗法的临床试验也正在招募中。
除对CLDN18.2 治疗靶向治疗药物的研究外,基于CLDN18.2 的肿瘤特异性成像检测为CLDN18.2阳性肿瘤的诊断治疗提供指导。带有89Zr 标记的CLDN18.2 特异性抗体,能高效稳定地对胃癌中的CLDN18.2 的表达进行成像和定量[39]。ZHAO 等[40]用124I、Cy5.5 和FD1080 修饰CLDN18.2 特异性抗体,这种新型的CLDN18.2 靶向探针可以协助临床医生通过免疫PET 成像、近红外成像定位肿瘤并指导CLDN18.2 阳性肿瘤的手术,这些研究的进行为CLDN18.2阳性肿瘤的靶向治疗提供了支持。
4 结语
在精准医疗时代,肿瘤靶点的发现作为肿瘤治疗的重要环节。CLDN18.2 在正常组织中特异性表达,且在部分消化系统恶性肿瘤组织中高表达,因此是消化系统恶性肿瘤治疗的潜在靶点,但目前对CLDN18.2 在肿瘤发生与发展中的具体机制及其对患者预后的影响尚不清楚,还有待深入研究。已有多项针对CLDN18.2 阳性的肿瘤治疗药物及方案进入临床研究阶段,已完成的CLDN18.2的临床研究大多集中在胃癌及胃-食管交界癌中;CLDN18.2同样在胰腺癌中高表达,这为胰腺癌靶向治疗提供了除KRAS 外又一新的选择。近年来对CLDN18.2 阳性胰腺癌患者治疗的临床研究也在逐步开展中,相信在未来CLDN18.2或将成为胃癌、食管癌和胰腺癌治疗的重要靶点。

