一线晚期肺腺癌治疗中PD-1抗体联合化疗和抗血管生成药物联合化疗的对比研究
段玉青,夏宁,贾云泷,吕微,王郁,王佳丽,王雪晓,刘天旭,刘丽华(河北医科大学第四医院 肿瘤免疫科,河北石家庄050035)
肺癌是中国恶性肿瘤患者病死的首要原因[1]。肺癌的病理类型主要分为非小细胞肺癌(non-small cell lung cancer,NSCLC)和小细胞肺癌[2],在NSCLC中肺腺癌占半数以上。NSCLC 恶性程度较高,70%的患者在确诊时已有远处转移[3]。表皮生长因子受体(EGFR)酪氨酸激酶抑制剂开启了EGFR 敏感突变肺癌的靶向治疗时代[4]。对于驱动基因阴性晚期肺腺癌,含铂双药化疗是标准一线治疗,但对于生存的改善极为有限。抗血管生成治疗率先打破了晚期NSCLC 患者的治疗困境,抗血管生成药物联合含铂双药方案的应用明显改善了肺癌患者的生存,奠定了联合用药在一线治疗中的优势地位[5-6]。近年来免疫检查点抑制剂(immune checkpoint inhibitor,ICI)为晚期驱动基因阴性的NSCLC治疗带来重大突破[7-10],多项RCT研究[11-14]证实,PD-1抗体联合含铂双药可给肺癌患者带来明显的生存获益,已成为晚期肺癌一线治疗选择。目前驱动基因阴性晚期肺癌一线治疗选择方案较多,多种联合治疗模式以及获益人群和安全性仍在不断的探索中。但是并没有PD-1 抗体联合化疗头对头比较抗血管生成药物联合化疗一线在驱动基因阴性晚期肺腺癌中的相关研究。因此,本研究通过对141 例EGFR、ALK 驱动基因阴性晚期肺腺癌患者进行回顾性分析,探讨PD-1抗体联合化疗对比抗血管生成药物联合化疗一线治疗晚期肺腺癌的有效性和安全性,为晚期肺腺癌的一线临床治疗提供新的选择。
1 资料与方法
1.1 临床资料
收集2018 年03 月至2021 年08 月就诊于河北医科大学第四医院的肺腺癌患者。病例纳入标准:(1)经病理学确诊为肺腺癌;(2)根据第八版肺癌TNM 分期,临床分期为不可手术的ⅢB、ⅢC及Ⅳ期;(3)按照RECIST1.1 疗效评价标准,至少有1处可测量病灶;(4)ECOG 评分0~1 分;(5)年龄≥18 岁且<78 岁;(6)预计生存时间≥3 个月;(6)临床资料完整,包括姓名、年龄、病历资料、治疗过程、随访信息等。病例排除标准:(1)无可测量病灶或病灶不可评估者;(2)EGFR 和ALK 突变患者;(3)同时存在其他恶性肿瘤病史者;(4)患有严重的未控制的内科疾病或急性感染者;(5)合并严重的心、肝、肾等重要器官功能障碍者;(6)伴有自身免疫功能缺陷者;(7)既往有明确的神经或精神障碍史者。所有患者均接受化疗联合PD-1抗体或化疗联合抗血管生成药物治疗。研究方案获得河北医科大学第四医院伦理委员会批准(批准号:2018M1C111)。
1.2 治疗方法
根据药物的使用情况,将患者分为PD-1抗体联合化疗组(A 组)、抗血管生成药物联合化疗组(B 组),A 组具体用药方案:培美曲塞(500 mg/m2)+卡铂(AUC=5)+PD-1 抗体(帕博利珠单抗200 mg,或信迪利单抗200 mg,或替雷利珠单抗200 mg),第1天静脉滴注;该方案每21 d重复。B组具体用药方案:培美曲塞(500 mg/m2)+卡铂(AUC=5)+贝伐珠单抗7.5 mg/kg,第1 天静脉滴注;该方案每21 d重复。
1.3 疗效评价
根据实体瘤疗效评价标准1.1版(RECIST1.1)对肿瘤客观缓解进行分类,包括完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)。每6 周进行一次疗效评价。本研究主要观察指标为无进展生存期(PFS),次要观察指标为客观缓解率(ORR)、疾病控制率DCR)和总生存期(OS)。ORR=(CR+PR)例数/总例数×100%。DCR=(CR+PR+SD)例数/总例数×100%。
1.4 安全性
本研究次要观察指标包括治疗方案的安全性,采用常见不良事件评价标准(CTCAE)5.0 进行毒性反应评价。
1.5 随访
本研究随访主要通过查阅患者住院病历资料以及电话询问的方式,随访时间截至2022年3月31日。随访内容包括:患者的一般情况、血常规、肝功能、肾功能、甲状腺功能、垂体功能等指标、复查情况、药物依存性、治疗期间不良反应、患者疗效评估等信息。PFS 定义为治疗开始日期至第1 次发生PD,OS 定义为治疗方案开始日期至任何原因死亡发生时间。
1.6 统计学处理
采用SPSS 26.0 软件对数据进行统计分析,计数资料采用χ2检验进行分析。采用Kaplan-Meier 法进行生存分析,并进行Log-Rank检验,以P<0.05或P<0.01为差异有统计学意义。
2 结果
2.1 肺腺癌患者的临床特征
本研究共纳入141 例肺腺癌患者,A 组57 例、B组84 例。其中,A 组男性37 例(64.91%),女性20 例(35.09%);年龄46~76岁,平均(62.95±6.66)岁;B 组男性60例(71.43%),女性24例(28.57%);年龄42~78岁,平均(59.79±9.65)岁。两组患者临床基线临床特征比较,差异均无统计学意义(均P>0.05,表1)。

表1 两组肺腺癌患者的临床特征比较[n(%)]
2.2 肺腺癌患者的近期疗效
依据RECIST1.1 标准评价治疗效果。141 例患者中,CR 0例,PR 42例,SD 87例,ORR 为29.79%(42/141),DCR 为91.49%(129/141)。其 中A 组CR 0例,PR 19例,SD 37 例;B 组CR 0例,PR 23例,SD 52 例;两组ORR、DCR 比较差异均无统计学意义(33.33%vs27.38%,χ2=0.326,P=0.568;98.25%vs89.29%,χ2=2.889,P=0.089)。
根据不同临床参数对两组的ORR 与DCR 进行分层分析结果(表2)显示,患者性别、年龄、吸烟史、高血压、BMI、ECOG 评分、脑和肝转移均不对ORR和DCR 产生影响(均P>0.05)。10 例(7.09%)患者在给药1 个周期后因PD 而停止治疗,其中A 组1例,B组9例。
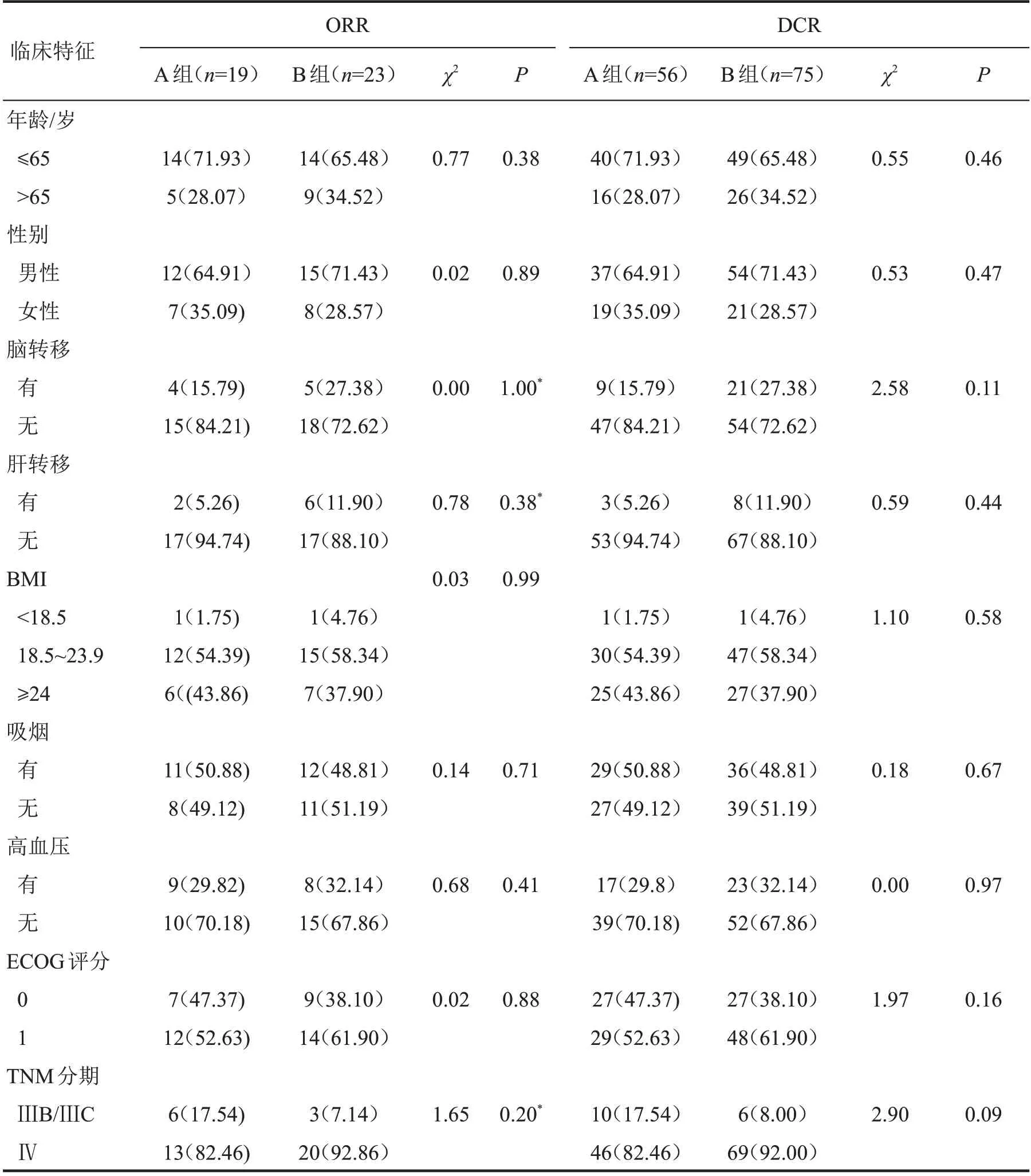
表2 两组肺腺癌患者的ORR和DCR影响因素分层分析结果[n(%)]
2.3 肺腺癌患者的远期疗效
141例患者的中位随访时间为13.0个月(95%CI:12.0~14.0)。Kaplan-Meier 生存分析结果(图1)显示,全体患者的中位PFS为7.0个月(95%CI:6.8~8.3)。A 组的中位PFS 为8.4 个月(95%CI: 7.3~9.9),B 组的中位PFS 为6.9 个月(95%CI:6.1~7.7,P=0.08)。
依据临床特征分层分析结果(图1)显示:(1)141 例患者中,ⅢB/ⅢC 期和Ⅳ期患者中位PFS 分别为10.5 个月(95%CI: 6.7~14.3)和7 个月(95%CI:6.3~7.7,P=0.03)。其中,A组和B组ⅢB/ⅢC期患者的中位PFS 分别为10.5 个月(95%CI: 3.8~17.2)和8.5 个月(95%CI: 3.6~13.4;P=0.007)。(2)141 例患者中,肝转移和无肝转移患者中位PFS 为分别5.5 个月(95%CI:3.5~7.5)和7.6 个月(95%CI: 6.7~8.5,P=0.01)。其中,A 组和B 组肝转移患者的中位PFS 分别为8.4 个月(95%CI: 7.3~9.9)和6.9 个月(95%CI:5.6~8.2,P=0.012)。(3)全体患者中脑转移患者和无脑转移患者的中位PFS 为分别为7.0 个月(95%CI:6.8~7.2)和7.6 个月(95%CI:6.7~8.5,P=0.83),其中,A组和B组脑转移患者的中位PFS分别为9.2 个月(95%CI:4.2~5.8)和6.9 个月(95%CI:3.4~9.2,P=0.000 1)。
2.4 肺腺癌患者的不良反应
根据CTCAE 5.0 标准对治疗期间患者出现的不良反应进行记录。两组最常见的不良反应包括:恶心/呕吐、白细胞减少、中性粒细胞减少、血小板减少、贫血和乏力与化疗药物培美曲塞和铂类有关(表3)。A 组免疫相关不良反应发生率为26.32%,包括皮疹瘙痒3例、甲状腺功能异常4 例、肺炎4 例、垂体炎3 例、肾上腺功能减退1例,均为1~2级不良反应;B组血管靶向药物不良反应发生率为14.29%,包括高血压6例(其中1 例为4 级)、出血4 例、蛋白尿1例,均为1~2 级不良反应。多数患者均可在对症治疗或停药后症状缓解,且治疗期间并未发生新的安全事件。

表3 两组患者的不良反应发生率比较[n(%)]
3 讨论
近年来,血管靶向药物[5,15]和免疫检查点抑制剂[16-18]的应用改变了驱动基因阴性晚期肺腺癌患者的整体治疗格局。既往临床试验结果[6,11]显示,与含铂化疗相比,化疗联合PD-1 抗体或化疗联合抗血管药物治疗均能显著改善晚期肺腺癌患者的PFS 和OS,提高患者的整体预后水平。然而,以上研究并未明确多种联合治疗模式的优势人群。本研究回顾性地分析PD-1抗体联合化疗对比抗血管生成药物联合化疗一线治疗驱动基因阴性晚期肺腺癌在真实世界中的疗效和安全性,旨在为晚期肺腺癌患者的一线治疗方案的选择提供更多的临床证据。
本研究共纳入141 例肺腺癌患者,在此次回顾性研究中,32 例(22.7%)患者获得CR+PR,所有患者中位PFS 为7 个月,中位OS 未达。近期临床疗效显示,PD-1抗体联合化疗组ORR和DCR均高于抗血管生成药物联合化疗组,但差异均无统计学意义。进一步对两组患者的临床参数进行分层分析,结果显示患者性别、年龄、吸烟史、高血压、BMI、ECOG 评分、脑和肝转移均不对ORR 和DCR 产生影响。远期临床疗效显示,PD-1 抗体联合化疗组的中位PFS 为8.4 个月,抗血管生成药物联合化疗组的中位PFS为6.9个月,PFS有延长趋势,但差异无统计学意义。既往的临床研究(KEYNOTE-189)显示,PD-1抗体联合化疗组PFS 为9.0 个月(95%CI:8.1~10.4),但PATEL 等[19]的研究结果显示,培美曲塞联合铂类联合贝伐珠单抗的PFS 为6.04 个月。本研究中数据与以上的临床试验研究结果相似,进一步在真实世界中证实了治疗方案的有效性和可及性。本研究中患者接受PD-1抗体联合化疗治疗的中位PFS与抗血管生成药物联合化疗的效果相当。因此,考虑到目前PD-1 抗体的可及性及医保因素,PD-1 抗体联合化疗有望成为肺腺癌患者的优选方案。
另外,研究纳入了不可手术的ⅢB/ⅢC 期以及Ⅳ期肺腺癌患者,ⅢB/ⅢC 期患者的中位PFS 显著长于Ⅳ期患者(10.5vs7.0 个月,P<0.01)。进一步分析结果显示,ⅢB/ⅢC期患者PD-1抗体联合化疗组中位PFS较抗血管生成药物联合化疗组延长2个月,表明ⅢB/ⅢC 期肺腺癌患者预后明显优于Ⅳ期期肺腺癌,且在ⅢB/ⅢC期患者中PD-1抗体联合化疗方案可作为优先选择。晚期肺腺癌易出现肝转移,且肝转移患者预后比其他部位转移的患者预后更差[20]。本研究中141例患者中肝转移患者的中位PFS 为5.5 个月,无肝转移患者的中位PFS 为7.6 个月,证实肺腺癌肝转移患者临床预后差。进一步研究结果表明,肝转移患者中PD-1 抗体联合化疗组中位PFS较抗血管生成药物联合化疗组延长,此亚组样本量小,仍需进一步验证,但部分肝转移患者可从PD-1 抗体联合化疗治疗中明显获益,这可能是肺腺癌肝转移患者的一种有效治疗方式,值得深入探索。另外,肺腺癌具有高度的中枢神经侵犯性,24%~44%的晚期肺腺癌患者出现脑转移,预后不良[21-22]。本研究中PD-1 抗体联合化疗组脑转移患者的中位PFS较抗血管生成药物联合化疗组延长2.3个月,提示PD-1 抗体联合化疗方案在肺腺癌脑转移中可使一部分患者获益。但由于本研究中这部分患者样本量较少,仍需大样本研究结果证实。
药物不良反应也是本研究的重要观察指标。本研究结果显示,恶心/呕吐、白细胞减少、中性粒细胞减少、血小板减少、贫血和乏力等为最常见的不良反应,考虑与化疗药物有关。在接受联合抗血管药物治疗的患者中,高血压和出血的患者更常见。在接受联合PD-1 抗体方案治疗的晚期肺腺癌患者中,发生甲状腺功能异常、肺炎、垂体炎、肾上腺皮质功能减退等免疫检查点抑制剂相关不良反应更常见。总之,本研究两组治疗相关的不良反应多数为1~2级,总体安全性较好。
综上所述,本研究结果表明,PD-1抗体联合化疗与抗血管生成药物联合化疗在驱动基因阴性晚期肺腺癌一线治疗中疗效相当高,亚组分析结果提示,PD-1抗体联合化疗方案在ⅢB/ⅢC期以及肝、脑转移患者中可能更有效,但其潜在机制尚需进一步探索。由于本研究为回顾性研究,纳入的病例数量较少,需要更大的样本量进行前瞻性临床研究,进一步为驱动基因阴性晚期肺腺癌一线治疗选择提供更多的高级别循证医学依据。

