奶牛乳腺炎模型的建立及炎症相关因子基因mRNA转录水平的分析
罗仍卓么,王晋鹏,焦 鹏,李彦霞,董益闻,魏大为,王兴平*
(1.宁夏大学农学院,银川 750021; 2.宁夏回族自治区反刍动物分子细胞育种重点实验室,银川 750021)
奶牛乳腺炎是一种由细菌等病原体引起的乳腺疾病,可导致奶牛产奶量下降、兽医护理费用增加和死淘率上升,从而影响奶牛场的经济效益。金黄色葡萄球菌()和大肠杆菌()是引起乳腺炎的主要致病菌,其中,为革兰阴性菌,其感染经常会引起急性、症状严重的临床乳腺炎,甚至会引起奶牛死亡;而是引起乳腺炎的最常见的革兰阳性菌,可在乳腺吞噬细胞中存活,逃避乳腺免疫系统的杀伤,因此感染奶牛乳腺组织后很难被机体清除,也极易产生耐药性,常常会引起难以治愈的亚临床隐性乳腺炎。上述两种细菌具有不同的病原体相关分子模式,引起的奶牛乳腺炎具有不完全相同的临床症状。因此,和也分别作为引起临床和亚临床乳腺炎的主要病原体,用于乳腺炎活体模型的制备。在基因表达方面,感染奶牛可立即激活促炎因子基因的表达,而感染的反应较为缓慢,其引起炎症因子基因的表达程度较低。但是,乳腺炎相关的差异表达基因有很多,在型和型乳腺炎中,仍有很多基因的表达情况尚不清楚,有待于进一步探讨。
作者前期通过乳腺炎奶牛乳腺组织的转录组测序分析,初步获得了趋化因子家族的C-C基序趋化因子配体2(C-C motif chemokine ligand 2,2)、C-C基序趋化因子配体8(C-C motif chemokine ligand 8,8)、C-X-C基序趋化因子受体1(C-X-C motif chemokine receptor 1,1)、C-X-C基序趋化因子2(C-X-C motif chemokine 2,2)、C-X-C基序趋化因子13(C-X-C motif chemokine 13,13)、补体因子Ⅰ(complement factor I,Ⅰ)、补体因子B(complement factor B,)、自噬调节因子孕酮诱导的蜕膜蛋白1(decidual protein induced by progesterone 1,1)和白细胞介素21受体(interleukin 21 receptor,21)共9个候选基因,但是它们在型和型乳腺炎奶牛的乳腺组织中的mRNA转录水平尚不完全清楚。因此,本研究建立了型和型奶牛乳腺炎活体模型,检测了上述9个基因在对照组和诱导组奶牛乳腺组织中的mRNA转录水平,以期为深入研究不同类型乳腺炎的分子调控机制提供参考。
1 材料与方法
1.1 主要试剂与仪器
(ATCC 25923)和(ATCC 25922)冻干粉购自上海复祥生物科技有限公司;逆转录试剂盒(货号RR047A)、荧光定量试剂盒TB Green Premix Ex Taq II (Tli RNaseH Plus) (货号RR820A)和TriZol试剂均购自TaKaRa宝日医生物技术(北京)有限公司;TLR4抗体(sc-29372)、TNFα抗体(sc-133192)、NF-κB p50抗体(sc-8414)和羊抗兔IgG-HRP(sc-2030)均购自圣克鲁斯生物技术(上海)有限公司;Synergy LX多功能酶标仪购自BioTek(美国);CFX 96 Touch荧光定量PCR仪均购自Bio-Rad公司(美国)。
1.2 试验动物
购于同一饲养条件、处于泌乳盛期的2~3岁 头胎荷斯坦奶牛。所有奶牛泌乳周期相同,体况健康,牛奶体细胞数(somatic cell count,SCC)<20万·mL。 随机分为对照组、诱导组和诱导组,每组各3头。
1.3 奶牛乳腺炎活体模型的建立
为消除由于奶牛可能有其他炎症性疾病而引起的试验误差,给奶牛注射抗生素7 d进行平衡处理。然后继续饲养21 d以消除抗生素残留,使奶牛达到体况良好,无炎症且牛奶SCC<20万·mL。
将和冻干粉溶解、划线接种、挑取单菌落和扩大培养,用PBS稀释至10CFU·mL的接种密度。清洁奶牛乳房和乳头,75%乙醇消毒,用通乳针将5 mL 1×10CFU·mL的和悬浮液经乳导管分别一次性注入到试验组奶牛乳房的右后乳区内,对照组奶牛注射等量的无菌PBS。在接种后的第7天,采用无菌手术法活体采集奶牛的乳腺组织,用于乳腺炎病理鉴定和组织RNA提取。
1.4 乳腺炎奶牛模型的鉴定
1.4.1 临床诊断和组织病理检测 奶牛乳腺感染细菌后,测定奶牛体温和牛奶SCC,并诊断奶牛感染后的临床症状。此外,将采集到的乳腺组织经过石蜡包埋、组织切片、苏木精-伊红(hematoxylin-eosin,HE)染色和显微拍照,观察对照组、诱导组和诱导组奶牛乳腺组织的病理变化。
1.4.2 乳腺组织免疫相关蛋白质的检测 Toll样受体4(toll-like receptor 4,TLR4)/ 核因子激活的B细胞的κ-轻链增强子(nuclear factor kappa light chain enhancer of activated B cells,NF-κB)信号通路在动物固有免疫和炎症反应中具有重要的作用。为了验证奶牛乳腺炎模型的构建结果,本试验采用组织免疫荧光技术检测了对照组、诱导组和诱导组奶牛乳腺组织中TLR4/NF-κB信号通路关键分子TLR4、NF-κB和肿瘤坏死因子α(tumor necrosis factor alpha,TNFα)的表达水平,采用Image J软件进行表达量统计,-检验进行差异表达显著性检验。
1.5 RNA提取与qPCR
1.5.1 RNA提取与cDNA合成 采用TRIzoL法提取对照组、诱导组和诱导组奶牛乳腺组织的总RNA,利用多功能酶标仪检测RNA的纯度(OD/OD≥1.8;OD/OD≥1.0)和浓度(总RNA浓度≥800 ng·μL)。按照逆转录试剂盒说明书,以经检测合格的1 000 ng RNA为模板,进行逆转录PCR,获得cDNA。
1.5.2 qPCR引物 根据GenBank公布的基因序列,利用Primer Premier 5.0软件设计qPCR引物(表1)。引物由通用生物系统(安徽)有限公司合成,无菌超纯水溶解。
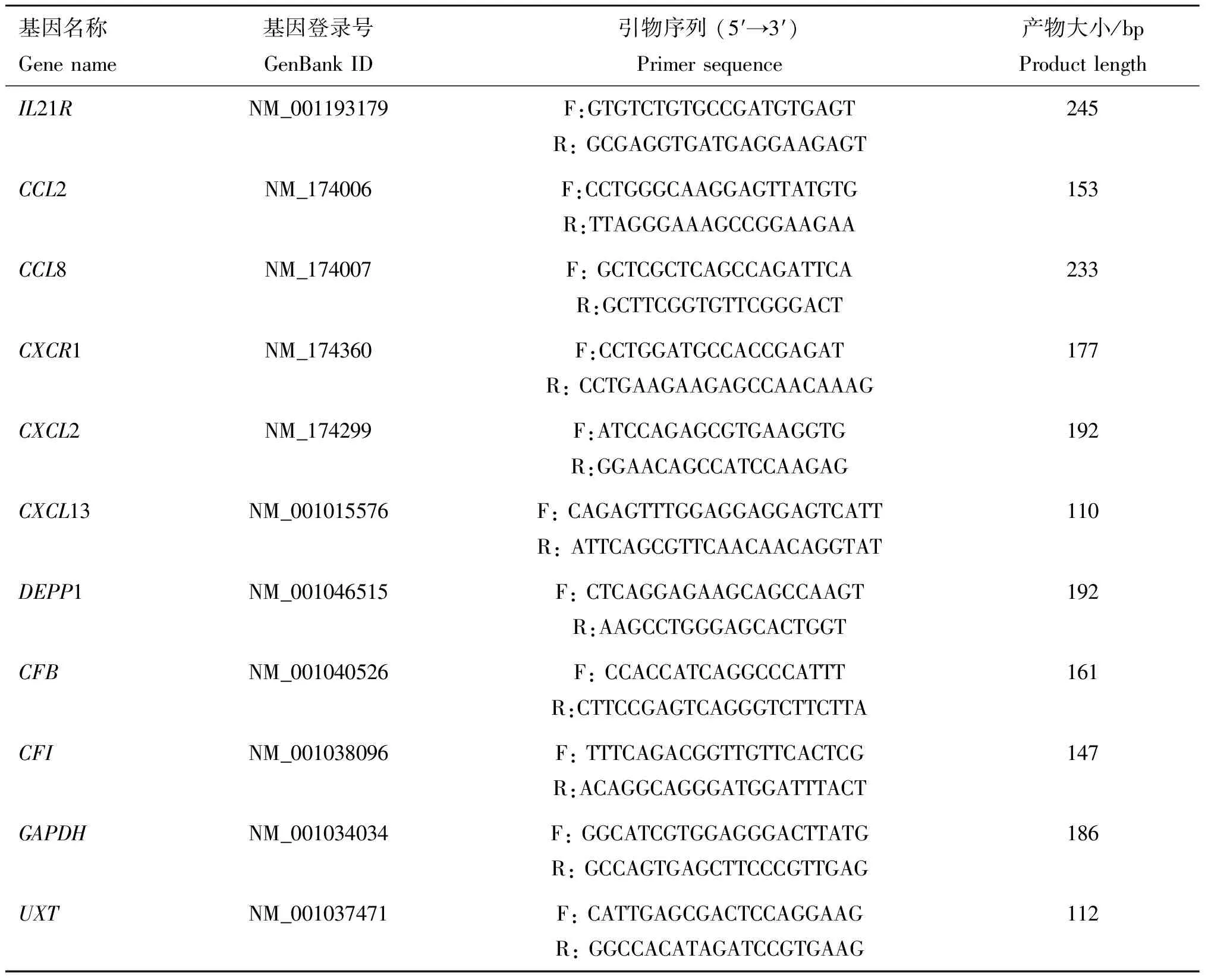
表1 qPCR引物信息
1.5.3 qPCR反应 分别以对照组、诱导组和诱导组奶牛乳腺组织的cDNA为模板,利用qPCR试剂盒进行相关基因mRNA转录水平的检测。qPCR反应体系为2×TB Green Premix ExⅡ 10 μL,上、下游引物各0.8 μL,cDNA模板100 ng,加无菌无酶的ddHO至20 μL。 qPCR反应程序:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s,共40个循环;95 ℃ 10 s,65 ℃ 5 s。每个检测进行3次重复。
1.5.4 统计分析 以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,)和前折叠蛋白样伴侣(ubiquitously expressed prefoldin like chaperone transcript,)作为内参,采用2-△△方法计算基因的相对表达量。利用GraphPad Prism 8.0软件,通过单因素方差分析法进行组间基因表达量的差异显著性检验,<0.01表示差异极显著。
2 结 果
2.1 奶牛乳腺炎模型的建立
2.1.1 乳腺炎临床检查 用和分别感染奶牛乳房,在感染1 d后,两个感染组奶牛体温明显升高,在第4、5天达到40 ℃左右,并表现出典型的乳腺炎临床症状:乳头发红、肿胀、疼痛、发热和牛奶产生絮状沉淀。其中,组在第4、5天时奶样絮状严重,乳汁变清水样,第7天乳房出现结块。组反应较激烈,在第3天时奶样出现豆渣样,第4天乳清变黄色,第5天乳房出现结块,第6天牛开始出现下痢,粪便呈灰绿色。第3天以后,两组牛的奶样体细胞数大于90万·mL, 且产奶量显著下降,到第6~7天出现停乳。上述诊断结果显示,奶牛已产生严重的乳腺炎。
2.1.2 乳腺组织病理鉴定 乳腺组织HE病理观察结果表明,与对照组相比,诱导组和诱导组奶牛的乳腺小叶结构破坏,乳腺腺泡受损,腺泡腔减小,部分乳腺上皮细胞的形态发生变化,并出现中性粒细胞和巨噬细胞等炎性细胞浸润(图1)。
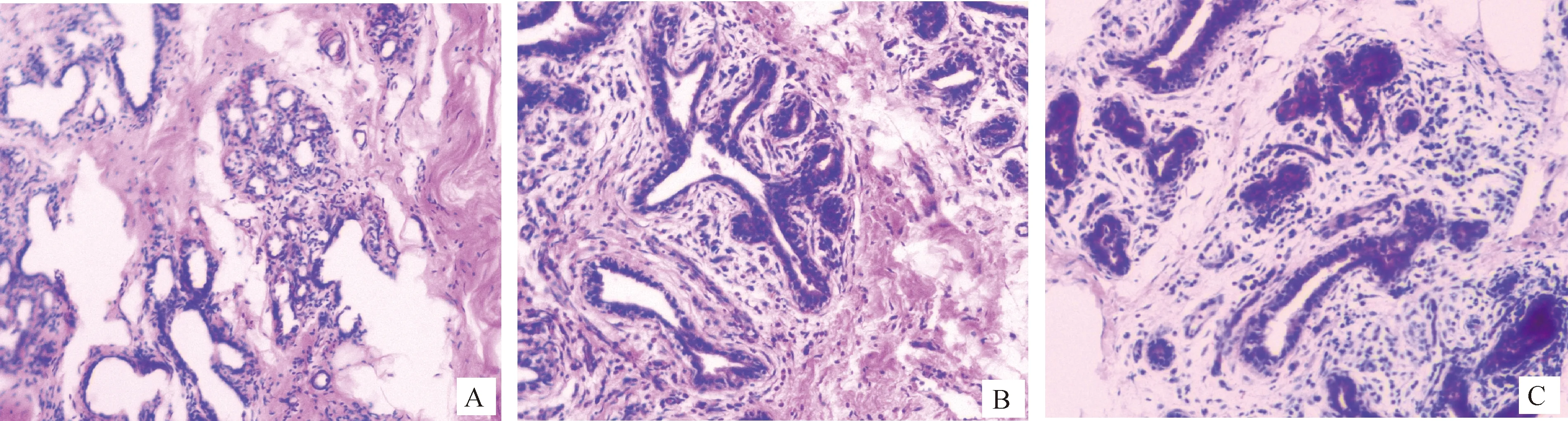
A. 对照组;B. S. aureus诱导组;C. E. coli诱导组A. Control group; B. S. aureus-induced group; C. E. coli-induced group图1 乳腺组织的HE染色(100×)Fig.1 HE staining of mammary gland tissue (100×)
2.1.3 TLR4/NF-κB信号通路关键分子的表达量检测 TLR4、NF-κB和TNF-α是TLR4/NF-κB固有免疫和炎症信号通路的关键分子。为验证奶牛乳腺炎模型的可靠性,采用组织免疫荧光技术检测了它们在对照组、诱导组和诱导组中的表达情况,结果表明,与对照组相比,诱导组和诱导组奶牛乳腺组织的TLR4、NF-κB和TNF-α蛋白质的表达水平均极显著上调(<0.01)(图2),说明了和可使奶牛乳腺组织启动TLR4/NF-κB固有免疫信号通路,并产生了炎症反应。上述结果从蛋白质水平上说明了本试验所建立的乳腺炎模型是可靠的。
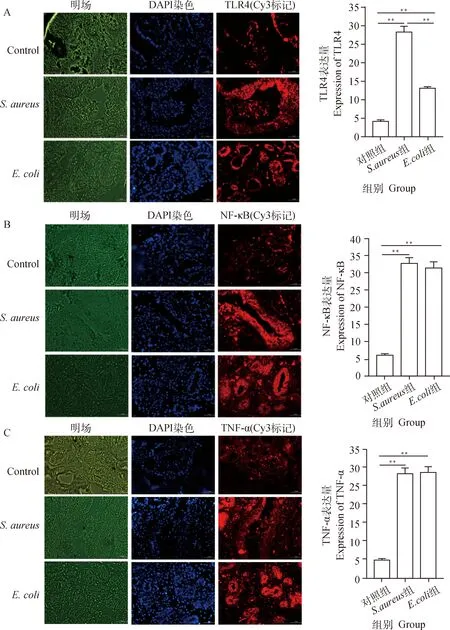
A. TLR4免疫荧光;B. NF-κB免疫荧光;C. TNF-α免疫荧光。**.P<0.01A. TLR4 immunofluorescence; B. NF-κB immunofluorescence; C. TNF-α immunofluorescence. **. P<0.01图2 奶牛乳腺组织TLR4、NF-κB和TNF-α蛋白的免疫荧光检测(40×)Fig.2 Expression of TLR4, NF-κB and TNF-α in bovine mammary tissues by immunofluorescence (40×)
2.2 qPCR检测结果
为探讨奶牛感染和后炎症相关基因的mRNA转录水平,采用qPCR技术检测对照组、诱导组和诱导组的趋化因子家族2、8、1、2和13,补体因子和,以及自噬调节因子1和白介素受体21共9个基因的mRNA 转录水平。
2.2.1 趋化因子基因mRNA转录水平的检测结果 qPCR检测结果显示,与对照组相比,诱导组和诱导组的趋化因子2、8、1和2基因的mRNA转录水平均极显著上调(<0.001);2、8和1在诱导组的mRNA转录水平极显著高于诱导组(<0.001);13仅在诱导组中的mRNA转录水平极显著上调(<0.001),在诱导组中的上升趋势不显著(>0.05)(图3)。结果说明,在和感染奶牛乳腺后,上述基因可能在组织炎症反应中具有重要的作用。
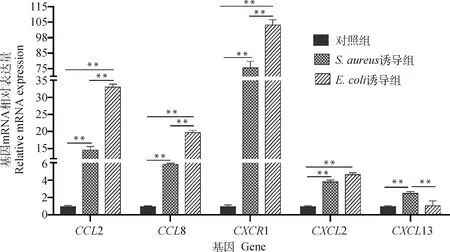
**.P<0.001图3 奶牛乳腺组织趋化因子基因mRNA转录水平的检测结果Fig.3 Detection results of mRNA transcription levels of chemokine genes in dairy cow mammary tissues
2.2.2 补体因子基因mRNA转录水平的检测结果 qPCR检测结果表明,与对照组相比,诱导组和诱导组中补体因子和基因mRNA转录水平极显著上调(<0.001),尤其是在诱导组和诱导组的mRNA转录水平分别上调51倍和42倍。此外,在诱导组的mRNA转录水平极显著高于诱导组(<0.001),而在诱导组的mRNA转录水平极显著低于诱导组(<0.001)(图4),推测这两个基因在和诱导的乳腺炎中可能具有不同的调控方式。
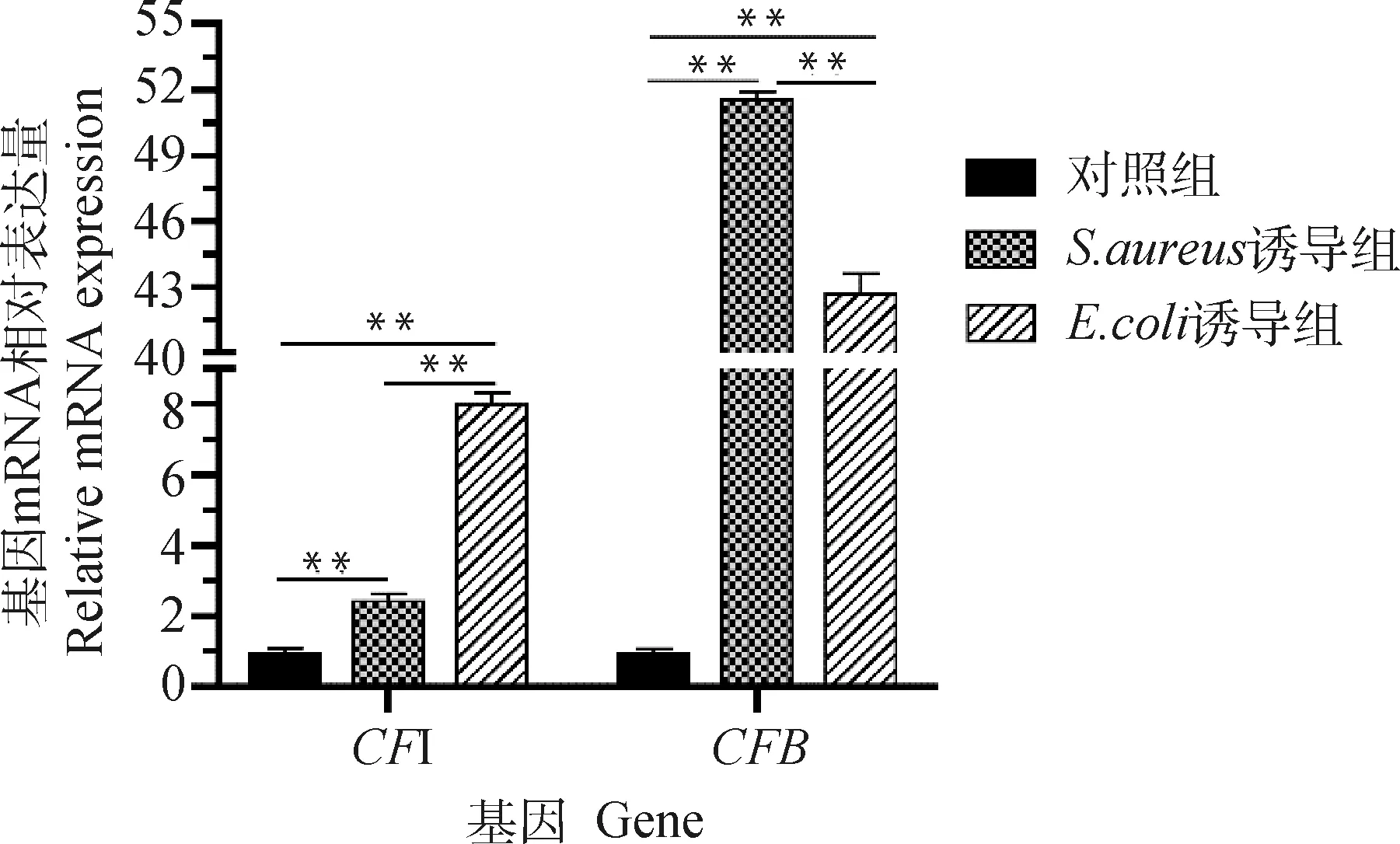
**. P<0.001图4 奶牛乳腺组织 CFI和CFB基因mRNA转录水平的检测结果Fig.4 Detection results of mRNA transcription levels of CFI and CFB genes in dairy cow mammary tissues
2.2.3 自噬调节因子1和白细胞介素受体21基因mRNA转录水平的检测结果 qPCR检测结果表明,与对照组相比,诱导组和诱导组中自噬调节因子1基因mRNA转录水平均极显著下降(<0.001)(图5),说明在炎症发生中细胞维持内环境稳态遭到严重破坏。21基因在诱导组和诱导组mRNA转录水平均极显著上升(<0.001),且诱导组mRNA转录水平极显著高于诱导组(<0.01)(图5)。鉴于21基因具有重要的免疫抑制作用,表明在和感染后,奶牛免疫力急剧下降,并且感染后对免疫力的影响作用更明显。
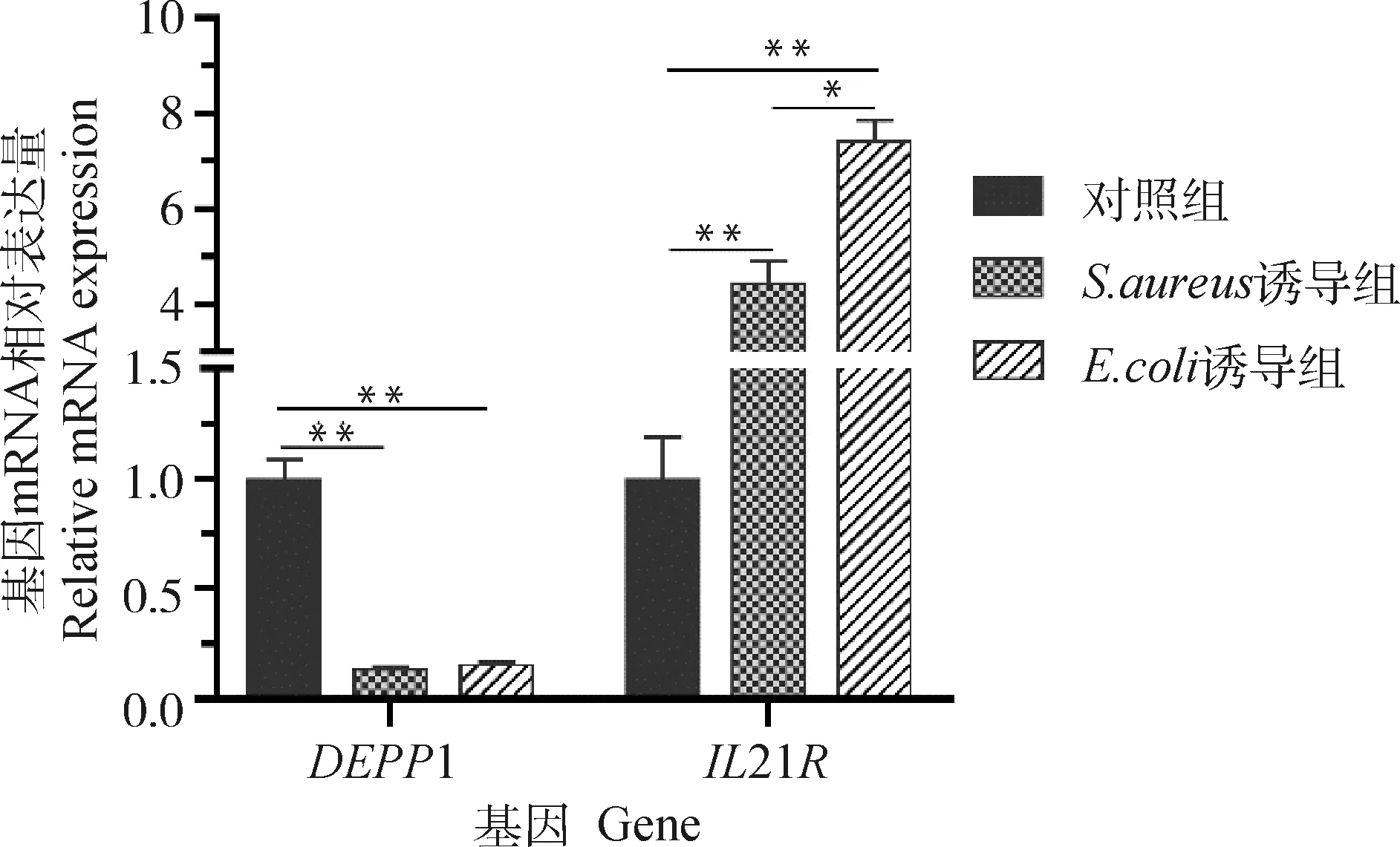
*. P<0.01; **. P<0.001图5 奶牛乳腺组织DEPP1和IL21R基因mRNA转录水平的检测结果Fig.5 Detection results of mRNA transcription levels of DEPP1 and IL21R genes in dairy cow mammary tissues
3 讨 论
奶牛乳腺炎受多基因组成的分子网络共同调控,其发生与发展机制非常复杂。为进一步解析乳腺炎的分子调控机制,近年来,人们利用奶牛乳腺上皮细胞(bovine mammary epithelial cells,bMECs)炎症模型和奶牛乳腺炎活体诱导模型开展分子水平上的研究。在这两种模型中,奶牛乳腺炎活体诱导模型接近于临床乳腺炎,是更合理的研究材料。迄今为止,几乎全部研究均采用高浓度菌液短时(24 h)感染奶牛乳房,诱导产生奶牛急性乳腺炎。但是,上述模型所检测基因的表达量差异很大,甚至出现表达趋势不一致的结果,可见基因表达水平与乳腺炎症程度、奶牛个体遗传、病原菌的类型和剂量、以及感染时间等多种因素有关。和是引起奶牛乳腺炎的常见病原菌。乳腺炎是奶牛养殖过程中被病原体长期感染的过程。因此,为了更接近乳腺炎自然发生与发展的过程,作者分别将较低浓度的和长时间(7 d)感染奶牛乳房,成功建立了型和型乳腺炎模型,并进行了趋化因子基因、补体因子、细胞因子受体和自噬调节因子共9个基因mRNA转录水平的检测分析,以期为奶牛乳腺炎的分子机制研究提供参考。
本研究发现,和分别感染奶牛乳房后,乳腺组织内趋化因子家族的2、8、1、2和13基因的mRNA转录水平在s诱导组和诱导组均上升,说明2种病原菌感染可使乳腺产生固有免疫反应,有助于白细胞募集。在细胞水平上,人们发现bMECs对和s具有不同的免疫反应。脂多糖(LPS)是的主要致毒因子,能刺激Toll样受体2(toll-like receptor 2,TLR2)和TLR4蛋白而启动NF-κB和Fas信号通路,而s的致毒因子LTA能刺激TLR2,启动AP-1和IL-17A信号通路。研究表明,、2、-6和-8、6、-1在LPS诱导的bMECs中的mRNA转录水平显著高于LTA诱导的bMECs。Zhang等研究发现LPS和LTA诱导炎性bMECs可触发基质成纤维细胞不同的免疫反应。本研究发现,诱导组趋化因子家族的2、8和1基因的mRNA转录水平比诱导组显著升高,与上述细胞水平的研究结果一致。趋化因子蛋白超家族的表达量升高,可介导白细胞和其他效应细胞向炎症损伤部位的迁移和黏附,从而引起组织炎症。同时,上述结果解释了通常引起急性临床乳腺炎,而引起慢性乳腺炎的原因。
补体系统在免疫反应中的作用具有两面性:它可通过对免疫系统的调节以及对炎症细胞的直接杀伤作用,促进免疫监视并抑制炎症的发展;但是,过度激活的补体可激活免疫抑制微环境,促进炎症的快速发展。CFB为C3激活剂前体,主要由肝和巨噬细胞合成,是补体旁路活化途径的关键因子,与唐氏综合征、恶性肿瘤、系统性红斑狼疮等多种疾病有关。CFI是补体激活途径中的一种重要抑制因子,与年龄相关性黄斑变性、急性出血性白质脑炎等疾病相关。在本研究中,相比于对照组,补体因子和基因在诱导组和诱导组奶牛乳腺中mRNA转录水平均极显著上升,特别基因的上调倍数分别达到51倍和42倍,这种异常激活则可能对奶牛机体免疫产生抑制作用,从而促进了乳腺炎的发展。
细胞自噬是真核生物维持内环境稳态的一种保护性机制,即通过依赖溶酶体降解细胞质内破损的细胞器、致病性微生物和错误折叠的蛋白质,从而维持真核细胞内环境稳态。在正常生理情况下,自噬不影响细胞的生存和正常功能;而当机体内细胞自噬平衡被破坏时,自噬不足或过度均可引起细胞功能异常,导致相关组织细胞病理损害加重甚至死亡。自噬调节因子DEPP1是一个参与自噬激活的主要缺氧诱导因子,其N端含有一个过氧化物酶体靶向信号类型2(peroxisomal targeting signal type 2,PTS2)序列,该序列可与过氧化物酶体生物发生因子7(peroxisomal biogenesis factor 7,PEX7)受体结合并进入过氧化物酶体,调节过氧化氢酶的活性,从而调节细胞活性氧(reactive oxygen species,ROS)的解毒能力,对叉头框蛋白O3(forkhead box protein O3,FOXO3)诱导的自噬起关键调节作用。在本研究中,和感染乳腺造成奶牛的应激增加,导致1基因的mRNA 转录水平显著降低,说明在和所致的乳腺炎发生过程中,减弱了细胞自噬,从而促进了组织炎症过程。
21是机体免疫调节的基因之一。21结合-21后可激活MAPK、PI3K/AKT和JAKs-STATs等多种信号通路,调节不同基因的表达,进而调节T细胞、B细胞、自然杀伤细胞和树突状细胞的活化和增殖,从而参与机体的固有免疫和适应性免疫。作为新型的免疫调节因子,-21在艾滋病、胰腺导管腺癌和风湿性关节炎等多种自身免疫性疾病的发生发展中扮演着重要的角色。在本研究中,21基因的mRNA转录水平在诱导组和诱导组中显著上升,提示在2种奶牛乳腺炎中,乳腺组织21基因表达上调可激活更多T细胞和B细胞等免疫细胞,参与乳腺固有免疫和适应性免疫的调节,以应对乳腺炎的发生与发展过程。
4 结 论
S.和感染奶牛乳房后,可造成严重的临床型乳腺炎症状;两种病原菌可上调乳腺组织中趋化因子2、8、1、2和13基因,补体因子和基因,以及白细胞介素受体21基因的mRNA转录水平,同时下调自噬调节因子1基因的mRNA转录水平,从而应对奶牛乳腺炎症过程。此外,诱导组乳腺组织中的2、8、1、和21基因的mRNA转录水平均显著高于组,解释了是引起急性乳腺炎,而是引起慢性乳腺炎的原因。上述结果可为深入研究奶牛乳腺炎的分子调节机制提供参考,其深入的机制有待于进一步研究。

