色氨酸微生物吲哚代谢途径在IBD治疗及新药研发中的作用①
张倩文 张 曦 徐小婷 MOHAMMED ISMAIL 江振洲 焦春花 孙丽新
(中国药科大学,江苏省药效研究与评价服务中心,南京 210009)
炎症性肠病(inflammatory bowel disease,IBD)主要分为两种类型:溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn's disease,CD)。IBD 在西方国家具有较高的发病率和患病率,最新流行病学研究表明,近年亚洲、非洲和南美洲新兴工业化国家 IBD 发病率呈上升趋势[1-2]。IBD 表现为结直肠慢性非特异性炎症,症状主要包括慢性腹泻、腹痛、体重减轻和血便等,患者需频繁住院治疗,健康和生活质量受到严重影响,经济负担较重[3-5]。IBD 的发病机制仍不清楚,且迄今为止无根治性治疗药物[6-7]。因此,阐明IBD 的发病机制,开发新的治疗方法或治疗药物具有重要意义。
近年研究发现,色氨酸(tryptophan,Trp)通过肠道菌群代谢生成的吲哚类物质在IBD发病机制与治疗中发挥重要作用[8-10]。因此,阐明吲哚类代谢物变化规律及病理生理作用对寻找IBD 生物标志物、探索发病机制、开发靶点药物等具有重要意义。本文对Trp 吲哚类代谢物在IBD 中的变化特点、作用机制及药物研究进展进行综述,以便更好地了解肠道微生物产生的Trp 吲哚代谢物在改善IBD 方面的作用,为IBD治疗和新药研发寻找新的方向和突破点。
1 Trp吲哚代谢途径与IBD
Trp 代谢主要有三条通路:犬尿氨酸途径(kynurenine pathway,KP)、血清素途径(serotonin/5-HT pathway)及微生物吲哚代谢途径(indole pathway)。Trp 及其代谢产物通过免疫、代谢等信号机制双向影响肠道微生物和肠道组织,最终影响宿主肠道功能。虽然Trp 吲哚代谢途径仅代谢不到10%Trp,但其在IBD中的作用受到越来越多关注。
吲哚代谢途径中,Trp 由含有苯乳酸脱水酶基因簇(fldAIBC)、芳香氨基酸转氨酶(ArAT)、色氨酸脱羧酶或吲哚乳酸脱氢酶(ILDH)等代谢酶菌株代谢为含吲哚环的代谢物,如吲哚乙酸(indoleacetic acid,IAA)、吲哚乳酸(indolelactic acid,ILA)、吲哚-3-醛(indole-3-aldehyde,I3A 或IAld)、吲哚丙酸(indole propionic acid,IPA)、吲哚丙烯酸(indole acrylic acid,IA)等。这些吲哚类代谢物多为芳香烃受体(aryl hydrocarbon receptor,AhR)配体,通过激活AhR或维持肠道黏膜完整性影响肠道免疫稳态,调节肠道微生物群平衡影响结肠炎发生发展(表1)。如IAld 可激活AhR 诱导结肠NKp46+细胞产生IL-22,分泌抗菌肽,防止致病菌感染,改善小鼠结肠炎[11];消化链球菌编码fldAIBC 代谢Trp产生IA,减少肠道氧化应激,提高微生物适应能力[12]。梭状芽孢杆菌、肉毒梭状芽孢杆菌和厌氧菌胃链球菌也可表达fldAIBC 代谢Trp,产生IPA,与孕烷X 受体(prgenane X receptor,PXR)结合调节肠道通透性和炎症[13]。

表1 吲哚类物质在肠道稳态中的作用Tab.1 Function of indoles in intestinal homeostasis
Trp 各代谢途径相互影响(图1)。微生物吲哚代谢途径与犬尿氨酸途径相互影响,当犬尿氨酸途径限速酶吲哚胺 2,3-双加氧酶 1(indoleamine 2,3-dioxygenase 1,IDO1)缺乏时,肠道细菌优先使用Trp产生吲哚化合物;IDO1 过表达时,会抑制吲哚对结肠上皮细胞系紧密连接完整性的转录网络激活[14]。AhR 不仅影响小鼠肠道微生物群落,还可调控IDO1表达和活性[15];犬尿氨酸也可通过AhR 发挥免疫调节作用[16]。IDO 表达依赖于微生物群,在无菌小鼠中定植肠道共生菌会增加IDO 表达,而犬尿氨酸因具有抗菌性,直接影响肠道菌群增殖[17-18]。另外,肠道菌群影响血清素途径中5-HT 合成,而5-HT 又可通过调节肠道运动和肠道免疫影响菌群组成和定植,菌群组成和定植变化势必会影响KP 和吲哚途径[19]。
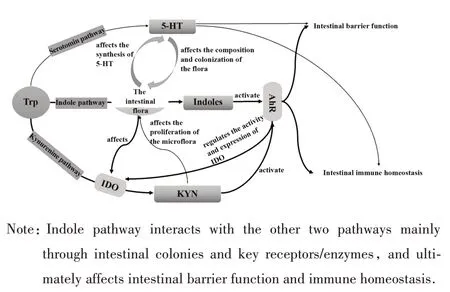
图1 Trp 3条代谢通路的联系Fig.1 Relationship between three metabolic pathways of Trp
总之,Trp 3 条代谢通路的联系是紧密且复杂的,正常情况下处于动态平衡,但某一环节失调会影响其他代谢环节。Trp 微生物代谢途径不仅能够维持免疫稳态和屏障完整性,还影响犬尿氨酸途径和血清素途径,调节宿主局部和整体功能,但具体相互影响机制仍需深入研究。
2 吲哚类物质在IBD中发生的变化
研究发现,IBD中存在Trp代谢紊乱现象。肠道炎症中,吲哚类物质含量一般会下降,如IPA、IA 及IAA、IAld 及 Indole 等[10,20-21]。ALEXEEV 等[10]通过对吲哚代谢物的定量分析发现,活动期UC 患者血清中IPA约为20 nmol/L,与健康人相比下降近60%,而缓解期 UC 患者 IPA 含量正常,提示 IPA 既是 UC 活动期的生物标志物,也是UC 缓解期的指标。由于Trp 代谢在病理情况下会受到影响,因此采用Trp 及其代谢物作为生物标志物以支持诊断和预后并确定治疗方案具有一定前景,但目前Trp 及其代谢物研究不够深入,仍不清楚样本中哪些吲哚衍生物变化与疾病进程特异性相关;再者个体差异可能会导致较大定量差异,如正常人血清中IPA 含量为50 nmol/L 及1.0 μmol/L,可能影响吲哚代谢物作为IBD生物标志物的临床应用[10,22]。
3 吲哚代谢物在IBD中的作用机制
IBD 患者及肠道炎症动物模型中常伴随肠道菌群失调、致病菌增多、肠道屏障破坏、抗炎/促炎因子失衡、大量炎症因子释放、黏膜免疫系统过度反应等现象[23-24]。吲哚代谢物可通过维持黏膜完整性、调节肠道免疫、抗氧化应激三个方面发挥肠道保护作用(图2)。
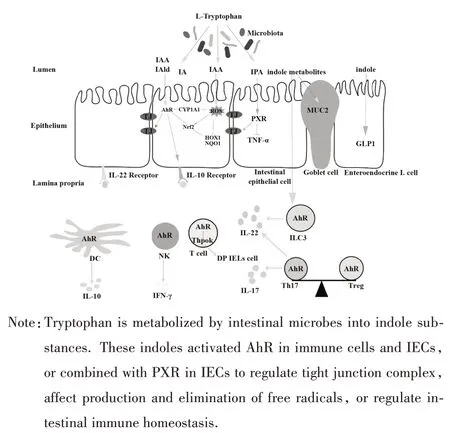
图2 吲哚代谢物在IBD中的作用机制Fig.2 Mechanism of indole metabolites in IBD
3.1 维持黏膜屏障完整性 肠道黏膜由单层肠道上皮细胞组成,主要包括肠上皮内淋巴细胞(intraepithelial lymphocyte,IELs)、肠内分泌细胞、潘氏细胞、杯状细胞等。其中杯状细胞分泌黏蛋白构成黏液层,阻止细菌入侵,潘氏细胞位于隐窝底部,分泌抗菌肽[25]。此外,相邻肠上皮细胞间由紧密连接的复合体形成封闭,正常情况下紧密连接成分是动态调节的,但持续的炎症或感染可导致屏障破坏和微生物入侵[26]。
肠道黏膜直接接触菌群刺激,响应菌群和代谢物信号分子变化,是肠道微生物及其Trp 代谢物发挥宿主肠道稳态调节作用的重要物质基础,也影响肠道菌群定植和功能。吲哚类物质可维持肠道黏膜完整性。早期研究发现,PXR 和AhR 可作为吲哚类物质受体发挥肠道保护作用。如IAld 通过促进AhR 依赖的IL-22 生成阻止白色念珠菌等致病微生物定殖,改善 DSS 小鼠结肠炎损伤[11];IPA 通过激活PXR 下调炎症因子TNF-α 水平,上调紧密连接蛋白水平,改善吲哚美辛诱导的肠道损伤[13]。进一步研究发现,Trp 代谢物吲哚-3-乙醇(indole-3-ethanol,IEt)、吲哚-3-丙酮酸(indole-3-pyruvate,IPyA)和I3A激活AhR,抑制肌动蛋白调节蛋白Ezrin 和MyosinⅡA 维持紧密连接和黏附连接完整性,降低结肠炎小鼠肠道通透性[9]。IA 诱导 AhR 靶基因 CYP1A1 表达,且导致杯状细胞相关基因分化和表达增加,促进肠上皮屏障功能[12]。此外,吲哚诱导肠上皮细胞结构和功能维护的相关基因如紧密连接、肌动蛋白细胞骨架、黏蛋白产生等表达[14,27]。口服给予吲哚导致DSS 小鼠紧密连接蛋白表达增加,改善上皮损伤[28]。另外吲哚作为一种信号分子,可调节结肠L细胞中胰高血糖素样肽-1(GLP-1)分泌,肠道微生物群通过吲哚与L细胞沟通并影响宿主代谢[29]。
3.2 调节免疫功能 AhR 广泛存在于肠上皮细胞及免疫细胞,如IELs、Th17细胞、先天淋巴样细胞(congenital lymphoid cells,ILCs)、巨噬细胞、树突状细胞(dendritic cell,DCs)等,对肠道稳态维持至关重要[30]。吲哚化合物可通过激活AhR 维持肠道免疫应答。AhR 激活可抑制ILC2,增强ILC3 功能,平衡肠道 ILC2-ILC3 以保护宿主免受病原体感染[31]。CYP1A1 在 IECs 组成型表达会耗尽 AhR 配体,导致AhR 依赖型ILC3 和Th17 减少,并增加肠道易感性,增加 AhR 配体吲哚-3-甲醇(indole-3-carbinol,I3C)摄入量可抵消过量AhR 配体降解对肠道免疫功能的有害影响[32]。罗伊氏乳杆菌代谢Trp产生ILA,激活CD4+T 细胞AhR,使Thpok 下调并分化为免疫调节 T 细胞(CD4+CD8αα+双阳性上皮内 T 细胞,DP IELs)[33]。此外,AhR 激活影响不同细胞因子表达,如 TNF-α、IL-10、IL-17、IL-22、IFN-γ 等[9-11,34-37]。其中,IL-22 级联在 IBD 中具有重要临床意义,IL-22 可促进黏膜愈合,刺激IBD 生物标志物钙蛋白及不同种类抗菌肽产生,AhR/IL-22/Stat3 信号通路参与肠道菌群对肠道黏膜抗菌分子的调控[11,37-38]。IPA、IAld 通过 AhR 途径参与 IL-10R1 在 IEC 中的表达进而维持肠道稳态[10]。
此外,吲哚代谢物通过AhR 调控Treg 分化,影响 Treg 功能[8,10,39]。吲哚及吲哚衍生物与 AhR 结合可诱发 Treg 增殖,抑制活化 T 细胞免疫功能[8]。在DSS 小鼠结肠炎模型中,Trp 吲哚代谢物IAA 和IPA增加可激活AhR,调节CD4+T 细胞分化,恢复Th17和 Treg 免疫应答[20]。KIM 等[39]研究表明,口服吲哚衍生物3,3′-二吲哚甲烷(DIM)可激活AhR,影响Treg/Th17比例,显著减少肠道病变。
3.3 抗氧化应激 色氨酸及其代谢物对IBD 的抗氧化作用部分由AhR 介导,AhR 的靶基因CYP1A1、CYP1A2、CYP1B1 与 ROS 产生和消除有关[40]。另外,AhR介导核转录因子-E2相关因子2(nuclear factor-E2 related factor 2,Nrf2)激活,在机体抗氧化防御中起重要作用。NAD(P)H:醌氧化还原酶1[NAD(P)H quinine oxidoreductase,NQO1]、谷胱甘肽硫转移酶(glutathione-S-transferases,GST)和超氧化物歧化酶1(superoxide dismutase 1,SOD1)等均为Nrf2 和 AhR 的靶基因,AhR 或 Nrf2 被激活后入核,与靶基因启动子中的二噁英反应元件和抗氧化反应元件结合,诱导下游靶基因转录。研究显示,I3C可激活AhR,减少iNOS、IL-1β和NLRP3等促炎基因表达,提高抗氧化蛋白 NQO1 和 HOX1 水平[41]。ILA可激活肠道上皮细胞AhR 及CYP1A1,激活Nrf2 及NQO1、SOD2 表达以减少炎症性刺激引起的细胞氧化应激[42]。IA 除激活 AhR 外,还特异性激活 Nrf2,在体外LPS诱导的氧化应激模型中显著上调Nrf2靶基因(如Hmox1、NQO1、Gclm)表达,促进抗氧化和抗炎免疫应答[12]。
但近来JI等[43]发现,IAA显著改善了RAW264.7细胞中LPS 引起的炎症反应和自由基生成,诱导血红素加氧酶 1(heme oxygenase 1,HO-1),减少促炎细胞因子IL-1β和IL-6表达,但IAA 对于自由基(NO和ROS)的清除作用是通过直接中和作用的,既不依赖于HO-1也不依赖于AhR。
4 微生物吲哚代谢途径给IBD 药物研发带来的新思路
Trp 通过肠道菌群代谢为吲哚类物质,并通过激活AhR 或PXR 发挥肠道免疫或肠道黏膜保护作用这一通路可为IBD新药研发及中药机制探索提供新的思路(图3)。
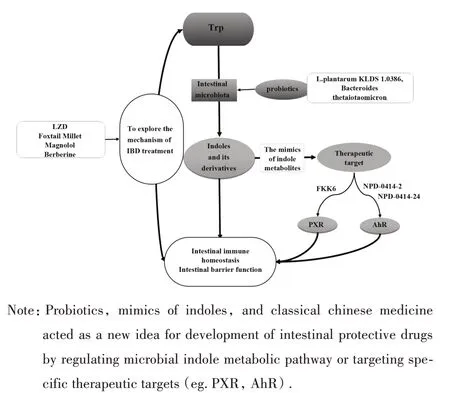
图3 微生物吲哚代谢途径与IBD药物研发Fig.3 Microbial indole metabolic pathway and IBD drug development
4.1 发掘活性单体或模拟吲哚类物质开发新药从Trp 微生物代谢物中发掘活性单体或模仿这些天然代谢物结构设计合成新的分子药物,针对靶点精准治疗是药物开发的重要策略。天然代谢物与靶点的亲和力通常较低,无法保证直接用于制药,因此,需要对其结构进行改造。如PXR 作为IBD 治疗靶点,其激活发挥的维持肠道稳态和黏膜完整性的作用已被证实。DVOŘÁK 等[44]通过开发FKK6 首次证明模拟微生物代谢物是一种可行的药物开发策略。研究者通过观察PXR残基与吲哚和IPA的相互作用,基于混合结构方法,采用IPA和吲哚在PXR配体结合域相互作用改进得到双吲哚类似物FKK 1~10,其中FKK6 以PXR 依赖方式显著减轻DSS 小鼠结肠炎。
AhR 也被确定为IBD 易感性位点的候选基因。AhR 激动剂 6-formylindolo(3,2-b)carbazole(FICZ)激活AhR 诱导IL-22 产生,改善小鼠实验性结肠炎[45]。天然AhR配体青黛治疗UC患者8周发现,其对患者的临床和内镜下黏膜愈合是有效的,但长期使用会导致肺动脉高压和肝功能障碍等不良反应[46]。因此,急需开发减毒高效的AhR 配体治疗IBD。基于此,MARAFINI 等[47]开发了 FICZ 结构类似物NPD-0414-2 和NPD-0414-24,这两种化合物可激活 AhR,降低 IFN-γ 水平,提高 IL-22 水平,减轻TNBS 结肠炎。因此可通过Trp 代谢物或其模拟物靶向AhR受体实现肠道保护作用。
4.2 发现药物作用新机制或发掘可通过调节Trp代谢途径发挥肠道保护作用的药物 一些用于治疗IBD 的经典中药可引起Trp 代谢相关通路变化,表明其可能通过Trp 代谢途径发挥IBD 治疗作用。长期用于UC 临床治疗的理中汤(LZD)可改变肠道微生物结构及代谢,显著降低L-Trp 水平,降低炎症相关的细菌丰度,提高有益细菌含量,提示微生物群及其代谢产物可能是LZD 改善UC 的潜在靶点[48]。有报道称,粗粮可降低结直肠癌(colorectal cancer,CRC)风险,ZHANG 等[49]探索其分子机制发现,相较于大米,粗粮谷子摄入可减轻小鼠结肠炎症及损伤,增加IPA、IAA 和IA,并激活AhR,调节肠道微生物结构趋于正常,降低AOM/DSS 引起的结肠炎相关CRC 风险。厚朴酚通过增加IAA、ILA 等Trp代谢物产生激活AhR,对DSS 诱导的小鼠结肠炎具有抗炎作用[50]。小檗碱能够逆转DSS造模大鼠的肠道微生物失衡,恢复乳酸杆菌、梭状芽孢杆菌及拟杆菌水平,增强微生物色氨酸代谢,恢复IAA、IPA和IA至正常水平,触发AhR/IL-22信号通路,保护肠道屏障功能[21]。益生菌也被证实可通过调节吲哚代谢途径发挥肠道保护作用。植物乳杆菌KLDS 1.0386 联合Trp 治疗DSS 小鼠可提高血清和结肠中IAA 水平,上调 AhR 水平,激活 IL-22/STAT3 信号通路,增加抗炎细胞因子、紧密连接蛋白和黏蛋白表达,调节肠道微生物群组成[51]。另外,给予DSS结肠炎小鼠多形拟杆菌可增加IAA、IPA,激活AhR 并调节CD4+T细胞分化减轻结肠炎症[20]。
5 结语与展望
当今中国精准医疗快速推进的背景下,微生物吲哚代谢途径在IBD治疗及新药研发中具有新的突破点和曙光。如IBD患者血清中,Trp水平与疾病活性呈负相关,IPA 也可作为UC 缓解的指标,提示Trp及其代谢物可能成为 IBD 的生物标志物[10,52]。因此,高通量代谢物分析可筛选IBD相关生物标志物,或可用于IBD诊断和治疗。再者,Trp代谢物相关通路在IBD 发病机制和靶点方面的深入研究,有助于精准药物研发。此外,经典中药通过调节Trp 吲哚代谢途径治疗UC 这一新分子机制的发现,不仅可使研究者对中药治疗IBD 的认识微观精准,为临床UC中西结合给药方案提供科学依据,更提示研究者可利用高通量代谢组学分析发现病症生物学标志物,实现中医药的客观精确诊断,推进中医药融入精准医疗,为中医药发展注入新的活力。

