乳双歧杆菌XLTG11缓解环磷酰胺 致小鼠免疫功能损伤
李玟玟,马微微,马青,张振华,黄莉莉
(黑龙江中医药大学药学院,黑龙江哈尔滨 150040)
益生菌是对宿主有益并有利于肠内菌群生态平衡的活性微生物制剂,当摄入足够剂量时会刺激宿主免疫系统,增强宿主免疫应答反应,从而帮助宿主抵抗各类疾病发生[1]。目前,益生菌作为保健食品在临床使用广泛,主要以调节肠道菌群提高免疫力为主,其主要来源于乳杆菌属和双歧杆菌属。双歧杆菌属下的动物双歧杆菌乳亚种(Bifidobacterium animalissubsp.lactis)即乳双歧杆菌(Bifidobacterium lactis)安全性高,使用时间长,在我国《可用于食品菌种名单》和欧盟安全资格认定(qualified presumption of safety,QPS)名单中均有收录[2,3]。乳双歧杆菌XLTG11分离自健康婴儿肠道,具有优良益生特性,在pH 2.5的人工胃液中3 h,存活率为75.01%,之后继续在pH 8.0的人工消化液中11 h,存活率为89.75%,具有良好的胃肠道消化液耐受性,具有开发为保健食品的优势。马微微等[4]发现乳双歧杆菌XLTG11可以升高小鼠全血白细胞数目、刺激T淋巴细胞增殖分化,增强小鼠细胞免疫与体液免疫功能。此外,乳双歧杆菌XLTG11可以降低促炎细胞因子表达,增强肠道屏障,调节肠道菌群组成,提高短链脂肪酸含量,进而有效缓解葡聚糖硫酸钠诱导的小鼠溃疡性结肠炎[5]。环磷酰胺(cyclophosphamide,CTX)是一种细胞毒化疗药物,对动物的体液和细胞免疫应答具有抑制作用,是制备动物免疫抑制模型的常用药物[6]。
本研究以CTX构建免疫低下小鼠模型,灌服乳双歧杆菌XLTG11探讨其对小鼠胸腺及脾脏指数、细胞免疫功能、小肠黏膜屏障、免疫球蛋白和炎症因子的影响,全面评价乳双歧杆菌XLTG11的免疫调节功能,为益生菌微生态制剂产品的合理应用及保健食品开发提供理论基础。
1 材料与方法
1.1 材料
1.1.1 实验菌株
乳双歧杆菌XLTG11,葵花药业集团有限公司;中国微生物菌种保藏管理委员会普通微生物中心保藏编号CGMCC No.18738。实验前将菌株以不同剂量分装保存于-80 ℃冰箱,用0.4 mL生理盐水作为溶剂临用现配。
1.1.2 实验动物
8周龄健康SPF级雄性BALB/c小鼠(18~22 g),辽宁长生生物技术股份有限公司,动物许可证号:SCXK(辽)2020-0001。实验动物饲养于屏障环境动物室,期间自由饮水、摄食,温度控制在20~23 ℃,12 h明暗交替。
1.1.3 主要试剂和仪器
环磷酰胺冻干粉(批号20172225),江苏恒瑞医药股份有限公司;盐酸左旋咪唑(levamisole hydrochloride,LEV)(批号200102),山西太原药业有限公司;绵羊红细胞(SRBC)(批号20210605),上海源叶生物科技有限公司;小鼠免疫球蛋白A(immunoglobulinA,IgA,编号MM-0055M2)、免疫球蛋白G(immunoglobulinG,IgG,编号MM-0057M2)、干扰素γ(interferon-γ,IFN-γ,编号MM-0182M2)、肿瘤坏死因子α(tumor necrosisfactor-α,TNF-α,编号MM-0132M2)、白细胞介素2(interleukin,IL-2,编号MM-0701M2)、白细胞介素6(interleukin,IL-6,编号MM-0163M2)试剂盒,江苏酶免实业有限公司;Donatello脱水机,意大利DIAPATH公司;JB-P5包埋机,武汉俊杰电子有限公司;RM2016病理切片机,上海徕卡仪器有限公司;SORVALL ST8/8R离心机,美国TOMOS公司;Nikon Eclipse E100光学显微镜,日本尼康。
1.2 方法
1.2.1 实验动物分组及模型建立
空白组和模型组灌服生理盐水0.4 mL,阳性对照组灌服LEV(10 mg/kg),乳双歧杆菌XLTG11不同剂量组分别灌服乳双歧杆菌XLTG11溶液1×106、1×107、1×108、1×109CFU,持续28 d,期间自由饮食。第23、24 d,除空白组腹腔注射生理盐水外,其余各组小鼠腹腔注射CTX(40 mg/kg),参照文献[7]方法建立免疫低下小鼠模型。
1.2.2 免疫器官指数测定
实验第28 d末次给药30 min后,各组小鼠称重,脊椎脱臼处死,摘取胸腺和脾脏,剥离表面脂肪,用滤纸吸干表面水分,称重并按照公式计算胸腺和脾脏指数。
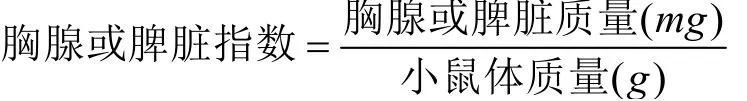
1.2.3 迟发型变态反应(delayed typehypersensitivity,DTH)测定
实验第23 d,先后用0.2 μL、20 μL 2%(V/V)SRBC间隔4 d对小鼠进行致敏和攻击。于攻击前、后24 h分别测量每只小鼠左后足趾部位厚度,同一部位测量三次取平均值,计算足趾厚度差值。
1.2.4 小肠黏膜组织病理变化
小鼠处死后,采集2~3 cm小鼠回肠,4%多聚甲醛固定,经脱水、包埋、切片等步骤制作石蜡切片,HE染色,使用光学显微镜观察小肠黏膜组织病理变化,染色步骤参考文献操作[8]。
1.2.5 小肠黏膜绒毛高度和杯状细胞数目测定
使用1.2.4的小肠黏膜组织HE染色切片,选取小肠组织目的区域进行100倍成像,使用Image-Pro Plus 6.0分析软件,以毫米作为标准单位,分别测量每张切片中5根完整肠绒毛高度(Villus height),并求出平均值。
使用1.2.4的小肠黏膜组织未染色切片,将切片进行碘酸雪夫氏(PAS)染色处理,选取小肠组织目的区域进行100倍成像,使用Image-Pro Plus 6.0分析软件,以毫米作为标准单位,计数单位长度杯状细胞数量。
1.2.6 血清中细胞因子水平测定
实验第28 d末次给药30 min后,摘除各组小鼠眼球取全血,3000 r/min离心10 min,取血清分装-80 ℃冰箱冷冻待测。ELISA试剂盒检测血清IgA、IgG、IL-2、IL-6、IFN-γ、TNF-α水平,操作步骤按说明书进行。
1.3 统计学方法
应用SPSS 26.0统计软件,实验数据以均数±标准差(±S)表示,单因素方差分析方法进行数据处理,LSD法进行两两比较,p<0.05具有显著性差异。
2 结果与讨论
2.1 各组小鼠免疫器官指数测定
胸腺是机体最重要的免疫器官,是T细胞分化、发育的场所;脾脏是机体最大的免疫器官,其中的免疫细胞在机体防御和清除功能中具有重要作用[9]。当机体接受抗原刺激后,T淋巴细胞及B淋巴细胞数目增多,相应细胞区体积扩大,免疫器官的体积和重量也随之增大。因此,胸腺指数和脾指数的高低可以反映机体非特异性免疫水平,在保健品免疫功能评价中具有重要意义[10,11]。田艳等[12]研究了以乳双歧杆菌为主要成分的益生菌对CTX模型小鼠免疫功能的影响,结果表明CTX可以降低小鼠胸腺和脾指数,经益生菌给药处理后,小鼠胸腺指数明显回升,但脾指数无显著差异。乳双歧杆菌XLTG11不同剂量组对CTX小鼠胸腺和脾指数的影响如表1所示。与空白组比较,模型组小鼠胸腺指数和脾指数显著降低(p<0.05),说明免疫低下小鼠模型构建成功。与模型组比较,阳性对照组小鼠胸腺指数增长43.43%(p<0.05),XLTG11各剂量组小鼠胸腺指数均增加(p<0.05),且呈剂量依赖性,其中1×106CFU剂量组增加37.37%(p<0.05),1×107CFU剂量组增加43.43%(p<0.05),1×108CFU剂量组增加56.56%(p<0.01),1×109CFU剂量组增加84.84%(p<0.001),但各组小鼠脾指数无明显变化。表明乳双歧杆菌XLTG11可以拮抗CTX对小鼠胸腺的损伤,回调胸腺指数使其接近正常水平,但不能拮抗CTX导致的小鼠脾脏损伤。
表1 XLTG11不同剂量组对CTX小鼠胸腺和脾指数的影响 Table 1 Effect of different dose groups of XLTG11 on thymus and spleen indexes in CTX mice (±S, n=8)
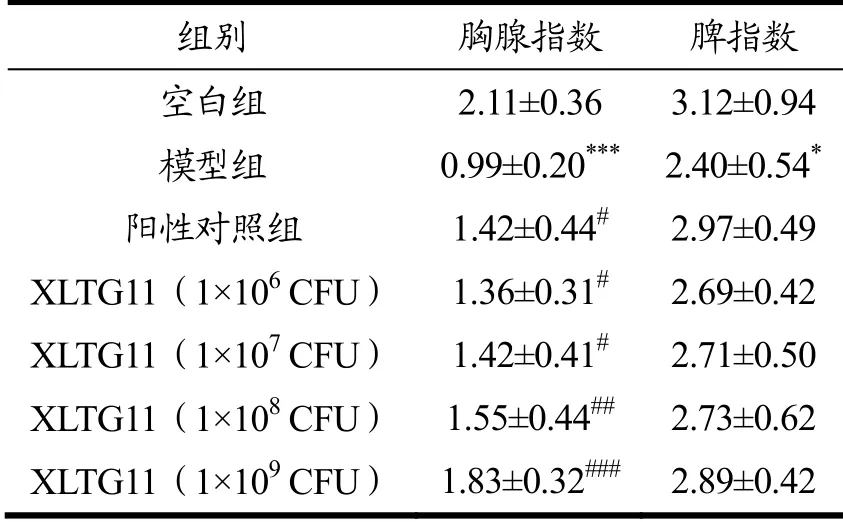
表1 XLTG11不同剂量组对CTX小鼠胸腺和脾指数的影响 Table 1 Effect of different dose groups of XLTG11 on thymus and spleen indexes in CTX mice (±S, n=8)
注:*p<0.05,***p<0.001,与空白组比较;#p<0.05,##p<0.01,###p<0.001与模型组比较。
组别 胸腺指数 脾指数 空白组 2.11±0.36 3.12±0.94模型组 0.99±0.20*** 2.40±0.54*阳性对照组 1.42±0.44# 2.97±0.49 XLTG11(1×106 CFU) 1.36±0.31# 2.69±0.42 XLTG11(1×107 CFU) 1.42±0.41# 2.71±0.50 XLTG11(1×108 CFU) 1.55±0.44## 2.73±0.62 XLTG11(1×109 CFU) 1.83±0.32### 2.89±0.42
2.2 各组小鼠DTH测定
SRBC诱导小鼠DTH评价乳双歧杆菌对细胞免疫功能的影响[13],结果如表2所示。与空白组比较,模型组小鼠足跖厚度显著降低(p<0.05),XLTG11(1×109CFU)组小鼠足跖厚度增加,增加效果32%(p<0.05)。与模型组比较,阳性对照组小鼠足跖厚度显著增加,增加效果58.82%(p<0.01),XLTG11各剂量组小鼠足跖厚度均增加(p<0.05),且随着给药剂量增大效果越显著,增加效果分别为38.24%(p<0.05)、50.00%(p<0.05)、55.89%(p<0.01)、94.12%(p<0.001)。
表2 XLTG11不同剂量组对CTX小鼠足跖厚度的影响 Table 2 Effect of different doses of XLTG11 on plantar thickness of CTX mice (±S, n=8)

表2 XLTG11不同剂量组对CTX小鼠足跖厚度的影响 Table 2 Effect of different doses of XLTG11 on plantar thickness of CTX mice (±S, n=8)
注:*p<0.05,与空白组比较;#p<0.05,##p<0.01,###p<0.001与模型组比较。
组别 足跖厚度/mm 空白组 0.50±0.04 模型组 0.34±0.08* 阳性对照组 0.54±0.11## XLTG11(1×106 CFU) 0.47±0.12# XLTG11(1×107 CFU) 0.51±0.05# XLTG11(1×108 CFU) 0.53±0.09## XLTG11(1×109 CFU) 0.66±0.24*###
2.3 各组小鼠小肠黏膜组织病理变化
人体70%的淋巴细胞都存在于肠道,肠道具有黏膜免疫功能,是机体最大的免疫器官,其组织结构的完整性可以反应肠道健康状况,而肠道健康又直接决定了人体健康[14]。研究表明,CTX具有抑制肠道黏膜免疫作用[15],而乳双歧杆菌属益生菌对维持肠道微生态平衡,增强肠道免疫功能尤为重要[16]。各组小鼠肠组织HE染色结果见图1。空白组小鼠小肠黏膜组织结构完好,绒毛排列整齐紧密,粗细均匀。模型组小鼠小肠黏膜组织损伤,肠壁变薄,绒毛萎缩长短不一,且排列稀疏。阳性对照组和XLTG11各剂量组小鼠小肠黏膜组织损伤均有改善,绒毛病变程度减轻。随着剂量增加,小鼠的小肠黏膜损伤情况得到缓解,呈剂量依赖性,以XLTG11(1×109CFU)效果最明显。
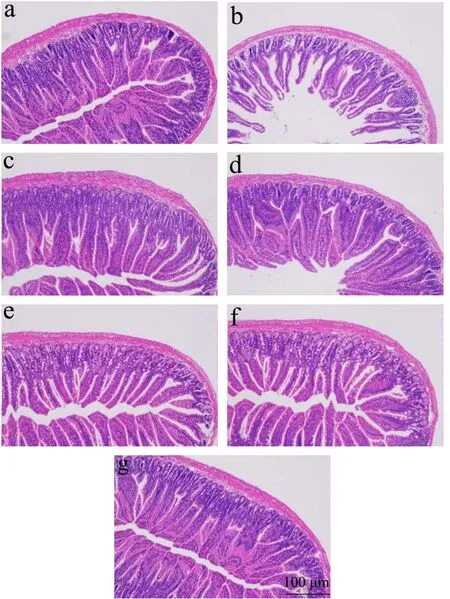
图1 光学显微镜下观察小肠黏膜组织苏木精-伊红(HE)染色(×100) Fig.1 Observation of small intestinal mucosa tissues hematoxylin-eosin (HE) staining under the light microscope (×100)
2.4 各组小鼠小肠黏膜绒毛高度和杯状细胞数目测定
在小肠黏膜层中,小肠黏膜向管腔内伸出的指状突起为绒毛,绒毛外部被覆一层单层柱状细胞,柱状细胞间的粘液分泌细胞即为杯状细胞。小肠绒毛高度和小肠与营养物质接触面积直接相关,绒毛高度是衡量机体生长发育的重要指标,绒毛越高则证明小肠吸收转化营养物质能力越好,在一定程度上反应化学消化能力以及细胞的更新状态[17]。杯状细胞数量与小肠黏膜免疫功能密切相关,杯状细胞可以调节黏蛋白合成相关过程,参与肠道黏膜屏障构成[18]。Nana Wang等[19]发现乳双歧杆菌XLTG11可以改善硫酸葡聚糖钠致小鼠结肠组织结构损伤,拮抗杯状细胞数目减少,从而增强小鼠肠道黏膜免疫功能。各组小鼠小肠黏膜绒毛高度HE染色结果见图1,杯状细胞数目PAS染色结果见图2,测定结果见表3。与空白组比较,模型组小鼠小肠绒毛高度显著降低(p<0.001),杯状细胞数目降低(p<0.05)。与模型组比较,阳性对照组小鼠小肠绒毛高度增高,增加效果为16.91%(p<0.05),杯状细胞数目增加,增加效果为47.83%,XLTG11各剂量组小鼠小肠绒毛高度均增加,剂量由小到大增加效果分别为15.23%(p<0.05),15.77%(p<0.05),16.35%(p<0.05),20.82%(p<0.01)。1×107CFU组杯状细胞数目增加33.59%,1×108CFU增加40.45%,1×109CFU增加51.23%。实验结果表明,乳双歧杆菌XLTG11可以提高小肠绒毛高度,增加小肠对营养物质的吸收转化,增加杯状细胞数目,拮抗CTX对肠道黏膜造成的损伤,对小鼠肠道黏膜免疫具有明显增强作用,与Nana[19]研究结果相一致。
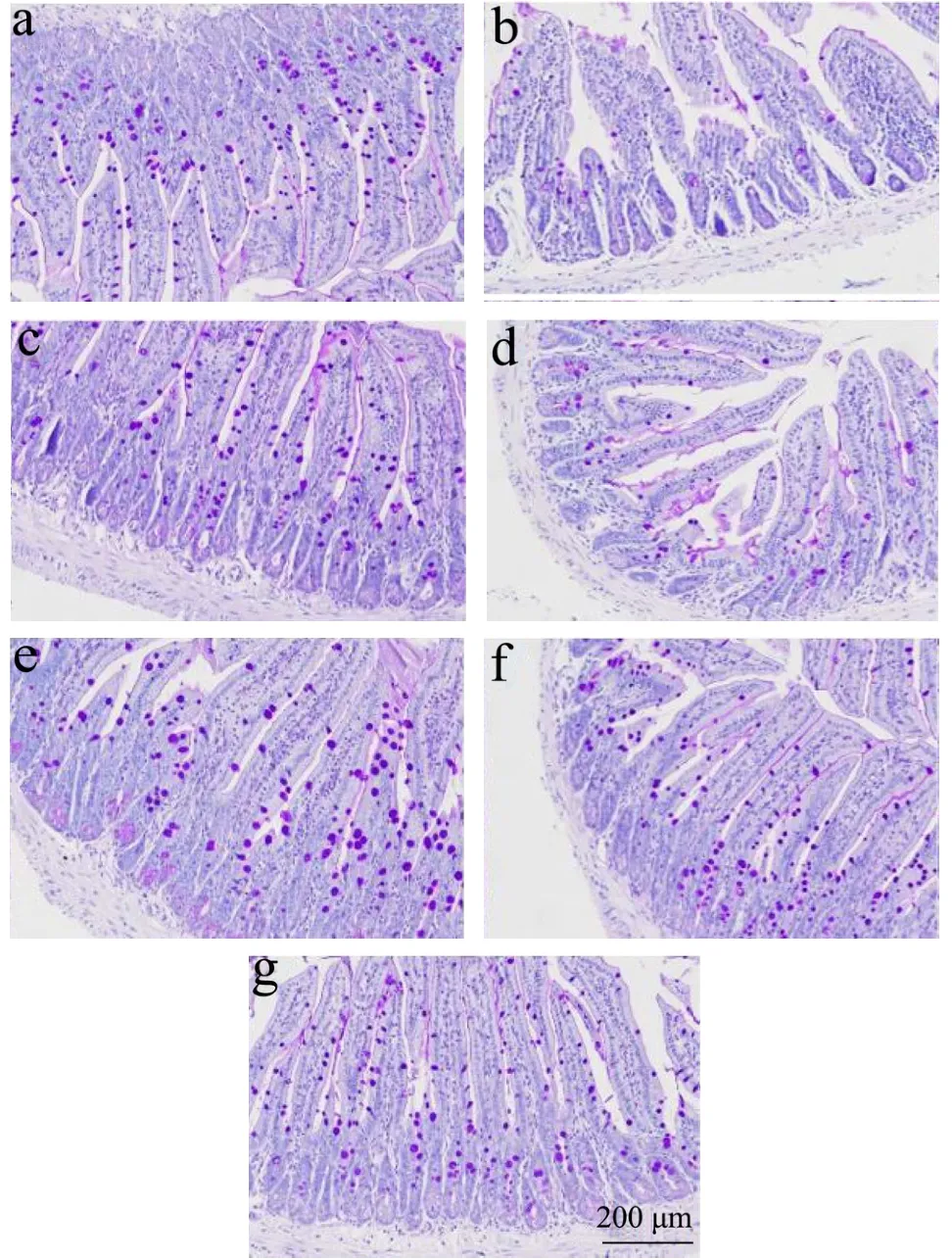
图2 光学显微镜下观察小肠黏膜组织碘酸雪夫氏(PAS)染色(×200) Fig.2 Observation of small intestinal mucosa tissues periodic acid-schiff (PAS) staining under the light microscope (×200)
表3 XLTG11不同剂量组对小肠黏膜绒毛高度和杯状细胞数目的影响 Table 3 Effect of different doses of XLTG11 on villus height and goblet cell number of small intestinal mucosa (±S, n=8)

表3 XLTG11不同剂量组对小肠黏膜绒毛高度和杯状细胞数目的影响 Table 3 Effect of different doses of XLTG11 on villus height and goblet cell number of small intestinal mucosa (±S, n=8)
注:*p<0.05,***p<0.001,与空白组比较;#p<0.05,##p<0.01,与模型组比较。
组别 绒毛高度/mm 杯状细胞数目空白组 338.22±29.51 23.90±5.01 模型组 264.80±26.27*** 17.06±3.49* 阳性对照组 309.58±51.42# 25.22±5.93## XLTG11(1×106CFU) 305.13±34.31# 19.50±6.77 XLTG11(1×107CFU) 306.57±32.71# 22.79±3.53# XLTG11(1×108CFU) 308.10±38.47# 23.96±5.68# XLTG11(1×109CFU) 319.93±51.5## 25.80±7.90##
2.5 各组小鼠血清IgA、IgG、IL-2、IL-6、IFN-γ、TNF-α水平测定
机体内IgA和IgG浓度升高可以说明机体能更好地应对胃肠道中病原体定植的负面影响,从而发挥免疫调节作用[20]。IL-2是T细胞系Th1型细胞因子,可诱导杀伤细胞产生其他细胞因子,如IFN-γ、TNF-α等[21]。IL-6是Th2型细胞因子,主要来自于活化的T细胞和其他免疫细胞分泌[22],促进B淋巴细胞向浆细胞增殖分化,从而分泌特异性免疫球蛋白参与体液免疫[23,24]。各组小鼠血清细胞因子结果见表4。与空白组比较,模型组小鼠血清IgA、IgG、IL-2、IL-6、IFN-γ、TNF-α水平明显降低(p<0.05),说明CTX会干扰小鼠血清细胞因子分泌。与模型组比较,阳性对照组小鼠血清IgA、IgG、IL-2、IL-6、IFN-γ、TNF-α水平分别升高15.65%(p<0.01)、23.67%(p<0.01)、24.92%(p<0.05)、36.49%(p<0.01)、15.54%(p<0.05)、20.39%(p<0.01);乳双歧杆菌XLTG11四个剂量组对IgA、IL-2、和TNF-α含量均有显著提高作用(p<0.05),1×108CFU组IgG、IL-6、IFN-γ水平分别升高16.52%(p<0.05)、21.65%(p<0.05)、14.10%(p<0.05);1×109CFU组分别升高35.60%(p<0.001)、22.76%(p<0.05)、18.06%(p<0.01)。本实验前期研究结果[4]显示,乳双歧杆菌XLTG11对CTX致免疫低下小鼠的脾脏T淋巴细胞亚群平衡具有调节作用,可提高小鼠脾脏T淋巴细胞CD3+、CD19+、CD4+CD8-和CD4-CD8+百分比。研究表明,CD19+参与B淋巴细胞发育再生,促进免疫球蛋白类别转换,使被激活的B细胞膜表面表达和分泌的免疫球蛋白类别从产生IgM转换为产生IgG、IgA或IgE,从而升高血清中免疫球蛋白IgA和IgG表达水平[25]。CD4+CD8-和CD4-CD8+T淋巴细胞与细胞因子IL-2和TNF-α呈正相关[26]。因此,我们推测乳双歧杆菌XLTG11增强小鼠免疫功能是通过刺激淋巴细胞增殖分化,升高B淋巴细胞和T淋巴细胞分泌免疫球蛋白及Th1细胞、Th2细胞因子水平参与机体免疫反应实现的。
表4 各组小鼠血清IgA、IgG、IL-2、IL-6、IFN-γ、TNF-α水平 Table 4 Levels of serum IgA, IgG, IL-2, IL-6, IFN-γ, TNF-α of rats in various groups (±S, n=8)

表4 各组小鼠血清IgA、IgG、IL-2、IL-6、IFN-γ、TNF-α水平 Table 4 Levels of serum IgA, IgG, IL-2, IL-6, IFN-γ, TNF-α of rats in various groups (±S, n=8)
注:*p<0.05,**p<0.01,***p<0.001,与空白组比较;#p<0.05,##p<0.01,###p<0.001,与模型组比较。
组别 IgA/(ng/mL) IgG/(ng/mL) IL-2/(ng/L) IL-6/(pg/mL) IFN-γ/(ng/L) TNF-α/(ng/L)空白组 57.87±3.64 462.19±21.64 700.68±123.49 82.29±7.06 472.73±51.55 467.16±30.28模型组 48.38±3.65** 378.10±92.63** 533.40±65.94** 56.50±13.29*** 403.99±64.51* 412.70±57.50*阳性对照组 55.95±3.66## 467.59±54.35## 666.32±134.02# 77.12±17.49## 466.78±62.60# 496.86±49.31##XLTG11(1×106 CFU) 54.11±3.19# 405.24±35.33 646.22±142.10# 61.59±8.77 399.58±51.32 463.58±38.69#XLTG11(1×107 CFU) 54.75±3.30# 432.87±32.42# 663.80±103.17# 67.96±5.73 433.15±53.26 465.62±41.08#XLTG11(1×108 CFU) 56.95±8.72## 440.56±47.27# 673.12±80.22# 68.73±14.61# 460.97±33.15# 468.12±78.39#XLTG11(1×109 CFU) 58.07±6.85### 512.72±21.05### 725.08±63.62## 69.36±9.44# 476.94±47.67## 472.56±33.93#
3 结论
本实验研究结果显示,40 mg/kg CTX连续腹腔注射2 d可显著降低小鼠胸腺指数和脾指数、降低足跖肿胀度,降低小肠绒毛高度和杯状细胞数目,降低血清免疫球蛋白IgA、IgG和细胞因子IL-2、IL-6、IFN-γ、TNF-α的水平(p<0.05),成功建立小鼠免疫功能低下模型。在灌胃给予各剂量组乳双歧杆菌XLTG11干预28 d后,CTX小鼠免疫功能低下情况得到明显改善,乳双歧杆菌XLTG11(1×109CFU)组小鼠胸腺指数提高了84.84%,足跖肿胀程度增加了94.12%(p<0.05),血清细胞因子IgA、IgG、IL-2、IL-6、TNF-γ和TNF-α水平分别升高20.03%(p<0.001)、35.60%(p<0.001)、36.03%(p<0.01)、22.76%(p<0.05)、18.06%(p<0.01)、14.50%(p<0.05),且呈剂量依赖性,表现出增强机体免疫功能的作用。此外,乳双歧杆菌XLTG11可以缓解小肠黏膜组织损伤,减轻组织病变程度,增加小肠绒毛高度和杯状细胞数目,1×109CFU组小鼠小肠绒毛高度增加20.82%(p<0.01),杯状细胞数目增加51.23%(p<0.01),表现出较好的黏膜免疫调节和肠道屏障保护作用,具有较强的肠道黏膜免疫增强作用。综上,乳双歧杆菌XLTG11具有增强免疫功能作用,且呈剂量依赖性。这一结论为乳双歧杆菌XLTG11在保健品方面的开发与应用提供了理论支持。

