雪菊乙醇提取物对丙烯酰胺所致肝损伤的保护作用
高娟娟,李爽,马瑞,邵蕾,谢艾迪,王祯,赵怡,黎钰欣,韩海霞
(新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052)
丙烯酰胺(acrylamide,ACR)由高脂肪、高淀粉食品在高温加工过程发生美拉德反应而产生[1]。目前,ACR的神经毒性、遗传毒性、免疫毒性、肝毒性及潜在致癌性已被证实[2,3]。早在1994年,ACR就被国际癌症研究机构认定为“2A类可能致癌物”[4]。然而,在某些食品加工过程中不可避免地产生ACR,并随食物一起被人们食用。因此寻找可拮抗ACR毒性的天然产物具有重要意义。有研究结果显示,一些天然抗氧化剂可拮抗ACR诱发的神经、肝脏、肠组织细胞毒性,如灵芝多糖、蓝莓花色苷、山药多糖、原花青素、矢车菊-3-葡萄糖、水飞蓟素、发酵火麻仁蛋白粉等,其机制均与抗氧化应激有关[5-13]。由此可见,利用天然抗氧化剂拮抗ACR引起的体内氧化应激损伤,是拮抗食源性ACR的重要途径。
雪菊(Coreopsis tinctoriaNutt.),学名两色金鸡菊、蛇目菊,为菊科金鸡菊属多年生草本植物的干燥头状花序,可作为药食两用类原料用于食品和药物的开发与应用。研究发现,雪菊富含总黄酮、蛋白质、酚类等多种活性物质,具有抗炎、降脂、降压、降糖、抗凝血、抗氧化、抗病毒等生理活性[14]。研究表明雪菊乙醇提取物具有较强的抗氧化活性,其中所含的奥卡宁和异奥卡宁对1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除率的EC50分别为6.2、10.6 μmoL/L,远远高于维生素C等阳性对照物[15],且有研究表明雪菊中原花青素对CCl4所致小鼠急性肝损伤有一定保护作用[16]。具有强抗氧化活性的雪菊乙醇提取物是否对ACR所致肝损伤有保护作用值得探讨。因此,本实验利用ACR诱导人肝癌HepG2细胞毒性,建立细胞损伤模型,采用MTT法检测雪菊乙醇提取物对ACR致HepG2细胞损伤模型存活率的影响,同时,利用ACR诱导小鼠肝损伤,探讨雪菊乙醇提取物对ACR诱导小鼠肝损伤的保护作用及机制。本研究为雪菊对ACR致肝损伤的保护作用的进一步研究以及雪菊利用价值的深度开发提供一定的理论依据。
1 材料、仪器与方法
1.1 材料与试剂
雪菊购于新疆乌鲁木齐北园春干果市场,源于和田皮山县,由新疆农业大学食品科学与药学学院朱金芳教授鉴定。
清洁级ICR雄性小鼠,购于新疆医科大学实验动物中心,许可证号:SYXK(新)2018-0003,体重18~22 g,实验室条件下适应性喂养4 d后,用于正式实验。
人肝癌细胞株HepG2,由新疆农业大学细胞与分子实验室包晓玮教授提供;胎牛血清,美国Hyclone公司;N-乙酰半胱氨酸(N-acetyl-L-cysteine,NAC),上海源叶生物科技有限公司;丙烯酰胺,上海阿拉丁生化科技股份有限公司;双抗(青霉素和链霉素)、2",7"-二氢二氯荧光素二乙酸酯(2",7"-Dichlorodihydrofluorescein diacetate,DCFH-DA)、色谱甲醇、色谱乙腈,美国Sigma公司;噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT)、细胞增殖及细胞毒性检测试剂盒、谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、丙二醛(malondialdelyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶活性(glutathione peroxidase,GSH-Px)及BCA蛋白浓度测定试剂盒,南京建成生物工程研究所;其余试剂均为国产分析纯。
1.2 仪器设备
SW-CJ-2FD型双人单面净化工作台,中国苏州净化设备有限公司;ZWY-200D型恒温培养振荡器,上海智能分许仪器制造有限公司;BIONOON-VAC3型低温冷冻浓缩机,上海般诺生物科技有限公司;AE-31型数码倒置显微镜,中国厦门麦克奥迪公司;AL204-IC型电子天平,梅特勒-托多利仪器有限公司;Shellab型二氧化碳培养箱,美国希尔顿公司;xMarkTM型酶标仪,伯乐生命医学产品有限公司厂;SF-GL-16A型高速离心机,上海菲恰尔分析仪器有限公司;KQ-250DE型超声波清洗器,昆山超声仪器有限公司。
1.3 方法
1.3.1 雪菊乙醇提取物的制备
准确称取500 g雪菊,于40 ℃干燥4 h。加10 L 70%乙醇,常温浸泡2 h,过滤,滤渣再加7.5 L 70%乙醇浸提两次,三次滤液合并后真空浓缩,浓缩液经冷冻干燥后得雪菊乙醇提取物。参考文献方法[17]测得其中总黄酮含量为18.3%。
1.3.2 雪菊乙醇提取物对ACR致HepG2细胞损伤的保护作用
1.3.2.1 细胞培养、预处理及分组
按参考文献[7]方法并稍加改动,细胞预处理及分组如下:空白组(正常培养的HepG2细胞);ACR损伤模型组(ACR组,HepG2细胞经ACR溶液孵育24 h);阳性药对照组(NAC组,即HepG2细胞先用NAC溶液孵育6 h,再用ACR溶液孵育24 h);雪菊低、中、高浓度组(HepG2细胞先用不同浓度的雪菊溶液孵育6 h,再用ACR溶液孵育24 h)。
1.3.2.2 ACR致HepG2细胞损伤模型的建立
按参考文献[7,13]并稍加改动,将处于对数生长期的HepG2细胞接种于96孔板,细胞密度为1×104cells/mL,过夜培养,分别向孔中加入用不含血清培养基配置的不同浓度的ACR溶液(1.25、2.50、5.00、10.00、20.00 mmol/L)100 μL作为ACR组,每个浓度平行3个孔,同时,留3个孔加100 μL不含血清的培养基作为空白组(不加ACR溶液的细胞),37 ℃孵育24 h后,各孔加MTT溶液20 μL继续孵育4 h后,吸出各孔溶液并弃去,加DMSO 150 μL,避光条件下震荡10 min(100 r/min),用酶标仪在570 nm处测定不同浓度模型组和空白组的OD值,将OD值代入公式(1)计算各组细胞存活率,根据细胞存活程度确定建立HepG2细胞损伤模型的ACR浓度。

式中:
OD1——添加了不同浓度ACR溶液的各孔吸光度值;
OD2——空白对照组的吸光度值。
1.3.2.3 雪菊乙醇提取物对HepG2细胞增殖的影响
将处于对数生长期的HepG2细胞接种于96孔板,细胞密度为1×104cells/mL,过夜培养,分别向孔中加入用不含血清培养基配置的不同浓度的雪菊乙醇提取物溶液(0.125、0.25、0.50、1.00、2.00 mg/mL)作为实验组,每个浓度平行3个孔,同时,留3个孔加100 μL不含血清的培养基作为空白组(不加雪菊乙醇提取物),37 ℃孵育24 h后,按“1.3.2.2”项下MTT法测定不同浓度雪菊乙醇提取物实验组和空白组的OD值,并按公式(2)计算细胞存活率,根据细胞存活程度确定加入的雪菊乙醇提取物浓度。

式中:
OD3——添加了不同浓度雪菊乙醇提取物溶液的各孔吸光度值;
OD4——空白对照组的吸光度值。
1.3.2.4 雪菊乙醇提取物对ACR所致HepG2细胞损伤模型存活率的影响
按“1.3.2.1”项下方法培养细胞以及进行细胞预处理和分组后,按“1.3.2.3”项下方法操作,采用MTT法测定空白组、ACR组、NAC组(浓度1.50 mg/mL)和雪菊乙醇提取物低、中、高浓度组(0.50、1.00、2.00 mg/mL)的OD值,并按公式(3)计算细胞存活率,根据细胞存活率考察雪菊乙醇提取物对ACR诱导HepG2细胞毒性的保护作用。

式中:
OD5——ACR组、NAC组和雪菊低、中、高浓度组的吸光度值;
OD6——空白对照组的吸光度值。
1.3.2.5 雪菊乙醇提取物对ACR所致HepG2细胞损伤下氧化应激生物标志物的影响
按细胞密度为5×104cells/mL将HepG2细胞接种于12孔板,每孔1 mL,置于培养箱(37 ℃、5% CO2)中培养24 h后,按“1.3.2.1”项下方法进行细胞预处理和分组,得到空白组、ACR组、NAC组(1.50 mg/mL)和雪菊低、中、高浓度组(0.50、1.00、2.00 mg/mL),各组37 ℃孵育24 h后,移去培养基,用不含血清的培养基清洗3次,避光条件下每孔加入以不含血清的培养基配制的DCFH-DA溶液1 mL,浓度为10.00 μmol/L,避光孵育30 min后,移去孔中溶液,用不含血清的培养基充分清洗3次,再向各孔加RIPA缓冲液,反复吹打均匀后,收集细胞悬浮液,离心15 min(13000 r/min),收集上清液后,采用酶标仪检测荧光强度,用BCA法测定每孔裂解液中蛋白总量,以每孔蛋白总量校正荧光强度,以各组荧光强度与空白对照组荧光强度比值考察细胞内活性氧(reactive oxygen species,ROS)相对水平。
按上述方法,除不加荧光探针DCFH-DA外,同法操作如培养细胞、各组预处理与孵育、细胞裂解、收集细胞、离心后,按MDA、CAT、SOD和GSH-Px试剂盒操作说明测定MDA、CAT、SOD和GSH-Px,用BCA法测定每孔裂解液中蛋白总量,以每孔蛋白总量校正各指标值。
1.3.3 雪菊乙醇提取物对ACR所致小鼠肝损伤的保护作用
1.3.3.1 动物分组及给药方法
健康ICR小鼠分为6组,每组10只,分别为空白组(灌胃0.5%羧甲基纤维素钠)、ACR模型组(灌胃25 mg/kg ACR)、雪菊低剂量组(灌胃25 mg/kg ACR+0.25 g/kg雪菊乙醇提取物)、雪菊中剂量组(灌胃25 mg/kg ACR+0.5 g/kg雪菊乙醇提取物)、雪菊高剂量组(灌胃25 mg/kg ACR+1.0 g/kg雪菊乙醇提取物)、阳性药对照组(NAC组,灌胃25 mg/kg ACR+320 mg/kg NAC)。连续给药28 d。
1.3.3.2 样品采集与处理
实验结束前禁食不禁水12 h,摘眼球取血,常规分离制备血清,备用。同时快速剥离肝脏,称重记录,-80 ℃保存备用。
1.3.3.3 雪菊乙醇提取物对ACR所致小鼠肝损伤保护作用的指标测定
参照试剂盒说明书测定小鼠血清ALT、AST活力。肝脏组织匀浆后,参照试剂盒说明书检测MDA含量,SOD、GSH-Px活性。
1.3.3.4 HE染色法观察肝脏组织病理变化
将新鲜的肝脏组织取出后立即浸没在组织固定液内24 h,无水乙醇脱水后,石蜡包埋并进行切片,HE常规染色,显微镜观察肝脏组织的病理学变化。
1.3.4 数据处理
运用GraphPad Prism 5.0对实验数据进行单因素方差分析(One-way ANOVA),图表采用GraphPad Prism 5.0绘制,结果以平均值±标准误差(Mean±SD)表示。
2 结果与讨论
2.1 雪菊乙醇提取物对ACR所致HepG2细胞损伤的保护作用
2.1.1 不同浓度ACR对HepG2细胞存活率的影响
HepG2细胞经1.25、2.50、5.00、10.00、20.00 mmol/L的ACR孵育24 h后,细胞存活率结果如图1所示。由图可知,与空白组相比,当ACR浓度为0.25~20.00 mmol/L时,均对细胞产生毒性,且随着浓度的增加,HepG2细胞存活率明显降低,尤其经5.00、10.00 mmol/L ACR处理以后,细胞死亡达41.33%、53.97%(p<0.001)。经计算,0.125~20.00 mmol/L浓度范围内,ACR处理24 h致HepG2细胞损伤的半数致死剂量(median lethal dose,LD50)为8.00 mmol/L,对比李亮等[8]研究ACR对HepG2细胞的毒性作用选用剂量,故本实验选用8.00 mmol/L ACR诱导HepG2细胞建立细胞损伤模型。

图1 ACR对HepG2细胞存活率的影响 Fig.1 Effect of ACR on the survival rate of HepG2 cell
2.1.2 不同浓度雪菊乙醇提取物对HepG2细胞增殖的影响
本实验以雪菊乙醇提取物为研究对象,利用MTT法检测其对HepG2细胞增殖的影响,结果如图2所示。与空白组相比,HepG2细胞在不同浓度(0.125、0.25、0.50、1.00、2.00 mg/mL)雪菊乙醇提取物的作用下,其存活率并未受到影响(p>0.05),表明雪菊乙醇提取物在此范围内未对HepG2细胞产生细胞损伤,属于安全浓度范围,因此,选择0.50、1.00、2.00 mg/mL分别为雪菊乙醇提取物的低、中、高浓度,评价其对ACR诱导HepG2细胞损伤的保护作用。

图2 雪菊乙醇提取物对HepG2细胞存活率的影响 Fig.2 Effect of C. tinctoria ethanol extract on the survival rate of HepG2 cells
2.1.3 雪菊乙醇提取物对ACR所致HepG2细胞损伤的保护作用
由表2可知,各组细胞经ACR处理4、8、16、24 h后,与空白组相比,HepG2细胞的存活率明显下降(p<0.05),四个时间段下细胞损伤率分别为11.20%、39.70%、46.70%、51.37%,提示随着与ACR共同孵育时间的延长,HepG2细胞的损伤率也逐渐增加,尤其孵育24 h时,损伤率达到50%以上。而NAC(1.50 mg/mL)对HepG2细胞预处理8 h,细胞存活率达到70.67%,对ACR所致细胞损伤表现出明显的保护作用(p<0.05),当预处理达16 h,可使细胞存活率增加20.37%,雪菊乙醇提取物高浓度组(2.00 mg/mL)预处理4 h起,即可使细胞存活率达到98.77%,对ACR所致细胞损伤表现出较为明显的保护作用(p<0.05),且随着时间的延长,雪菊乙醇提取物中浓度(1.00 mg/mL)和高浓度(2.00 mg/mL)也逐渐表现出更加明显的保护作用(p<0.01)。ACR孵育24 h,ACR组HepG2细胞存活率降至48.63%,而雪菊乙醇提取物中、高浓度组使细胞存活率分别维持在60.37%、61.43%。郝瑞芳等[18]研究表明ACR对HepG2细胞的损伤作用与ACR浓度和孵育时间呈正相关性,用ACR对HepG2细胞孵育0~12 h,细胞存活率也随孵育时间的延长而逐渐下降,本实验结果和“3.1.1”实验结果也表明随着ACR浓度和孵育时间的增加,细胞损伤率也呈上升趋势,与郝瑞芳等的结果一致。而雪菊乙醇提取物中、高浓度组可使细胞存活率明显提高,且随着孵育时间的增加,细胞存活率相比于ACR组,可增加10%~15%,表明雪菊乙醇提取物对ACR诱导的HepG2细胞损伤具有一定保护作用。有文献表明[19],黄酮类化合物对ACR的毒性有干预作用,沈洋等[20]证明黄酮类化合物杨梅素对ACR所致小肠上皮细胞的毒性有保护作用。雪菊总黄酮含量高,约为11%~21%[21],本文制得的雪菊乙醇提取物中总黄酮含量为18.3%,提示雪菊乙醇提取物对ACR所致HepG2细胞损伤的保护作用可能与其中黄酮类化合物有关。另外,也有文献报道,ACR通过氧化应激损伤产生细胞毒性[8,11],雪菊提取物对细胞损伤的保护作用是否与阻断ACR引起的氧化损伤有关,有待进一步研究。
2.1.4 氧化指标的测定
2.1.4.1 ROS相对水平
当细胞内ROS积累到一定水平,可导致细胞发生氧化应激现象,导致细胞氧化损伤,因此,考察细胞是否发生了氧化损伤的首要指标就是检测细胞内ROS水平[22]。ROS相对水平采用荧光探针DCFH-DA法测定,结果如图3所示。由图3可知,与空白组相比,ACR可引起细胞内ROS相对水平显著增加(p<0.001)。与ACR组相比,阳性药NAC显著降低HepG2细胞内ROS相对水平(p<0.001),雪菊乙醇提取物中浓度(1.00 mg/mL)、高浓度(2.00 mg/mL)尤其高浓度能够使HepG2细胞内ROS相对水平显著降低57.67%(p<0.01)。曹菲薇等[23]研究表明阿胶可通过抑制ROS的生成发挥对ACR诱导的斑马鱼胚胎损伤的保护作用。沈洋[20]实验也表明ACR使Caco-2细胞内ROS荧光强度急剧增加,而给予杨梅素处理,ROS荧光强度降低58%。本实验结果也证明ACR会刺激HepG2细胞内ROS大量增加,而雪菊乙醇提取物可大量减少因ACR导致的胞内ROS产生和积聚,提示雪菊乙醇提取物可能通过阻断ACR致胞内ROS水平的升高而发挥HepG2细胞保护作用。
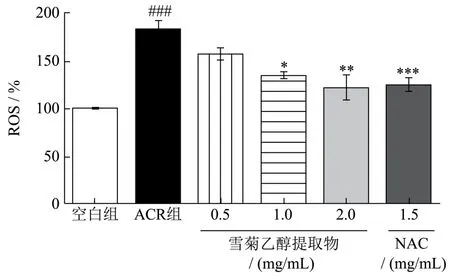
图3 雪菊乙醇提取物对ACR所致HepG2细胞损伤下ROS相对水平的影响 Fig.3 Effect of C. tinctoria ethanol extract on ROS relative levels in ACR - induced HepG2 cell

表1 雪菊乙醇提取物对ACR所致HepG2细胞损伤的保护作用 Table 1 Protective effects of C. tinctoria ethanol extract on ACR - induced HepG2 cell
2.1.4.2 MDA、CAT、SOD和GSH-Px的测定
测定细胞内MDA含量,是为考察机体脂质过氧化程度,从而间接评价细胞氧化损伤程度。CAT、SOD和GSH-Px是重要的抗氧化酶,因此,通过测定酶活力,可评价化合物的抗氧化能力[24]。雪菊乙醇提取物对ACR所致HepG2细胞损伤后细胞内MDA含量,CAT、SOD和GSH-Px活力的影响结果见图4。由图4可知,与空白组相比,ACR使HepG2细胞内MDA含量显著上升(p<0.001),CAT、SOD和GSH-Px活力显著降低(p<0.001)。与ACR组相比,NAC和雪菊乙醇提取物均降低HepG2细胞内MDA含量,提高CAT、SOD和GSH-Px水平。雪菊乙醇提取物中浓度(1.00 mg/mL)、高浓度(2.00 mg/mL)尤其高浓度能够使HepG2细胞内MAD由8.38 nmol/mg降低到3.70 nmol/mg(p<0.001),CAT、SOD和GSH-Px分别由4.73、8.07、10.64 U/mg升高到9.41、18.55、24.45 U/mg(p<0.001),且雪菊乙醇提取物对四种酶水平的影响呈剂量依赖关系。吕玲珠[9]研究结果表明蓝莓花色苷能有效恢复ACR导致的HepG2细胞损伤,通过降低MDA含量、升高SOD,CAT酶活性抑制ACR对HepG2细胞的氧化损伤作用。蔡小华等[25]实验发现辣木叶水提物也通过降低HepG2细胞内MDA水平,提高GSH-Px和SOD等酶类的活力发挥对H2O2导致HepG2细胞损伤的保护作用。本实验结果也表明雪菊乙醇提取物可降低HepG2细胞内MDA含量,提高CAT、SOD和GSH-Px等酶活力,提示雪菊乙醇提取物可能通过抗氧化机制发挥ACR致HepG2细胞损伤的保护作用。
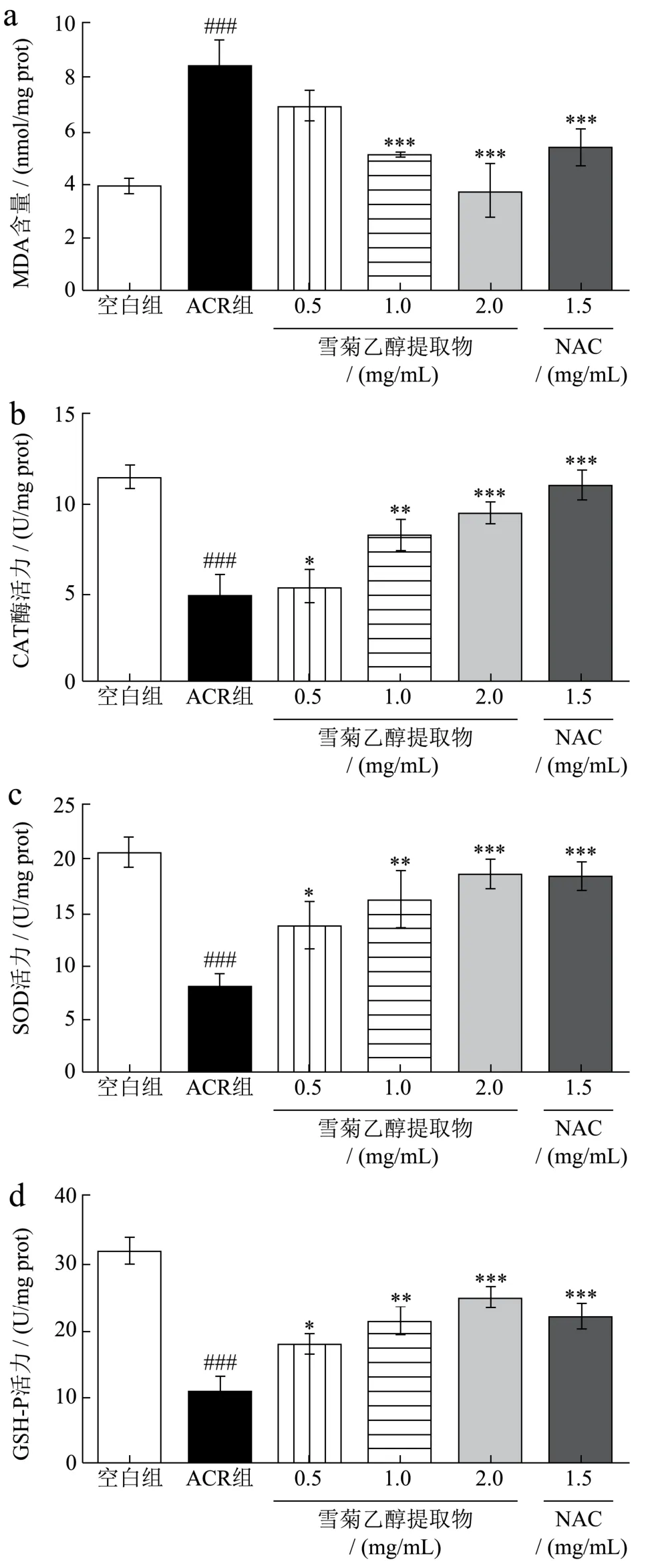
图4 雪菊乙醇提取物对ACR致HepG2细胞损伤下MDA(a)、CAT(b)、SOD(c)和GSH-Px(d)水平的影响 Fig.4 Effect of C. tinctoria ethanol extract on MDA (a), CAT (b), SOD (c) and GSH-Px (d) levels in ACR – induced HepG2 cell
2.2 雪菊乙醇提取物对ACR所致小鼠肝损伤的保护作用
2.2.1 小鼠体重变化
在适应性喂养期间,小鼠精神状态好、行动自如、进食量正常、毛发有光泽、无死亡现象。灌胃ACR造模后,小鼠出现精神不佳、活动减少、进食量减少、毛发粗糙等不良现象,推测可能是由于肝脏受到ACR损伤,肝功能不正常,导致小鼠体内代谢紊乱。雪菊提取物低、中、高剂量(0.25、0.50、1.00 g/kg)均可改善ACR引起的上述行为和体征。同时,每隔3 d测定各组小鼠体重,结果见图5。小鼠喂养28 d,空白组小鼠体重一直呈现增长的现象,体重变化率为28.93%,而ACR组小鼠体重呈先下降后增长趋势,体重变化率为10.25%,与空白组比较,有显著差异(p<0.001)。与ACR组相比,NAC和雪菊乙醇提取物低、中、高剂量可明显改善ACR引起的体重减少现象(p<0.01,p<0.01),从第7 d开始,小鼠体重一直呈明显上升趋势,至第28 d,NAC组和雪菊乙醇提取物低、中、高剂量组小鼠体重分别升高了27.45%、22.27%、25.86%、22.74%。李变丽等[26]研究发现镉致小鼠肝损伤使小鼠的体质量呈下降趋势,桑葚多糖使小鼠体质量下降的情况有所改善。本实验结果也表明雪菊乙醇提取物低、中、高剂量组可明显改善ACR引起的体重减少现象。
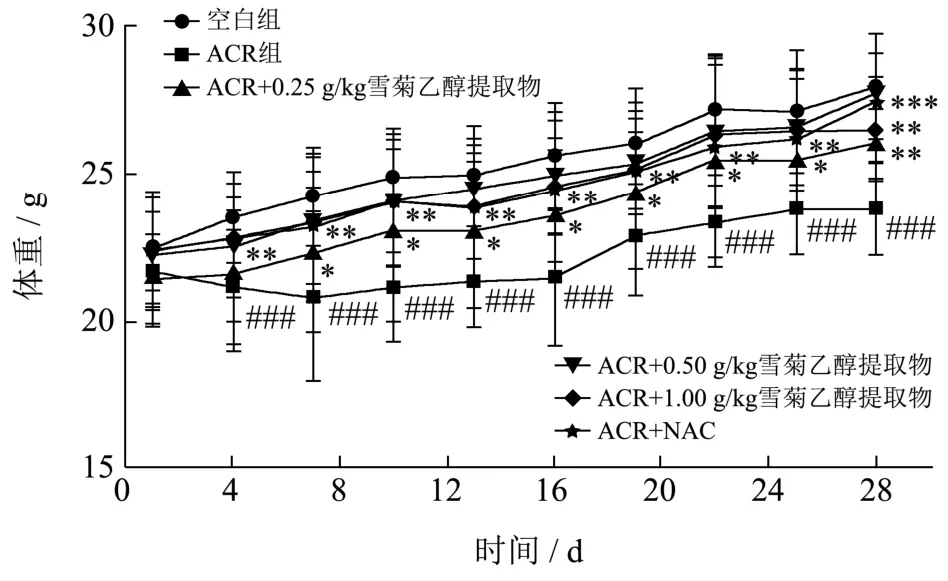
图5 雪菊乙醇提取物对ACR致毒小鼠体重的影响 Fig.5 Effect of C. tinctoria ethanol extract on body weight of ACR induced mice
2.2.2 血清ALT、AST
肝功能受损时,肝组织中ALT、AST等转氨酶进入到血液当中,导致血清中ALT、AST活力相对增加。因此,可通过检测血清中ALT、AST活力初步判断肝功能状况[27]。如图6所示,ACR组小鼠血清中ALT、AST活力明显高于空白组,分别由17.43、21.23 U/L升高至45.19、68.02 U/L,表明肝功能受到影响,造模成功。与ACR组比较,NAC组和雪菊乙醇提取物中、高剂量组(0.50、1.00 g/kg)ALT、AST活力显著下降(p<0.01),尤其是雪菊乙醇提取物高剂量组使ALT、AST活力分别下降了16.36、38.06 U/L。有研究结果表明昆仑雪菊原花青素[16]和蒲公英总黄酮[28]都能够降低四氯化碳致肝损伤小鼠血清中ALT、AST活力,对CCl4致肝损伤具有一定的保护作用。本实验结果也表明雪菊乙醇提取物能降低ACR所致肝损伤小鼠血清中的ALT、AST活力,表明雪菊乙醇提取物对ACR所致小鼠肝功能损伤有保护作用。

图6 雪菊乙醇提取物对ACR致毒小鼠血清ALT(a)、AST(b)的影响 Fig.6 Effects of C. tinctoria ethanol extract on serum ALT (a) and AST (b) of ACR induced mice
2.2.3 小鼠肝组织病理切片观察
对肝脏组织的病理学切片进行HE染色可以清晰地反映肝脏病理变化情况。如图7所示,空白组小鼠肝组织中肝小叶具有结构完整,肝细胞结构完整,排列整齐,细胞核大小正常、清晰可见;ACR组小鼠肝细胞破裂、排列紊乱,细胞核出现破裂、肿胀现象,部分细胞核消失;与ACR组相比,NAC组和雪菊乙醇提取物各剂量组小鼠肝细胞排列整齐,肝小叶结构完整,细胞核无明显的破裂、肿胀现象,损伤程度明显减弱。王莉等[27]实验发现黑枸杞多糖对ACR致大鼠肝损伤的肝组织病变情况得到很好的改善,黑枸杞多糖能够改善ACR染毒大鼠的肝损伤。本实验结果显示雪菊乙醇提取物低、中、高剂量组小鼠肝组织的损伤程度均有减轻,其中以高剂量组最为明显,肝组织结构清晰、无明显损伤,与NAC组的效果相似,表明雪菊乙醇提取物可减轻ACR所致的肝脏组织损伤,起到保护肝脏的作用。

图7 ACR致毒小鼠肝脏病理切片(HE,100×) Fig.7 Pathological sections of liver of ACR - induced mice (HE, 100×)
2.2.4 小鼠肝脏MDA、SOD、GSH-Px的测定
由图8可知,与空白组相比,ACR使小鼠肝脏中MDA含量显著上升(p<0.001),SOD、GSH-Px活力显著降低(p<0.001),而NAC组和雪菊乙醇提取物低、中、高剂量(0.25、0.50、1.00 g/kg)均能使小鼠肝脏内MDA含量显著降低(p<0.01),SOD、GSH-Px活力显著上升(p<0.01),雪菊乙醇提取物高剂量使MDA含量由7.21 nmol/mg降低到5.35 nmol/mg,SOD、GSH-Px由104.71、575.50 U/mg升高到161.44、905.94 U/mg,且雪菊乙醇提取物对MDA含量,SOD、GSH-Px活力的影响呈剂量依赖关系。有研究表明[29-31],白藜芦醇、藏红花素、橙皮素等天然抗氧化剂均可缓解ACR对鼠的肝损伤,其机制与降低MDA,提高SOD、GSH-Px抗氧化酶活性有关。研究表明雪菊提取物具有较强的抗氧化活性[15],且本文“2.2.2”和“2.2.3”实验结果证明雪菊乙醇提取物可缓解ACR对小鼠的肝损伤,本节小鼠肝脏MDA、SOD、GSH-Px的测定结果提示,雪菊乙醇提取物可能通过抗氧化机制对ACR所致的小鼠肝损伤发挥保护作用。

图8 雪菊乙醇提取物对ACR致毒小鼠肝脏MDA(a)、SOD(b)、GSH-Px(c)水平的影响 Fig.8 Effect of C. tinctoria ethanol extract on MDA (a), SOD (b) and GSH-Px (c) level of liver injury in induced - ACR mice
3 结论
3.1 本文研究雪菊乙醇提取物对ACR所致HepG2细胞损伤及小鼠肝损伤的保护作用。HepG2细胞经ACR处理后,存活率下降为48.63%,而雪菊乙醇提取物可使细胞存活率上升至61.43%。雪菊乙醇提取物能够显著抑制细胞内ROS相对水平和MDA含量,显著增高SOD、CAT、GSH-Px活性。动物实验结果表明,雪菊乙醇提取物可拮抗ACR引起的小鼠体重增长缓慢现象,能降低小鼠血清ALT、AST活力,降低肝脏MDA含量,提高肝脏SOD和GSH-Px活性;小鼠肝组织HE染色结果显示,雪菊乙醇提取物各剂量不同程度地改善小鼠肝小叶结构和肝细胞形态,减轻小鼠肝损伤,对肝组织有显著的保护作用。
3.2 综上所述,雪菊乙醇提取物对ACR诱导的HepG2细胞损伤及小鼠肝损伤均具有保护作用,此作用可能与抗氧化机制有关,本研究将对雪菊提取物在食源性ACR防治应用方面提供一定的理论依据。

