基于CT影像组学列线图鉴别非功能性神经内分泌肿瘤与实性假乳头状瘤
周永进,高瑞杰,江春燕,2,邓晶晶,夏水伟,沈少博,王祖飞,纪建松
1.浙江大学丽水医院 放射科 浙江省影像诊断与介入微创研究重点实验室,浙江 丽水 323000;2.松阳县人民医院 放射科,浙江 丽水 323400;3丽水市人民医院 放射科,浙江 丽水 323000
非功能性胰腺神经内分泌肿瘤(n o nfunctional pancreatic neuroendocrine tumors,NF-pNETs)是一种高度异质性、侵袭性生长的肿瘤[1],而实性假乳头状瘤(solid pseudopapillary tumors, SPTs)是良性或低度恶性肿瘤[2],相比较而言NF-pNETs的5年生存率(约65%)显著低于SPTs(95%)[3]。虽然手术切除是二者的主要治疗手段,但对于不可切除的NF-pNETs通常需采用化疗或靶向治疗[1],而SPTs目前尚无化疗指征[4]。由于此二者的治疗策略和预后不同,因此,对NF-pNETs和SPTs进行区分是必要的。虽然,SPTs常呈进行性强化,且NF-pNETs动脉期表现为显著均匀或环形强化[2],但是,NF-pNETs有时亦可表现为低增强,并且两种肿瘤均可有钙化和囊变[5],此时二者的区分存在困难。随着计算机技术的发展,影像组学技术已被广泛应用于医学领域并致力于临床转化应用[6]。通过对医学原始图片的肿瘤区域提取纹理特征,定量分析病灶灰度分布情况,可以非侵入性地获得比肉眼观察更多的客观特征,从而可以定量评估肿瘤的异质性。本研究通过基于CT平扫和增强图像的影像组学技术来区分NF-pNETs和SPTs,以期辅助临床提供更为有效通用的定量方法。
1 资料和方法
1.1 一般资料 回顾性分析2008年6月至2021年4 月浙江大学丽水医院、丽水市人民医院、松阳县人民医院符合以下标准的患者。纳入标准:①经病理证实为NF-pNETs或SPTs的患者,NF-pNETs需结合临床特征证实;②治疗前行常规CT平扫+三期增强检查。排除标准:①CT图像伪影累及病灶,影响定量测量要求;②病灶过小(<1 cm),无法勾画病灶VOI。87例患者纳入研究,NF-pNETs 53例,年龄(54.3±12.4)岁;SPTs 34例,年龄(34.9±13.1)岁。本研究通过了浙江大学丽水医院伦理委员会的批准(科研伦审2022第89号)。
1.2 检查方法 多排螺旋CT包括PHLIPS、GE、TOSHIBA公司16排以上CT扫描仪,管电压120 kV、管电流220~250 mAs,螺距0.8,层厚5 mm。所有患者均在治疗前行常规腹部或胰腺平扫+增强扫描。平扫后,经肘静脉以3 mL/s注射非离子型对比剂碘海醇,注射剂量1.5 mL/kg,注射后于25~35 s、45~60 s、135~150 s行动脉期、门脉期及延迟期增强扫描。
1.3 常规CT征象分析 由2名经验丰富的高年资医师在不知道患者病理结果的情况下对所有图像进行判读,遇到分歧时经商议达成一致。评估的内容包括肿瘤部位、大小、质地(囊性、囊实性或实性)、边缘(清晰或模糊)、胰管扩张、淋巴结及肝转移情况。肿瘤质地实性为强化实质达肿瘤90%及以上,囊实性为强化实质在90%以下;CT强化幅度值为各期强化值减去相应平扫CT值;胰管扩张标准为直径大于3 mm[7]。
1.4 影像组学特征提取 由于扫描方案及设备不同,为最大限度地减少对组学特征影响,应用A.K.软件(GE, Artificial Intelligence Kit)中的线性插值算法进行等向同性重采样,体素大小为1 mm×1 mm×1 mm,对CT平扫、动脉期、静脉期图像进行均一化处理[8]。将原始DICOM图片传至ITK-SNAP软件(版本3.6.0,https://www.itksnap.org/),由2名分别有8年和10年工作经验的腹部放射诊断主治医师逐层手动勾画ROI,融合成VOI,勾画时包括全部肿瘤组织,包括囊变、坏死及出血成分,全面评估肿瘤异质性(见图1)。

图1 NF-pNETs和SPTs患者CT动脉期的VOI勾画
A.K.软件提取肿瘤VOI纹理特征。纹理特征包括直方图类、纹理特征类(texture)、形状特征类(form factor)、灰度共生矩阵(gray-level cooccurrence matrix, GLCM)、步长矩阵类(gray-level run-length matrix, RLM)和灰度区域大小矩阵类(gray-level-size-zone matrix, GLSZM),共396个特征参数。
1.5 影像组学模型及列线图构建 采用组内相关系数(intraclass correlation coefficient, ICC)对2 名医师提取的特征进行一致性评估,ICC大于0.75为一致性比较好[9]。采用最大相关-最小冗余(max-relevance and min-redundancy, mRMR)、套索算法(least absolute shrinkage and selection operator, LASSO)和10折交叉验证进行特征筛选保留最优的特征。对最后保留的放射纹理特征构建影像组学标签(Rad-score)。应用多因素Logistic回归对临床特征和Rad-score构建鉴别诊断影像组学列线图。分类指标使用敏感度和特异度进行评估,性能指标还包括受试者工作特征(receiver operating characteristic, ROC)曲线下面积(area under curve, AUC),AUC的值越大分类效果越好,并采用Delong检验比较各模型的AUC值。采用决策曲线分析(decision curve analysis, DCA)计算列线图及各特异因子在不同阈值概率下的净效益情况,以评价影像组学预测模型的临床应用价值。
1.6 统计学处理方法 采用R 3.4.4进行统计分析。采用随机数字表法将87例患者以7:3比例分成训练组62例和验证组25例,Shapiro-Wilk检验是否符合正态分布和Levene方差齐性检验,计量资料符合正态分布的用±s表示,2组间比较采用独立样本t检验;不符合正态分布采用M(P25,P75)表示,2 组间比较用Man-WhitneyU检验;计数资料用例表示,2组间比较采用χ2检验或Fishers精确检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 纳入的87例患者中,NF-pNET患者53例,SPTs患者34例,二者的年龄、性别、病灶最大径差异有统计学意义(P<0.05)。影像学特征中病灶部位、形态、钙化与否的差异有统计学意义(P<0.05)。见表1。

表1 SPTs组和NF-pNETs组的临床及CT征象比较
2.2 CT图像纹理特征的影像组学模型构建 2名医师勾画的VOI提取的CT纹理特征一致性好,平扫ICC范围为0.758~0.802,动脉期ICC范围为0.845~0.877,延迟期ICC范围为0.806~0.841。对提取的396个特征采用mRMR去冗余、LASSO和10折交叉验证筛选后保留最优特征,CT平扫、动脉期、延迟期图像最终保留特征分别为8个、6个、7个,综合模型最终保留10个特征,包括了7个动脉期特征和3个延迟期特征,基于上述特征形成影像组学Radscore(见表2)。

表2 筛选出的影像组学特征及系数
2.3 影像组学模型鉴别诊断效能比较分析 筛选最后保留的CT平扫、动脉期、延迟期纹理特征和三者联合形成的Rad-score构建的影像组学模型,训练组AUC分别为0.85(95%CI=0.75~0.94)、0.92(95%CI=0.85~0.99)、0.85(95%CI=0.76~0.95)和0.94(95%CI=0.88~0.99),验证组AUC分别为0.75(95%CI=0.56~0.95)、0.89(95%CI=0.77~1.00)、0.83(95%CI=0.63~1.00)和0.90(95%CI=0.78~1.00),CT平扫构建的模型AUC值最小,三者联合构建的模型AUC最大。通过Delong检验比较各模型的AUC值,三者联合Radscore构建的模型与CT平扫模型的差异有统计学意义(Z=2.1698,P=0.030),CT动脉期、延迟期模型及三者联合模型两两比较差异无统计学意义(P>0.05),见图2。随后,运用综合模型Rad-score和临床特征构建影像-临床综合影像组学模型,训练组和验证组中的AUC分别为0.97(95%CI=0.94~1.00)和0.92(95%CI=0.81~1.00)。见图3。

图2 CT平扫、动脉期、延迟期及三者联合影像组学模型的ROC曲线
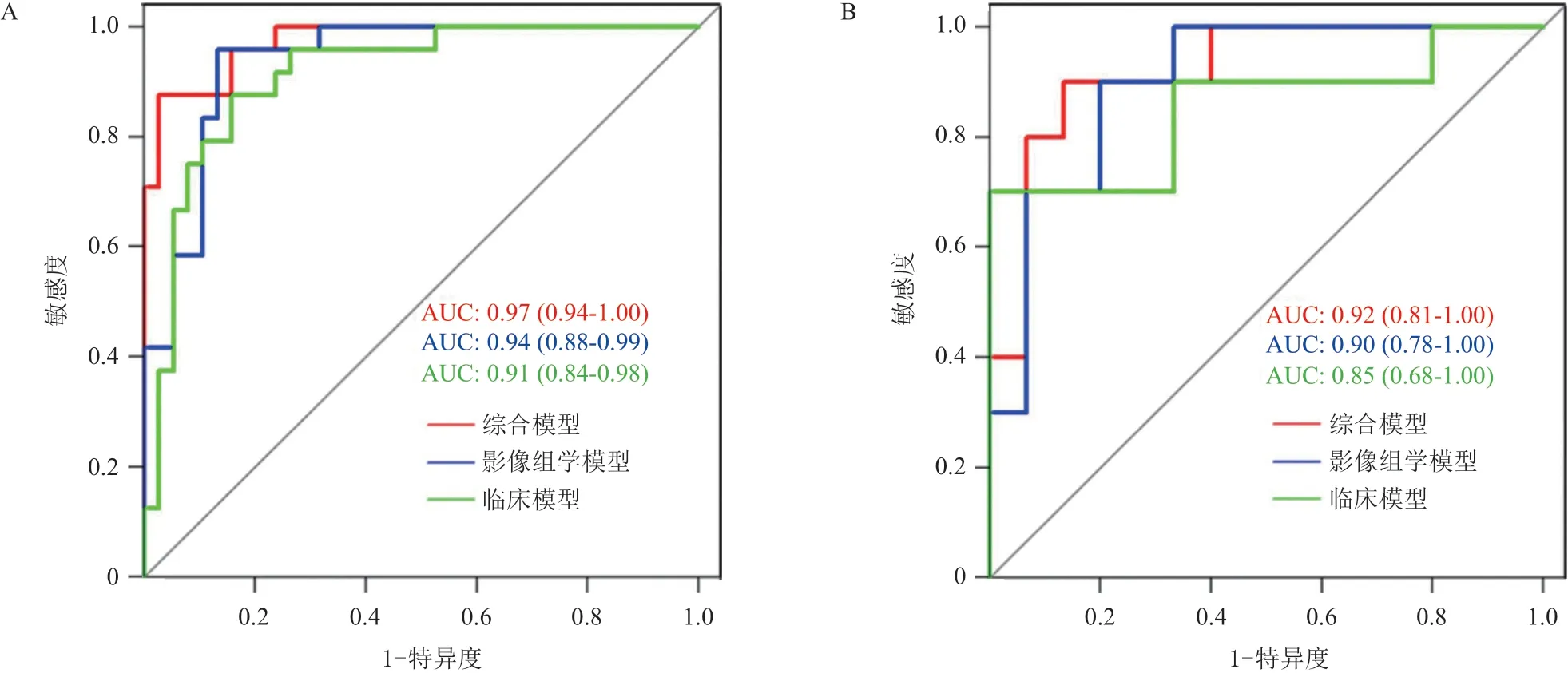
图3 临床模型、影像组学模型和综合模型的ROC曲线
2.4 列线图及临床应用效力 多因素Logistic回归分析显示年龄、性别和肿瘤最大径是患NF-pNETs的影响因素。为了给临床医师提供一个简单便捷的工具,根据基于CT图像的影像组学Radscore、年龄、性别和肿瘤最大径构建综合模型,绘制列线图(见图4)。DCA显示,在阈值概率大于0.45的情况下,胰腺NF-pNETs和SPTs患者可以从该预测模型中获益(见图5)。

图4 综合影像组学列线图

图5 基于各模型影像组学的决策曲线
3 讨论
NF-pNETs是异质性高、侵袭性生长的肿瘤,SPTs为良性或低度侵袭性、预后良好的肿瘤。NFpNETs因侵袭性更强,外科手术方式更为激进,包括胰腺切除术和淋巴结清扫从而实现肿瘤切缘阴性;且当NF-pNETs合并肝转移,患者的5年生存率显著下降,仅为15~25%[10];从影像学定性方面判断,NF-pNETs约有30%表现为低强化,和(或)伴有钙化、囊性变[5],而SPTs亦表现相似,此时二者的区分存在困难。因此,借助基于CT影像组学获取高通量数据的微观差异将有助于区分二者,帮助临床医师制定手术计划和选择联合治疗方案。
本研究结果显示,NF-pNETs患者和SPTs患者临床特征中性别、年龄、钙化和肿瘤大小差异有统计学意义,与之前的报道[11-12]基本一致,NF-pNETs多见于中老年人,SPTs以青年女性更为常见,且SPTs钙化较NF-pNETs更为常见。WANG等[12]研究显示年龄、钙化是诊断SPTs的独立预测因子,联合鉴别诊断SPTs和乏血供pNETs的敏感度为100%,特异度为63.6%,AUC为0.865。虽然临床及影像学定性特征有助于鉴别二者,但是,对于不典型的NF-pNETs和SPTs的区分仍有困难。
LIU等[11]运用基于增强延迟期CT图像的纹理分析联合临床、影像特征对NF-pNETs和SPTs进行了鉴别,诊断效能显示AUC为0.88,敏感度、特异度为88.89%、88.89%。与之不同,本研究对常规CT平扫和增强图像提取病灶纹理特征,联合了临床特征区分NF-pNETs和SPTs,结果显示综合影像组学列线图模型的诊断效能最佳,训练组和验证组AUC为0.97、0.92,优于单纯的基于CT平扫、动脉期或延迟期的影像组学模型(见图2),表明综合影像组学列线图可有效地区分二者。动脉期、延迟期主要反映肿瘤血供、间质成分的强化特点,动脉期与肿瘤血管强化显著相关,而静脉期随着对比剂的流入,肿瘤间质成分逐渐强化,因而在肿瘤功能毛细血管再生和反映肿瘤实质异质性方面有显著优势[13],因而综合多序列提取放射学纹理特征能更好地反映肿瘤内部细微特征及其异质性。另外,放射纹理特征建立的影像组学联合临床特征亦增强了模型的鲁棒性,本研究中联合了CT平扫、动脉期及延迟期的Radscore和临床特征构建影像-临床综合影像组学模型,训练组和验证组中的AUC为0.97、0.92显著高于单纯的影像组学模型(AUC为0.94、0.90)和临床模型(AUC为0.91、0.85)。多项研究[14-16]显示基于临床、放射纹理特征二者联合构建的影像组学模型联合模型优于单纯的临床或影像组学模型,本研究结果与之一致,综合影像组学模型优势更著,这有助于辅助临床术前NF-pNETs和SPTs的个体化诊断。
为避免纯数学指标(AUC等)对模型评估的抽象性,本研究形成了易于使用的可视化的影像组学列线图,训练组和验证组中,综合模型影像组学列线图预测符合率显著高于基于CT平扫、动脉期、延迟期,表明综合模型影像组学列线图具有较高的预测效能。同时,采用DCA来评估模型在所有可能风险阈值下的预测净收益,从而评估各种风险阈值的影响[17]。DCA结果显示,在阈值概率大于0.45的情况下,应用肿瘤与胰腺的CT影像组学列线图差异来区分SPTs与NF-pNETs,比将所有患者当作SPTs或当作NF-NETs进行治疗有更多的益处。
本研究的局限性:①样本量较少,尤其是SPTs患者数量,可能导致建模过拟合,对模型的稳定性造成一定的影响。②采用了不同的厂家或型号的螺旋CT扫描仪的数据图像质量可能不一致,但是主要参数基本一致。③虽然纳入了一些临床特征,但是仍有一部分影像学特征未纳入,未来我们将结合多种临床和影像学特征,建立一个更为完善的诊断模型。
综上所述,本研究基于CT平扫和增强图像联合临床特征构建影像组学列线图术前区分NF-pNETs和SPTs,显示出其对识别需要监测或手术切除的患者具有很大的潜力。

