酮病奶牛血液生化指标和肝脏病理变化分析
叶玮琪,蔡金音,陈 曦,范欣怡,赵 倩,苏亮飞,和凤平,张立梅,江康峰,李小兵
(云南农业大学动物医学院,云南昆明 650000)
随着云南省奶牛业的迅速发展,奶牛疾病发生比例逐渐增多,尤其是奶牛酮病。奶牛酮病虽然病死率低,但导致奶牛生产性能下降,继发其他疾病,使牧场饲养成本增加,影响养殖效益[1]。奶牛新陈代谢中85%的葡萄糖由肝脏合成,肝脏是维持血糖稳定的重要器官。奶牛因产前肥胖造成脂肪蓄积于肝脏,引起肝糖原含量减少,糖异生作用减弱,产犊时大量的体能消耗导致血糖降低。血糖浓度的降低会导致脂肪被大量分解为游离脂肪酸,游离脂肪酸的不完全氧化会生成大量酮体[2]。奶牛分娩后常处于能量负平衡(NEB)状态[3],使得体脂动员产生的脂肪酸增多,肝脏只能利用一部分游离脂肪酸,合成过多的甘油三酯对肝脏产生浸润,肝脏运行负荷过大,最终造成肝功能受损。奶牛酮病是NEB的结果,常呈高游离脂肪酸血症、酮血症、肝脂浸润[4]。肝脂浸润往往使能量代谢障碍更加严重[5],引起血酮升高进而加重NEB的恶性循环。
酮病的发生给奶牛生产带来严重的经济损失,因此进行酮病有效监测十分必要[6]。饲料营养的调整,饲养管理加强及产后护理措施的完善等,可显著降低酮病的发病率,提高养殖效益。有报道称,酮病在我国不同规模养殖场的发病率为16%~45%,并在产后2周内发病率达到最高[7]。然而,关于云南省奶牛酮病的流行情况还未曾报道。因此,本研究通过调查云南省昆明市某集约化养殖场奶牛酮病的发病情况,检测酮病奶牛相关血液指标,分析酮病奶牛肝脏病理变化,为进一步了解云南省集约化奶牛场奶牛酮病发病规律和酮病诊断提供依据。
1 材料与方法
1.1 材料
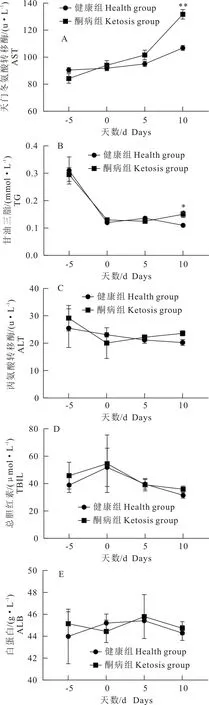
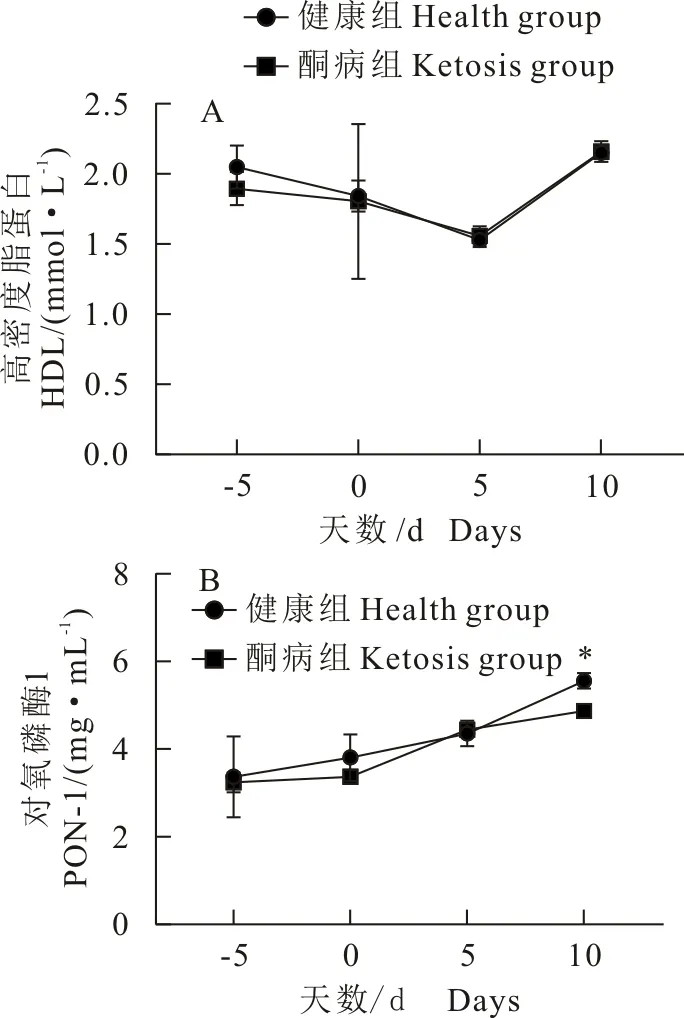
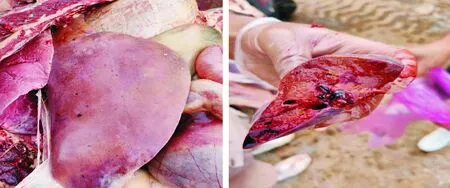
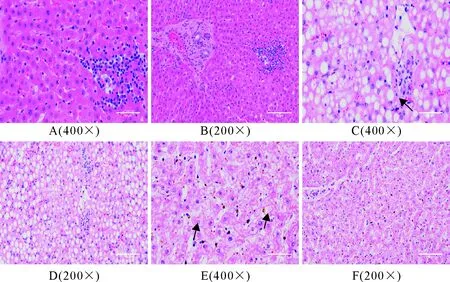
1.1.1 试验用动物 云南省昆明市某集约化奶牛场随机选择40头,胎次为2胎~4胎待产且体况正常的荷斯坦奶牛。体况正常包括无异常临床症状,脉搏、心跳、呼吸、体温等生理指标正常。根据β-羟丁酸(BHBA)浓度进行分组:血酮浓度≥1.2 mmol/L为酮病组、血酮浓度 1.1.2 主要试剂与仪器 牛β-羟基丁酸(BHBA)、牛游离脂肪酸(NEFA)ELISA检测试剂盒,上海酶连生物科技有限公司产品;丙氨酸氨基转移酶(ALT)、甘油三酯(TG)、白蛋白(ALB)、天门冬氨酸氨基转移酶(AST)、总胆红素(TBIL)、高密度脂蛋白(HDL)、葡萄糖(GLU)测定试剂盒,深圳雷杜生命科技有限公司产品;酶标检测仪,赛默飞世尔仪器有限公司产品;Chemray 800全自动生化分析仪,深圳雷杜生命科技有限公司产品。 1.2.1 血液样品采集 根据牛场管理软件的预产时间,跟踪采集产前5 d,生产当天,产后5 d,产后10 d的血液样品。采集尾根静脉血10 mL,肝素钠抗凝,室温下以3 000 r/min离心10 min,吸取上清液于EP管,分成2份,1份用于ELISA检测,另1份用于其他指标检测。置-80℃冰箱内冻存待检。 1.2.2 血液指标检测 ELISA操作步骤按试剂盒说明书进行,用酶标检测仪检测。用Chemray800全自动血液生化分析仪对生化指标进行测定。 1.2.3 酮病牛肝脏病理切片制作 将酮病组死亡和淘汰的牛解剖,在牛的右季肋区,从第5肋骨至第13肋骨之间的位置,用组织剪剪下部分肝组织,放入40 g/L多聚甲醛溶液中固定。 取出40 mL/L多聚甲醛固定好的组织样本用流水冲洗,梯度酒精依次脱水。750 mL/L酒精2 h、850 mL/L酒精2 h、900 mL/L酒精1.5 h、950 mL/L酒精2 h、无水乙醇Ⅰ 2 h、无水乙醇Ⅱ 2 h、醇苯40 min、二甲苯Ⅰ 40 min、二甲苯Ⅱ 40 min、65℃融化石蜡Ⅰ 0.5 h、65℃融化石蜡Ⅱ 1 h、65℃融化石蜡Ⅲ 3 h然后包埋成蜡块。使用切片机切3 μm~5 μm厚石蜡切片,65℃烤片4.5 h;切片入苏木素染液染3 min~5 min,自来水洗,分化液分化,自来水洗,返蓝液返蓝,流水冲洗;切片依次入850 mL/L、950 mL/L的梯度酒精脱水各5 min,入伊红染液中染色5 min;切片依次放入无水乙醇Ⅰ 5 min、无水乙醇Ⅱ 5 min、无水乙醇Ⅲ 5 min、二甲苯Ⅰ 5 min、二甲苯Ⅱ 5 min,透明中性树胶封片;光学倒置显微镜观察,选取目标区域进行拍照,分析。 1.2.4 数据处理 试验数据用SPSS20.0软件进行分析,数据结果均以平均数±标准差表示。两个组各时间点的试验数据采用比较平均值成对样本t检验,各时间点的试验数据检测结果用GraphPad Prism8.4.0软件进行对比作图。 40头奶牛产前5 d和生产当天,血酮值均低于1.2 mmol/L,无酮病发生;产后5 d,酮病奶牛有9头,发病率为22.5%;产后10 d,新增发病奶牛10头,酮病奶牛有19头,发病率为47.5%。发生酮病的19头牛为酮病组,另外21头健康牛为健康组(图1)。其中酮病组1头奶牛在产后第13 d因出现神经症状被淘汰,1头在产后第15 d突然发生猝死。产犊后记录奶牛从分娩后第1天至产后第60天每天的泌乳量,酮病奶牛平均每天产奶27.19 kg±1.33 kg,健康奶牛平均每天产奶32.06 kg±1.55 kg。 *P<0.05,**P<0.01 在分娩当天,酮病组BHBA浓度为0.82 mmol/L±0.04 mmol/L,健康组BHBA浓度为0.67 mmol/L±0.05 mmol/L,组间差异不显著,两组奶牛均未发病;产后5 d,健康组BHBA浓度为(0.84±0.05)mmol/L,酮病组为1.28 mmol/L±0.16 mmol/L,酮病组极显著高于健康组(P<0.01);产后10 d,酮病组BHBA持续上升为1.48 mmol/L±0.18 mmol/L,健康组为0.74 mmol/L±0.05 mmol/L,酮病组极显著高于健康组(P<0.01)。 产前5 d、生产当天和产后5 d的NEFA浓度无明显变化。产后10 d,酮病组NEFA浓度急剧升高,酮病组为1.1 mmol/L±0.40 mmol/L,健康组为0.64 mmol/L±0.45 mmol/L,酮病组极显著高于健康组(P<0.01);产前5 d,健康组和酮病组GLU浓度在4.0 mmol/L以下,生产当天两组GLU浓度均急剧升高,组间差异不显著。产后5 d,健康组浓度降至3.18 mmol/L±0.88 mmol/L,酮病组浓度降至1.97 mmol/L±0.12 mmol/L,组间差异显著;产后10 d,酮病组显著低于健康组(P<0.05)(图2)。 图2酮病组与对照组NEFA(A)、GLU(B)的变化曲线 健康组和酮病组AST、TG、ALT、TBIL和ALB浓度变化见图3,健康组和酮病组AST在产前10 d、产前5 d、生产当天均无显著差异。产后10 d AST浓度上升,酮病组为128.64 μ/L±6.11 μ/L,健康组为105.24 μ/L±3.23 μ/L,组间差异极显著(P<0.01);酮病组和健康组产前5 d至生产当天TG浓度急剧下降,并持续至产后5 d。产后10 d,健康组下降为0.11 mmol/L±0.0047 mmol/L,酮病组上升为0.15 mmol/L±0.0067 mmol/L,酮病组显著高于健康组(P<0.05);健康组和酮病组在监测时间内ALT、TBIL、ALB浓度未出现显著性差异。两组TBIL浓度在生产当天均有一定程度的上升,之后逐渐下降至正常水平。 HDL、PON-1变化见图4,健康组和酮病组在监测期内差异不显著,生产当天HDL浓度下降到最低;产前5 d到产后10 d,PON-1呈一个逐渐上升的趋势,产后10 d,酮病组对氧磷酶1浓度为4.87 mg/mL±0.17 mg/mL,健康组为5.56 mg/mL±0.22 mg/mL,酮病组显著低于健康组(P<0.05)。 酮病奶牛肝脏均匀性增大,边缘钝而厚,表面光滑,质如面团,表面呈黄红色和灰黄白色,有油腻感。刀切时,硬度较健康肝脏稍增加,刀面有脂肪沾染。切面呈黄红或淡黄色,有油腻感(图5)。健康奶牛肝组织结构基本正常,肝细胞结构饱满,未见明显水肿固缩坏死等变性(图6),酮病奶牛图(图6C、图6D)肝组织整体结构异常,肝细胞结构疏松,组织可见大量肝细胞脂肪变性,脂变的肝细胞胞浆内出现大小不等的脂滴。脂肪变性初期脂滴较小,逐渐变大后,紧密分布于胞浆内,病变明显部位可见空泡样(箭头所示);酮病奶牛的肝组织整体结构异常,组织肝细胞结构疏松,可见肝细胞广泛水肿(图6E、图6F)箭头所示; 部分肝细胞核固缩溶解消失。 酮病是奶牛围产期普遍发生的一种代谢性疾病,酮病的发病因素有很多,包括产前过度肥胖、机体能量负平衡(NEB)、营养不均衡等[8]。奶牛在围产期经历妊娠、分娩、泌乳等一系列变化,干物质摄入较少,但泌乳对能量的需求较高,采食量不能满足泌乳需求而出现能量负平衡,机体只能通过动用脂肪和蛋白质来满足需求,结果导致乙酰乙酸和β-羟丁酸的生成过多而引起酮病[9]。该集约化养殖场干奶期的饲养密度较大,奶牛运动量小,导致了奶牛胖瘦不均。研究表明,放牧的奶牛酮病发病率低于集约化养殖的奶牛[10]。奶牛产犊后开始泌乳,由于奶牛食欲恢复较慢,摄入的能量和葡萄糖还不能完全满足泌乳需求,从而导致血糖迅速下降。在本次研究中,酮病组GLU浓度在产后5 d、10 d显著低于健康组,呈现低血糖症,这与杨威等研究结果一致[11],GLU浓度在分娩时突然升高,之后又迅速下降,这与迟景波等研究结果相吻合[12]。 ALT、AST可作为反映肝细胞损伤及严重程度的指标[13]。在本次研究中,AST的含量在产后10 d极显著高于对照组,并且从生产当天到产后呈逐渐上升的趋势;ALT浓度虽然未表现显著性差异,但酮病组ALT浓度在产后10 d高于对照组,表明产后10 d左右酮病组奶牛肝脏受损严重。酮病奶牛TG浓度在产后10 d显著高于健康组,提示酮病奶牛肝脏有脂肪的蓄积。TG增加会引起肝脏状态和功能的改变。酮病奶牛的肝脏常伴有肿胀,边缘钝圆,切面苍白至黄色,并伴有肾脏、心肌和骨骼肌的大量TG浸润[14]。对酮病奶牛进行肝穿刺病理检查能够评价酮病导致的肝脏炎症和脂肪蓄积程度,评估病情,预测疾病进展。在平行于大转子通过第10肋间空间的位置,能够容易安全地实施经胸腔的针吸肝脏活组织检查[15]。然而,活组织样品检测的主要缺点是目前没有关于奶牛肝组织活检风险评估的相关报道。从肝脏病理切片的观察发现,酮病 图3酮病组与健康组AST(A)、TG(B)、ALT(C)、TBIL(D)、ALB(E)的变化曲线 图4酮病组与健康组HDL(A)、 PON-1(B)的变化曲线 图5酮病奶牛的肝脏 奶牛肝细胞肿大,充满大量大小不一的脂滴。肝细胞个体体积增大,细胞核固缩。引起细胞的结构和功能减弱,造成萎缩,坏死。通过对该场酮病奶牛病理切片分析,说明酮病奶牛肝脏存在严重的脂肪蓄积,出现器官实质性病变。 研究结果发现,酮病组奶牛血液中PON-1浓度与健康组相比显著下降(P<0.05),原因可能是围产期奶牛的生理状况,代谢水平发生了剧烈的变化,导致机体处于能量负平衡状态,同时体脂会大量动员产生脂肪酸,在肝脏内质网和线粒体氧化中释放大量的活性氧(ROS)。过多的ROS会造成抗氧化物的平衡失调,造成脂质间过度氧化,会产生大量有细胞毒性物质,引起肝细胞坏死,在肝脏受到损伤时,在血液中PON-1合成减少,活性下降,这可能是机体的氧化应激与PON-1活性成反比导致的结果。赵畅等在牛PON-1单克隆抗体夹心ELISA方法建立与初步应用的研究中,明确了血中 PON-1 可作为奶牛酮病发生的风险预警指标及其预警值为62.37 nmol/L[16]。酮病组奶牛血浆中的PON-1活性显著低于健康组[17]。本次试验关于PON-1的结果与先前的研究相一致,因此临床检测PON-1可能对奶牛酮病有一定的诊断价值。 图6健康奶牛和酮病牛肝脏组织切片1.2 方法
2 结果
2.1 酮病发病情况
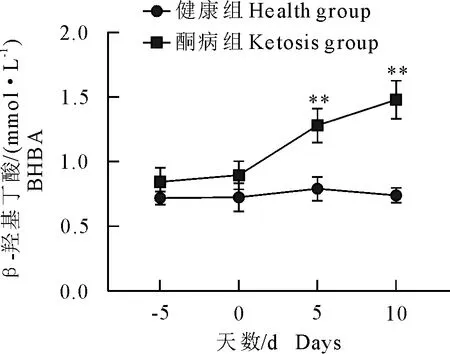
2.2 BHBA浓度变化
2.3 能量指标变化
2.4 肝功能指标变化
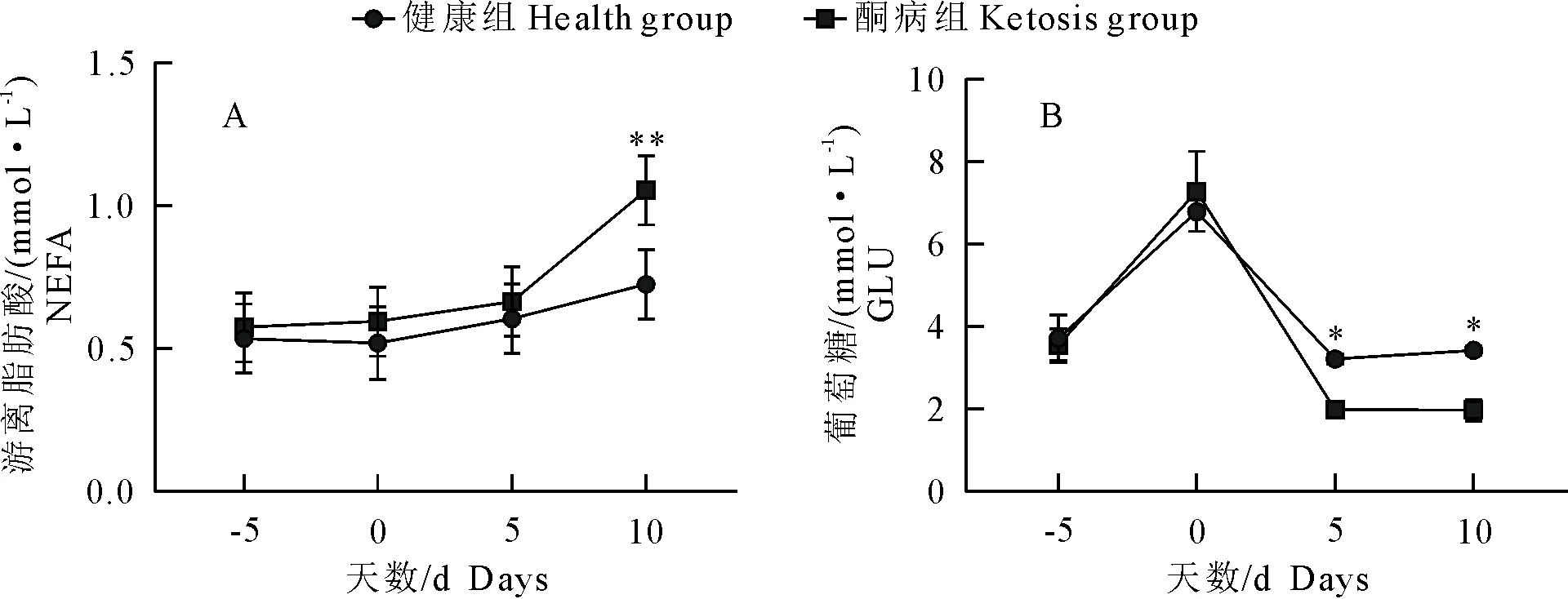
2.5 高密度脂蛋白、对氧磷酶1变化
2.6 酮病奶牛肝脏病理学变化
3 讨论