盖他病毒Cap和E2蛋白多克隆抗体的制备
莫清荣,任同伟,农作荣,王 豪,黄 静,陈 樱,欧阳康,黄伟坚,韦祖樟
(广西大学动物科学技术学院,广西南宁 530005)
盖他病毒(Getah virus,GETV)是披膜病毒科、甲病毒属成员之一,为单股正链线形RNA病毒,呈典型的甲病毒结构[1]。其主要是经过吸血节肢动物(如蚊虫等)对脊椎动物造成损害,主要感染的对象是猪和马。感染母猪后导致母猪的繁殖系统出现障碍,感染马后导致马匹出现淋巴结肿大、发热、后肢肿胀以及皮疹等症状,同时对两栖动物、鼠类以及爬行类和鸟类也具有感染性[2-3]。一年四季都有该病发生的报道,主要以7月~9月为高发期[4]。近年来,GETV迅速传播,并多次在动物群体中引起疫情[5-9]。GETV颗粒为圆球形,直径约为50 nm~70 nm,基因组长度约为11 kb~12 kb[10],含有2个开放阅读框(ORF),首、末端分别为5′和3′非编码区(UTR),ORF1编码4种非结构蛋白(NSP1、NSP2、NSP3、NSP4),ORF2编码5种结构蛋白(Cap、6K、E3、E2、E1)[11]。在结构蛋白中,衣壳蛋白Cap在病毒粒子的形成过程发挥着非常重要的作用[12]。E2蛋白是甲病毒重要囊膜蛋白的组成之一[13],同时也是病毒的抗原识别位点和中和位点。
为制备Cap和E2蛋白的多克隆抗体,本研究将盖他病毒Cap和E2蛋白基因连接至原核表达载体pET-32a(+)中,然后将重组表达质粒转化宿主菌诱导重组蛋白表达,将纯化好的重组蛋白皮下注入新西兰大白兔,从而制备多克隆抗体,通过Western blot和间接免疫荧光(IFA)验证多克隆抗体与病毒蛋白的反应。本研究制备的多克隆抗体为GETV的血清学检测方法提供了材料,也为GETV Cap和E2蛋白功能的研究奠定了基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 从广西大学实验动物基地购入2只雌性新西兰大白兔。
1.1.2 病毒、菌株、细胞与载体 GETV病毒GX201808由广西大学动物科学技术学院动物传染病与分子免疫学实验室分离保存[10];E.coliDH5α、BL21(DE3)感受态细胞自CWBIO公司购入;猪肾细胞(PK-15)、乳仓鼠肾细胞(BHK-21)、原核表达载体pET-32a(+)均由广西大学动物科学技术学院动物传染病与分子免疫学实验室保存。
1.1.3 主要试剂 Ni琼脂糖凝胶、SDS-PAGE凝胶制备试剂盒、蛋白Marker、RIPA细胞裂解液,康为世纪有限公司产品;HRP-山羊抗兔IgG,Abcam公司产品;BCA蛋白定量,TaKaRa公司产品;T4 DNA连接酶、BamHⅠ和EcoRⅠ限制性内切酶,NEB公司产品;IPTG,北京索莱宝科技有限公司产品;二抗Goat Anti-Rabbit IgG(H+L)、FITC Conjugate,全式金公司产品;PMSF(100 mmol/L),碧云天公司产品。
1.1.4 主要仪器 不同规格移液枪、低温离心机,Eppendorf公司产品;琼脂糖凝胶电泳仪,北京六一生物科技有限公司产品;凝胶成像仪和垂直电泳仪,Bio-RAD公司产品;恒温水浴锅,邦西仪器科技有限公司产品;普通倒置显微镜和荧光倒置显微镜,Nikon公司产品;恒温摇床细菌培养箱、细胞恒温培养箱和PCR仪,Thermo公司产品;超声波破碎仪,宁波新芝生物科技股份有限公司产品。
1.2 方法
1.2.1 引物的合成 根据实验室保存的GETV毒株 GX201808全基因组(GenBank登录号:MT269657)设计Cap蛋白和E2蛋白的两对特异性引物。Cap上游引物GETV -Cap-F:5′-CGGGATCCATGAATTACATCCCAACTCA-3′(下划线为BamHⅠ的酶切位点),下游引物GETV-Cap-R:5′-CCGGAATTCCCATTCTTCTGTTCCTT-3′(下划线为EcoRⅠ的酶切位点);E2上游引物GETV-E2-F:5′-CGGGATCCAG TGTGACGGAACACTT-3′(下划线为内酶切BamHⅠ位点),下游引物GETV-E2-R:5′-CCGGAATTCGGCATGCGCTCGTGGCGCGCA-3′(下划线为内酶切EcoRⅠ位点)。在上海杰李生物有限公司进行引物的合成过程,使用浓度均为10 pmol/μL。
1.2.2 RNA的提取和目的基因的扩增 用传统法抽提提取GETV的RNA,反转录得到cDNA,并以该产物为模板,扩增出Cap、E2基因。使用的反转录体系如下:5×MLV buffer 2.5 μL,M-MLV逆转录酶 0.25 μL,dNTP mix 1 μL,Reverse primer 0.5 μL,酶抑制剂 RRI 0.25 μL,RNA模板8 μL。在42℃条件下反转录1 h。PCR扩增的模板为经反转录得到的cDNA,反应体系如下:cDNA模板 4 μL,dNTP 8 μL,Forward primer 1 μL,Reverse primer 1 μL,LATaq酶 0.5 μL,LA buffer 5 μL,ddH2O补至50 μL。PCR反应条件为:94℃ 5 min;94℃ 1 min,58℃ 1 min,72℃ 1 min(35 cycles);72℃ 7 min。PCR所得产物经15 g/L琼脂糖凝胶进行电泳正确后,使用DNA胶回收试剂盒对目的片段进行回收。
1.2.3 构建重组表达质粒 pET-32a(+)载体和目的片段回收液同时使用限制性内切酶BamHⅠ和EcoRⅠ双酶切,用反应液回收试剂盒对已经酶切的产物进行回收,在T4 DNA Ligase的作用下,16℃环境中连接8 h以上,将连接产物转化到DH5α感受态细胞内,转化产物涂布于含有Amp+的LA平板,筛选出阳性菌落。对阳性菌液进行质粒抽提,质粒经过BamHⅠ和EcoRⅠ酶切正确后送至广州华大公司进行基因测序。
1.2.4 重组质粒的诱导表达及可溶性分析 将重组质粒pET-32a-Cap、pET-32a-E2分别转化至感受态细胞BL21(DE3),涂板,挑取平板上的单个菌落至4 mL LB培养基中,37℃培养12 h~16 h。翌日,经菌液PCR判定正确后以原始菌液:LB培养基为1∶100的比例将菌液体积扩大培养至200 mL中,置于37℃摇床中,200 r/min的转速培养4 h~5 h,当菌液的OD600nm值约达到0.6时向其中加入IPTG,使其在菌液中终浓度为0.5 mmol/L。在16℃、200 r/min转速的摇床中进行过夜诱导。4℃条件下,诱导后的菌液经8 000 r/min的转速离心10 min,使用8 mL PBS磷酸盐缓冲液进行重悬后超声,使全部菌体破碎完全,再经4℃、8 000 r/min离心10 min后分离沉淀与上清。经SDS-PAGE蛋白电泳、染色后分析诱导的重组蛋白可溶性情况,以同样条件下诱导的pET-32a(+)空载蛋白做阴性对照。
1.2.5 pET-32a-Cap、pET-32a-E2蛋白的纯化 将重组质粒菌液以原始菌液与LB培养基比例为1∶100扩大培养至500 mL含氨苄青霉素的LB培养基,37℃培养4 h~5 h,加入IPTG后使得终浓度达到0.5 mmol/L,在16℃条件下进行菌液诱导12 h~16 h。诱导后的菌液经8 000 r/min的转速离心15 min后用PBS重悬菌体沉淀,进行超声波完全破碎,8 000 r/min离心15 min后分别收集上清、沉淀。采用镍柱纯化蛋白说明书的操作,分别收集流穿峰和洗脱峰,进行SDS-PAGE电泳分析纯化后的效果。按照BCA蛋白定量试剂盒说明书测定纯化后的蛋白浓度。
1.2.6 多克隆抗体的制备 计算每只新西兰大白兔以1 mg纯化重组蛋白的剂量与完全弗氏佐剂等体积剂量完全乳化混匀,采取多点皮下注射的方式对试验动物初次免疫,初次免疫后每隔10 d进行增强免疫,后续免疫采取纯化蛋白与不完全弗氏佐剂等体积剂量完全的乳化,直至第4次免疫后5 d采血,采集血清备用。同时采集阴性对照组的血清。
1.2.7 IFA鉴定多克隆抗体 将0.01 MOI的GETV病毒液接种至BHK-21细胞中,并设立阴性细胞对照孔,待阳性病变出现至30%左右时加入冰甲醇于4℃固定30 min,10 g/L BSA室温封闭30 min后,以1∶100稀释的Cap、E2多克隆抗体为一抗,37℃培养箱中孵育2 h,用PBS清洗5次,每次振荡清洗的时间为5 min,以1∶300稀释的Goat anti-rabbit IgG(H+L)为二抗,37℃培养箱中孵育1 h,用PBS清洗5次,每次振荡清洗时间为5 min。最后,将其置于荧光倒置显微镜下,观察IFA的情况。
1.2.8 多克隆抗体效价的测定 对经过4次免疫后的新西兰大白兔心脏采血,疫后血清与阴性血清均经ELISA测定其效价。首先,将GETV Cap/E2蛋白使用包被液包被于ELISA板,包被浓度为5 μg/(mL·孔),每孔加入体积为100 μL,置于4℃包被过夜,PBST清洗5次。向各孔中加入300 μL封闭液后在37℃培养箱2 h,弃液,用PBST清洗5次。以免疫后血清和阴性血清作为一抗均从1∶500倍比稀释至1∶64 000,每孔加入体积均为100 μL,孵育时间1 h,孵育条件为37℃培养箱。孵育结束后弃液,PBST洗5次。以HRP-山羊抗兔IgG为二抗按照1∶10 000稀释,反应45 min后,用PBST清洗5次。每孔加入100 μL的TMB显色液,置于37℃培养箱避光孵育10 min后终止反应,终止液加入体积为50 μL/孔。在450 nm波长下测定各孔中吸光值。当四免后的兔血清OD450 nm值/阴性对照血清的OD450 nm值≥2.1即判定为阳性,其出现阳性最大的稀释度作为该多克隆抗体的有效效价。
1.2.9 Western blot鉴定多克隆抗体 将GETV接种于PK-15细胞,待出现明显病变后弃去细胞培养液,PBS洗涤3次。按照PMSF与RIPA比例为1∶100的比例配制细胞裂解液,置于冰上裂解PK-15细胞15 min,4℃条件下13 000 r/min离心10 min。将处理好的样品经SDS-PAGE电泳后,使用半干转膜仪将蛋白转至PVDF膜上,PBST清洗PVDF膜5次。在37℃条件下,使用50 g/L的脱脂奶粉进行封闭2 h,PBST充分振荡洗涤5次。按照1∶1 000的比例使用10 g/L BSA 稀释一抗兔血清,37℃培养箱进行2 h的孵育,PBST清洗5次。按照1∶10 000的比例用10 g/L脱脂奶粉稀释HRP-山羊抗兔IgG二抗,37℃培养箱内进行1 h的孵育,PBST清洗5次。加入DAB工作液与PVDF膜充分接触,在暗室条件下显色3 min~5 min,立即通过Western blot蛋白印迹成像仪观察并分析蛋白条带,最后拍照保存。
2 结果
2.1 重组质粒的构建与鉴定
以GETV病毒RNA为模板对Cap及E2基因进行扩增,经15 g/L琼脂糖凝胶电泳鉴定后,扩增出的Cap基因大小为804 bp,E2基因大小为1 266 bp(图1A)。将经BamHⅠ和EcoRⅠ双酶切的pET-32a(+)载体与双酶切的目的片段进行T4连接后,对重组质粒进行酶切鉴定,可见两条带(图1B)。经测序后鉴定质粒构建成功,分别命名为pET-32a-Cap、pET-32a-E2。
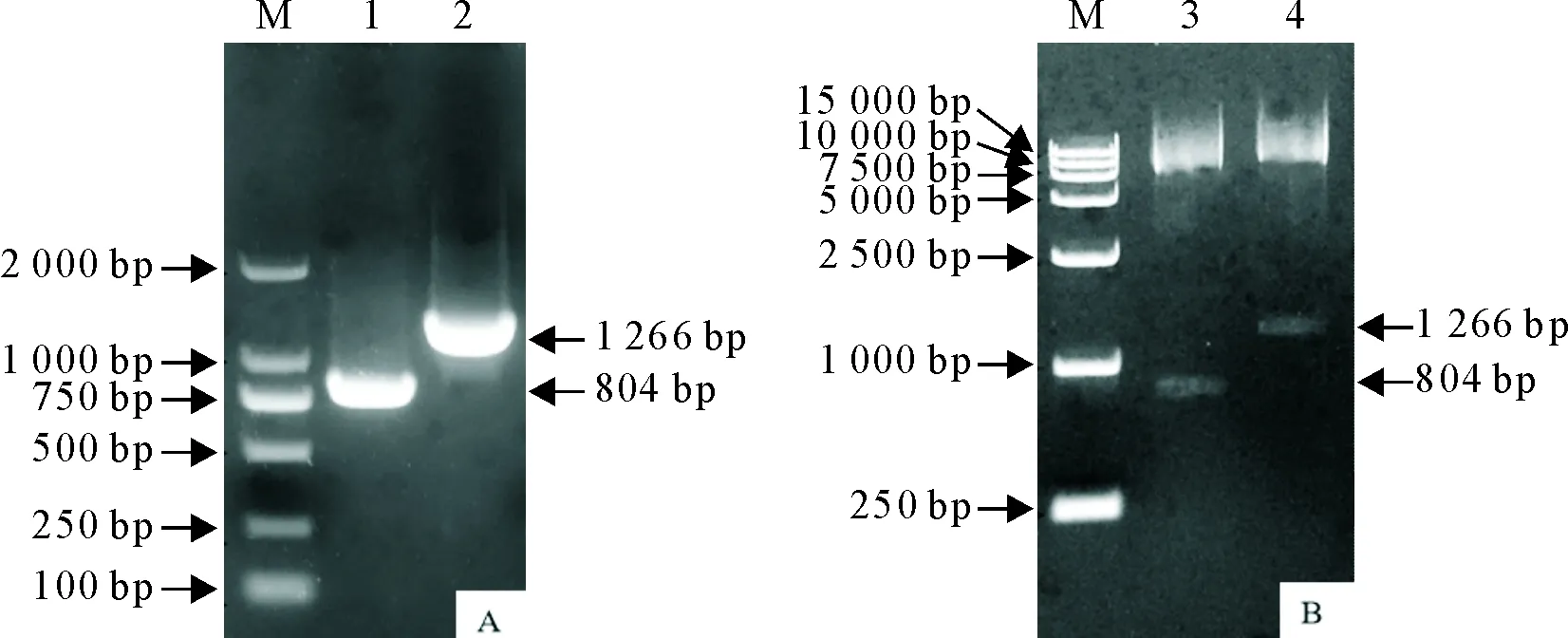
M.DNA标准DL 2 000;A.1.Cap基因;2.E2基因;B.3.重组质粒pET-32a-Cap双酶切;4.重组质粒pET-32a-E2双酶切
2.2 重组质粒的表达
IPTG诱导下重组质粒在BL21(DE3)中成功表达,诱导的pET-32a-Cap在48 ku处出现条带,pET-32a-E2在64 ku处出现条带,与预期大小相符,pET-32a在18 ku处表达了His标签大小(图2)。
2.3 重组蛋白可溶性分析及纯化
对2个重组蛋白进行可溶性分析,对破碎菌体后离心收集的上清样品以及沉淀经SDS-PAGE电泳分析,pET-32a-Cap和pET-32a-E2均在上清表达,蛋白大小与预期相符,纯化后得到较为单一的条带。重组菌表达的上清目的蛋白经镍柱纯化后得到的洗脱液按BCA蛋白定量试剂盒说明书测定蛋白浓度,pET-32a-Cap、pET-32a-E2蛋白质量浓度分别为1.03 mg/mL和0.8 mg/mL(图3)。
2.4 IFA鉴定多克隆抗体的特异性
以GETV病毒液1∶100接毒至BHK-21细胞,四免后兔血清为一抗,Goat Anti-Rabbit IgG(H+L)为二抗,在荧光显微镜下观察到感染的细胞内出现绿色荧光,证明2种多克隆抗体均能够识别GETV病毒产生的蛋白,且未感染病毒的细胞未见荧光(图4)。
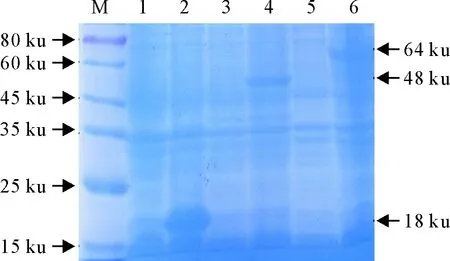
M.蛋白分子质量标准;1.未诱导的pET-32a空载;2.诱导的pET-32a空载;3.未诱导的pET-32a-Cap;4.诱导的pET-32a-Cap;5.未诱导的pET-32a-E2;6.诱导的pET-32a-E2
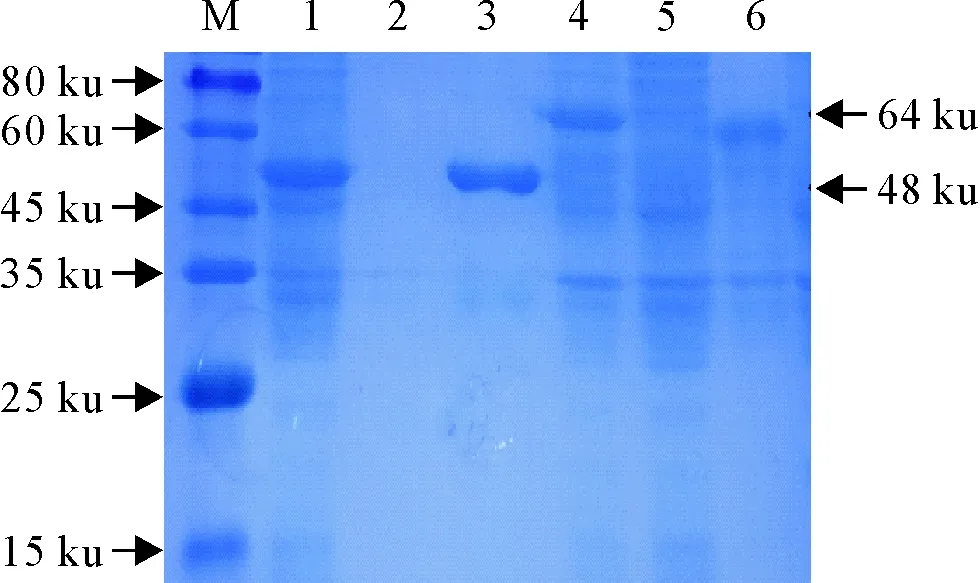
M.蛋白分子质量标准;1/2.诱导的pET-32a-Cap上清/沉淀;3.纯化后的pET-32a-Cap蛋白;4/5.诱导的pET-32a-E2上清/沉淀;6.纯化后的pET-32a-E2蛋白
Fig.3 SDS-PAGE analysis of the purified recombination proteins
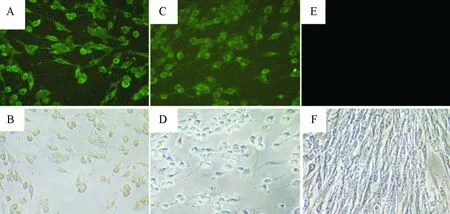
A.Cap多克隆抗体对GETV感染细胞中Cap蛋白表达的IFA分析;B.GETV感染的BHK-21细胞中的白光;C.E2多克隆抗体对GETV感染细胞E2蛋白表达的IFA分析;D.GETV感染的BHK-21细胞中的白光;E/F.模拟感染BHK-21细胞中的荧光或白光对照
2.5 多克隆抗体的效价测定
新西兰大白兔经4次免疫后采集心脏血清,ELISA检测免疫后的血清和阴性对照血清的效价,按照免疫后血清OD450 nm值/阴性对照血清OD450 nm值≥2.1判为阳性,出现阳性达到的最大稀释梯度即该抗体的有效效价。结果显示,所检测的免疫后血清的效价均达到了1∶64 000,说明注射至新西兰大白兔体内的免疫抗原Cap、E2蛋白均取得了良好的免疫效果。
2.6 多克隆抗体进行Western blot分析
将纯化后的多克隆抗体Cap和E2经过纯化,Western blot分析其特异性,表明制备并纯化的多克隆抗体Cap和E2均能与GETV感染的PK-15细胞的细胞裂解物结合,并在Western blot蛋白印迹成像仪下观察发现对应的条带,出现在PDVF膜上的条带大小与预期的蛋白条带大小相一致,而未感染GETV的PK-15细胞没有出现条带,阴性对照成立(图5)。
3 讨论
甲病毒衣壳蛋白(Cap蛋白)对病毒粒子的形成十分重要,与病毒的形态结构和感染性密切相关,而且衣壳蛋白的构象也决定了病毒包膜的装配以及与包膜蛋白的相互作用[15]。E2蛋白是甲病毒重要囊膜蛋白的组成之一[13],是主要的免疫保护性蛋白。近年来,对盖他病毒流行病学、诊断制剂和致病机制的研究还不多,本试验制备的盖他病毒结构蛋白多克隆抗体对盖他病毒的研究具有实际意义。
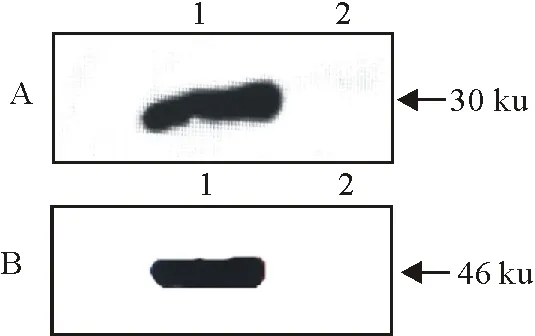
A:1.Cap多克隆抗体对GETV感染的细胞裂解物的Western blot验证;2.未感染GETV的细胞裂解物;B:1.E2多克隆抗体对GETV感染的细胞裂解物的Western blot验证;2.未感染GETV的细胞裂解物
本研究用原核表达载体pET-32a(+),其自身携带的His标签能与镍柱结合,有利于后续蛋白的纯化。诱导剂IPTG的终浓度、诱导时间以及温度都会影响重组蛋白的表达[14]。诱导温度对重组蛋白的表达影响较大,37℃~39℃为大肠埃希氏菌的最适生长温度,但在此温度下更容易使重组蛋白表达为包涵体。16℃低温的条件使重组蛋白的表达变慢,但会增大重组蛋白表达为可溶性蛋白的可能性,本试验选用终浓度为0.5 mmol/L的IPTG,16℃诱导过夜,重组pET-32a-Cap、pET-32a-E2蛋白在上清中表达量较多。免疫动物前采用的完全弗氏佐剂与抗原蛋白1∶1混合充分形成乳液状,目的是佐剂能够使抗原在体内留存时间更长,增加了抗原与宿主体内免疫细胞相遇的几率,能够诱发宿主免疫反应及局部炎症反应,刺激免疫细胞增值。第1次免疫采用完全弗氏佐剂,其后采用不完全弗氏佐剂。
本研究成功构建了原核表达质粒pET-32a-Cap和pET-32a-E2,并对重组蛋白进行了诱导表达和纯化,获得了较高浓度和纯度的重组蛋白。以在大肠埃希氏菌中高效表达的盖他病毒蛋白为免疫抗原,通过多点皮下注射新西兰大白兔制备了抗盖他病毒多克隆抗体。IFA和Western blot结果显示,所制备的抗盖他病毒多克隆抗体能够与盖他病毒特异性结合。制备的重组蛋白及多克隆抗体对盖他病毒检测制剂和病毒蛋白的功能研究奠定了基础。
——一道江苏高考题的奥秘解读和拓展

