钼处理对绵羊子宫病理形态学及内膜上皮细胞超微结构的影响
于亚明,赵 静*,李开放,崔书刚,张晨雨,王宏伟
(1.河南科技大学 环境与畜产品安全实验室,河南洛阳 471023;2.漯河市动物疫病预防控制中心,河南漯河 462000)
子宫内膜包括上皮层和固有层,是构成子宫内壁的一层重要结构,在接受胚胎着床及孕育胎儿的过程中起至关重要的作用[1]。子宫内膜内含有大量的间质细胞与上皮细胞,其中间质细胞可增殖分化为蜕膜细胞诱导蜕膜化反应的发生,使子宫内膜出现较高的容受性,进而可接纳胚胎的着床,有利于妊娠的建立及维持;而上皮细胞具有分泌功能,可供给着床时早期胚胎所需的营养[2-4]。子宫内膜结构的损伤可破坏胚胎着床和发育的微环境,是导致不孕症发生的重要原因[5]。
反刍动物对钼极其敏感,摄入过量的钼可拮抗反刍动物对铜的吸收,诱导以腹泻、被毛褪色、生长不良为临床症状的钼中毒现象[6-7]。近年来,随着钼矿的开采及钼在工业中的应用,钼污染对动物,尤其是对钼污染地区反刍动物的生长、发育和繁殖的危害,已严重干扰了畜牧养殖业的发展[8-9]。本课题组前期研究发现,钼可降低胚胎着床率和产子率[10-11],但具体的病理学基础尚不清楚。为此,本研究以小尾寒羊为试验用动物,通过建立钼处理绵羊模型,研究钼对子宫病理形态学及其内膜上皮细胞超微结构的影响,旨在为阐明钼的雌性生殖毒性提供理论依据。
1 材料与方法
1.1 材料
1.1.1 组织样品 试验共选取24只5月龄健康且体况相当(体重20.4 kg±1.7 kg)的雌性小尾寒羊。所有受试绵羊均饲喂在河南科技大学试验牧场,将绵羊随机分为4组,每组6只。钼处理组绵羊每天分别灌喂含有不同剂量钼酸钠(10、20、50 mg/kg,以绵羊体重计)的定量去离子水,并分别命名为钼处理Ⅰ组、Ⅱ组和Ⅲ组,而对照组绵羊每天被灌喂等量不含钼酸钠的去离子水。在钼处理第28天,处死绵羊,迅速采集新鲜的子宫组织。
1.1.2 主要试剂 电镜固定液(G1102),DAPI(G1012)、Tunel试剂盒(G1501)、抗荧光淬灭封片剂(G1401)、HE染液套装(G1003),武汉赛维尔生物科技有限公司产品;中性树胶(10004160),国药集团化学试剂有限公司产品。
1.1.3 主要仪器 组织切片机(RM2016),上海徕卡仪器有限公司产品;染色机(Giotto),意大利DIAPATH公司产品;光学显微镜(Nikon Eclipse E100)、荧光显微镜(Nikon Eclipse C1),日本尼康公司产品;透射电子显微镜(JEM-F200),日本电子株式会社产品。
1.2 方法
1.2.1 HE染色 子宫组织块在40 g/L多聚甲醛中固定24 h后,依次将组织块浸入浓度梯度递增的乙醇中进行脱水处理。随后,组织块被转入到二甲苯中透明,采用石蜡包埋组织块。用切片机进行5 μm连续切片。子宫组织切片在苏木精和伊红染色染液中进行染色,光学显微镜下观察子宫组织形态结构。
1.2.2 透射电镜 在装有25 mL/L戊二醛的培养皿中将子宫组织块修成约1 mm×1 mm×1 mm的小块,转移至装有新鲜的25 mL/L戊二醛EP管中固定4 h。随后,将组织块被转入到10 mL/L锇酸中进行后固定。固定后,组织块分别在浓度梯度递增的乙醇中脱水,用环氧树脂包埋组织块进行50 nm连续超薄切片。切片被置入到20 mL/L醋酸铀和26 mL/L枸橼酸铅溶液中染色,透射电镜观察超微结构的变化。
1.2.3 Tunel染色 子宫组织块经40 g/L多聚甲醛固定并用石蜡包埋后,进行连续切片。随后,子宫组织切片经脱蜡至水,并滴加蛋白酶K工作液孵育。将Tunel试剂盒内的TDT酶,dUTP,buffer按1∶5∶50比例混合,滴加到切片并在湿盒内孵育。DAPI染液复染细胞核,抗荧光淬灭封片剂封片处理,荧光显微镜观察染色结果。
1.2.4 数据分析 数据均以平均值(Mean)±标准偏差(SD)表示,用SPSS软件(SPSS 17.0,IBM公司)进行统计分析,数据采用单因素方差分析进行显著性分析,P<0.05为差异显著。
2 结果
2.1 钼对绵羊子宫组织病理形态学的影响
对照组子宫内膜上皮细胞规则排列,细胞间隙清晰,同时可见基质细胞形态正常,细胞核内染色质均匀分布(图1A1~A3)。在钼处理后可见子宫组织的形态结构受损。钼处理Ⅰ组子宫内膜上皮细胞排列紊乱,部分上皮细胞出现细胞质丢失,细胞核皱缩、浓染,间质细胞表现为染色质丢失(图1B1~B3)。在钼处理Ⅱ组(图1C1~C3)和钼处理Ⅲ组(图1D1~D3)可见子宫内膜上皮细胞形态严重损伤,细胞间隙不清,细胞质减少,空泡化严重,尤其在钼处理Ⅲ组子宫形态损伤最为严重。
2.2 钼对绵羊子宫内膜上皮细胞超微结构的影响
为进一步评估钼对子宫内膜上皮细胞超微结构的影响,用透射电镜观察钼处理后内膜上皮亚细胞结构的变化(图2)。对照组可清晰地观察到线粒体嵴和双层核膜(图2A1~A4)。钼处理后可见线粒体明显损伤,表现为线粒体嵴的溶解或消失,线粒体肿胀,空泡化,也可观察到细胞核受损,表现为核膜模糊,双层核膜消失,常染色质变多,异染色质变少,且子宫内膜上皮细胞超微结构的损伤随着灌喂钼剂量的增加而加重(图2B1~B4、C1~C4、D1~D4)。
2.3 钼对绵羊子宫内膜细胞凋亡的影响
对照组未见明显的细胞凋亡(图3A1~A2),而钼处理组凋亡的细胞明显地增多(图3B1~B2,C1~C2,D1~D2)。与对照组相比,钼处理组细胞凋亡率显著升高(P<0.05或P<0.01)(图3E),且细胞凋亡率呈剂量依赖性,随着灌喂钼的增多,子宫内膜细胞的凋亡率也逐渐升高。
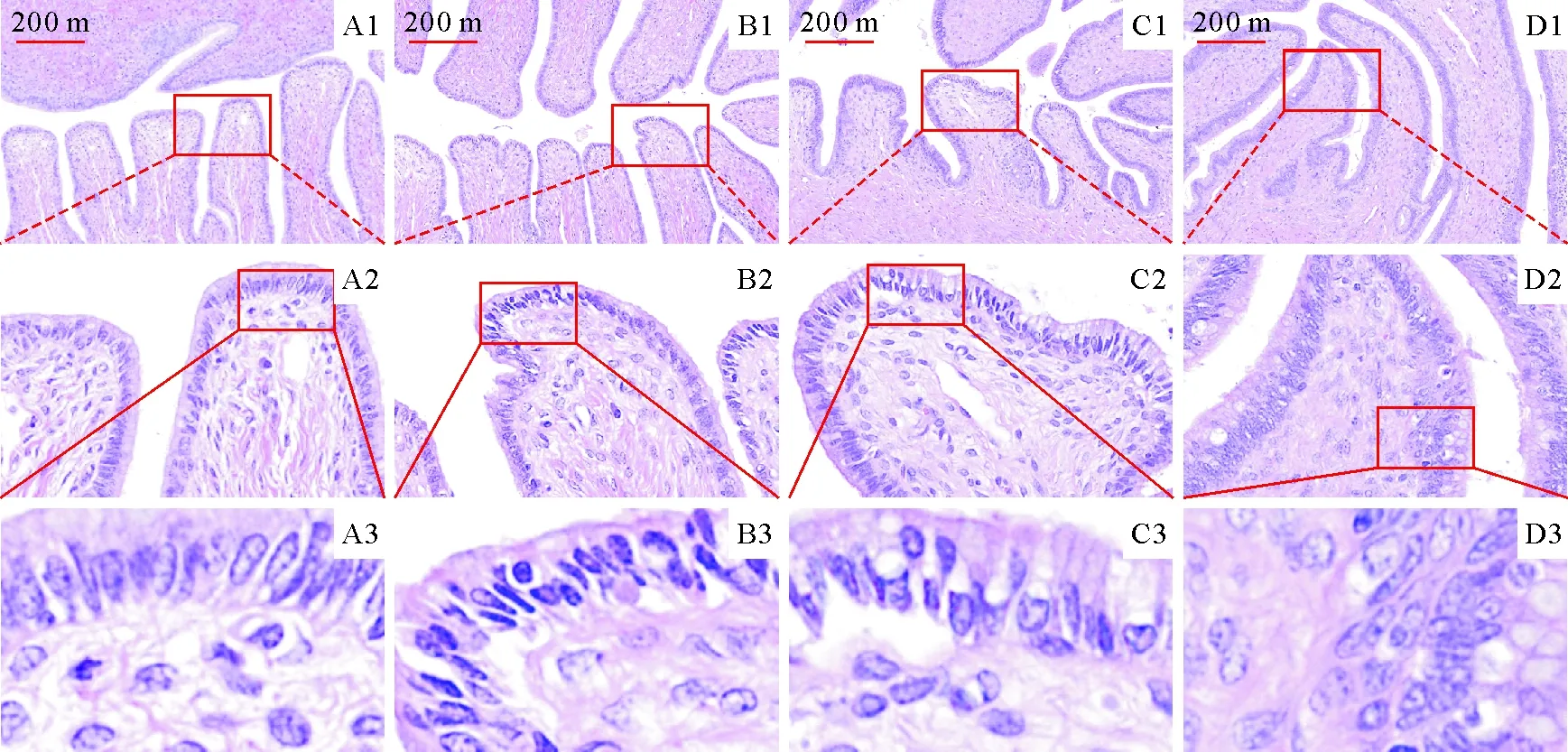
不同剂量钼对子宫组织病理形态学的影响。A1~A3为对照组,B1~B3为钼处理Ⅰ组,C1~C3为钼处理Ⅱ组,D1~D3为钼处理Ⅲ组

A1~A4为对照组,B1~B4为钼处理Ⅰ组,C1~C4为钼处理Ⅱ组,D1~D4为钼处理Ⅲ组。Mi为线粒体,N为细胞核,NM为核膜
3 讨论
钼作为机体必需微量元素,是多种酶的辅助因子,在促进动物生长、发育和繁殖中发挥着至关重要作用[12]。然而,过量的钼摄入可加速脂质过氧化进程,诱导氧自由基的生成增加,过多的自由基蓄积可攻击细胞膜,最终造成多种组织器官的结构及功能受损[13-14]。本研究发现在灌喂10 mg/kg钼酸钠后即可观察到子宫内膜上皮细胞及间质细胞的损伤,且随着钼剂量的增加,子宫内膜损伤逐渐加重,这可能是过量的钼引起铜缺乏,进而诱导铜依赖性抗氧化酶活性降低,加快体内脂质过氧化进程的结果[15]。子宫内膜结构的完整性对于维持胚胎着床及发育的微环境至关重要,钼诱导的子宫内膜损伤可能对胚胎着床存在潜在威胁。

A1~A2为对照组,B1~B2为钼处理Ⅰ组,C1~C2为钼处理Ⅱ组,D1~D2为钼处理Ⅲ组,E为子宫内膜细胞凋亡率。*P< 0.05,**P< 0.01
子宫内膜发挥正常功能离不开线粒体的供能。线粒体内膜向内皱褶形成的线粒体嵴是产生ATP的主要部位,为机体各项生命活动提供所需能量[16]。此外,存在于线粒体内膜的线粒体呼吸链可合成活性氧。正常生理状态下,活性氧的产生和消耗受机体氧化与抗氧化系统的调控而保持平衡。研究表明,过量的钼可降低机体抗氧化能力,打破体内氧化与抗氧化的平衡,导致活性氧生成增多[17-18]。活性氧的产生和消耗一旦失衡,可诱导氧化应激发生,进而损伤线粒体的结构与功能[19]。本研究在灌喂10 mg/kg钼酸钠后,可观察到子宫内膜超微结构的损伤,呈现线粒体空泡化,线粒体嵴溶解,消失核膜模糊,随着灌喂钼剂量的增加,线粒体空泡化更加明显,表明钼具有明显的线粒体毒性,造成这一结果的主要原因可能是钼诱导的氧化应激所引发。
钼引起线粒体损伤可能激活线粒体介导的细胞凋亡途径而诱导细胞凋亡。线粒体超微结构一旦受损可引起线粒体内促凋亡因子细胞色素C进入到细胞质内,促使细胞色素C与凋亡酶激活因子相互作用形成凋亡复合体,复合体又进一步促进下游caspase-9和caspase-3的激活,最终导致细胞凋亡[20-21]。本研究灌喂10 mg/kg钼酸钠后,子宫内膜细胞的凋亡率显著地升高,灌喂20 mg/kg和50 mg/kg钼酸钠后,细胞凋亡率极显著地上升,表明钼具有促进细胞凋亡的能力,且凋亡率呈剂量依赖性,这可能与钼损伤线粒体进而触发线粒体依赖性细胞凋亡相关。
综上所述,过量钼摄入可严重损伤子宫内膜的形态学和超微结构,并促进子宫内膜细胞凋亡发生,进一步破坏子宫内膜为胚胎着床及发育提供的微环境,但其具体作用机制有待深入研究。

