尿路上皮癌抗体偶联药物临床应用安全共识(第1版)
(中国医疗保健国际促进交流会泌尿健康促进分会,中国研究型医院学会泌尿外科学专业委员会)
晚期尿路上皮癌严重影响患者生存。长期以来,以顺铂为基础的化疗方案作为晚期转移性尿路上皮癌的一线标准治疗方案,患者中位生存期仅8~14个月[1-3]。随着免疫时代的到来,多个PD-1/PD-L1单抗被美国食品药品监督管理局(Food and Drug Administration, FDA)和国家药品监督管理局(National Medical Products Administration, NMPA)批准用于晚期尿路上皮癌的治疗[4-6]。另外,成纤维生长因子受体(fibroblast growth factor receptor, FGFR)抑制剂与抗体偶联药物(antibody-drug conjugate, ADC)的研究取得突破,并先后批准用于临床。国内外已经有多个ADC药物被用于尿路上皮癌的治疗,包括恩诺单抗(Enfortumab Vedotin, EV)、戈沙妥珠单抗(Sacituzumab Govitecan,SG)以及纬迪西妥单抗(Disitamab Vedotin, 研究代号:RC48)。
目前国内ADC药物用于晚期尿路上皮癌的治疗尚未广泛开展,对于其合理应用和不良反应管理方面的经验欠缺。有效地使用ADC药物对保障、提高ADC药物疗效及患者生活质量方面意义重大,本共识将从条件保障、人员培训、并发症防治和患者管理等方面,制定晚期尿路上皮癌患者ADC药物临床应用安全共识,促进中国尿路上皮癌患者ADC药物的安全应用。
1 医院及科室开展ADC药物治疗的条件保障
1.1 组织架构开展尿路上皮癌ADC药物治疗的医院必须具备多学科(multi-disciplinary team,MDT)会诊机制,涉及的专业至少包括泌尿外科、肿瘤内科、肿瘤放疗科、重症医学科等。同时,还应具备处置严重不良反应的应急处理机制:包括院内外急会诊(呼吸科、眼科、皮肤科、神经科等)及科室间转运机制等,以保障接受ADC药物治疗患者的基本医疗安全。
开展尿路上皮癌ADC药物治疗的临床科室还应具备以下保障条件,包括:根据医院或科室实际情况开展日间或住院治疗、设置专用治疗床位或可调剂床位、配备化疗药物配液中心或化疗药物配液室等。
1.2 人员保障开展ADC药物治疗的医院及科室需配备通过专业培训的专科医生和专科护士,相关医护人员必须熟练掌握应用ADC药物的适应证、化疗方案选择和剂量制定原则、化疗药物配制及配伍禁忌、化疗毒副反应的防治及化疗药物配置防护等,最终保证化疗过程中患者和医护人员双方的安全。
1.3 设备保障及药物输注ADC药物具有细胞毒性,为保证医护人员的自身安全,ADC药物的配置应在专门的化疗药物配置地点进行集中配置,如医院通风设施完善的化疗配药间或层流净化操作台,同时配备特殊防护设备。配置后的残余药品和废弃物按照化疗相关废弃物处理流程进行处理。
通过密闭式静脉留置套管针给药是传统的静脉给药途径,此方式存在药物外渗等局部治疗风险,应充分告知患者。如有条件可选择深静脉导管或植入式静脉输液港作为给药途径,药物可通过导管直接输送到中心静脉。
每次给药前应根据患者实际体重计算药物实际用量,避免体重测量不准确或治疗过程中体重出现波动,造成药物过量,药物配制应严格按照说明书进行,配制及输注时间应符合说明书规定。
1.4 医患沟通与患者管理ADC药物与现有抗肿瘤药物具有不同的药物机制,因此应重视其相关的不良反应,尤其是与现有抗肿瘤药物间不良反应的差异。晚期尿路上皮癌ADC药物治疗前患者需签署知情同意书,告知可能出现的不良反应。治疗期间应对患者进行追踪和管理,按期访视,评价疗效,以患者教育、门诊随访、电话及网络等方式完成患者的安全数据收集分析及全程管理。
专家共识推荐:ADC药物治疗的安全顺利开展,需要医院及科室相关部门的重视和硬件保障,保证患者能如期接受治疗,或发生不良反应时及时收住院处理;同时需要具备多学科协作会诊转诊机制和应对危急重症的应急处理能力。相关医师和护士在开展治疗工作之前,需认真接受相关专业培训,集中配置,合理输注,做好患者教育,治疗期间和结束后收集安全性数据,及时处理不良反应。
2 临床具体实施操作
2.1 ADC药物治疗患者适应证的合理化选择国内外有3种ADC药物用于晚期尿路上皮癌的治疗,分别为EV、SG及RC48,其均显示出了优越的疗效[7-12]。FDA先后批准EV、SG用于晚期尿路上皮癌治疗的适应证。NMPA批准了RC48用于既往接受过系统治疗且人类表皮生长因子受体-2(human epidermal growth factor receptor 2, HER2)阳性的晚期尿路上皮癌适应证,并已获得国内指南的推荐(表1)。
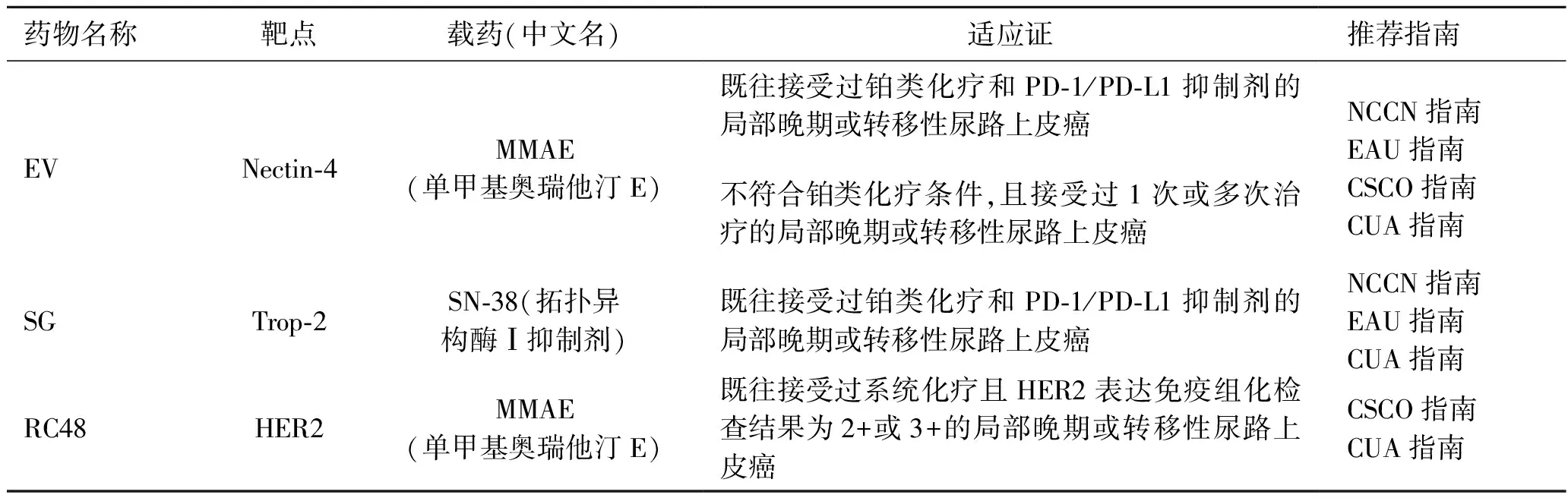
表1 晚期尿路上皮癌ADC药物指南推荐[13-16]
2.2 ADC药物治疗用药前评估及禁忌证ADC药物治疗相关不良反应可累及全身多个器官,且由于抗体和细胞毒性药物不同,各药物不良反应谱之间存在差异。因此,患者在进行ADC药物治疗前应进行全面系统的评估。用药前除评估常规的体能状态[美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体能状态评分]、血液学指标和合并症外,还应对不良反应发生的靶器官功能状态进行评估。如有皮疹、瘙痒、白癜风等,需记录发生部位及严重程度、评估基础心肺功能、有无眼部基础疾病,以及血糖、血脂等代谢和内分泌系统基础状态等。
患有活动性角膜炎或角膜溃疡的患者不建议应用EV,既往存在2级及以上的感觉或运动神经病变患者不建议应用EV或RC48。对ADC药物中活性成分或任何辅料存在超敏反应是ADC药物的禁忌证。
2.3 用药方法和疗效评估3种ADC药物用药方案和剂量见表2,给药剂量按照体重进行计算。实施化疗的科室必须具备心电监护、必要的抢救药物和措施。患者在输液过程中需进行心电监护,专科护士或医师在输液期间(尤其是首次输注时)需在床旁严密监测输液反应,并观察至输注结束后至少1 h,尤其对于首次用药的患者。

表2 ADC药物用药方案和剂量
患者接受ADC药物治疗可能发生输注反应,EV和RC48输注反应的发生率约7%~8%,在输液过程中不需要常规进行预处理,而SG输注反应的发生率为37%,其中1%为3~4级,故需提前给予苯海拉明以及抗组胺药物进行预处理,必要时可给予糖皮质激素。对于发生输注反应的患者,需及时停止输注,给予糖皮质激素、抗组胺药物、苯海拉明等对症治疗[10,17-18]。对于1~2级的输液反应,可待症状缓解后严密监测下调慢输液速度以尝试恢复给药;而对于发生严重输液反应的患者需永久停药。
恶心和呕吐是化疗药物常见的不良反应,部分专家建议在ADC药物治疗前可考虑使用止吐类药物(如胃复安或5-羟色胺抑制剂)及抑酸剂(如H2受体阻抗剂或质子泵抑制剂)。使用RC48发生恶心和呕吐的比例分别为20.9%和14%,使用EV治疗的患者发生恶心、呕吐的比例分别为39%和14%,而SG导致恶心和呕吐的比例更高[7,10]。因此对于使用SG的患者,可考虑联合应用NK-1受体抑制剂如阿瑞匹坦,降低恶心和呕吐反应的发生率。
患者接受ADC药物治疗前和治疗过程中应根据实体瘤的疗效评价标准(Response Evaluation Criteria In Solid Tumors version 1.1, RECIST 1.1)进行疗效评估,在接受ADC药物治疗期间注意患者生活质量的评估。
专家共识推荐:根据现有循证医学证据和国内现状,经由泌尿肿瘤多学科联合会诊(multi-disciplinary team,MDT)团队讨论后,在患者知情并充分沟通的情况下接受ADC药物治疗。在用药前和用药期间应全面评估患者身体情况,包括各个重要器官基线状态和治疗变化情况,特别是ADC药物需要关注的不良反应,最大限度保障ADC药物治疗的安全用药。使用ADC药物时,应严格按照推荐用药方案和剂量给药。警惕输液反应的发生,必要时给予预处理用药,保证治疗的顺利进行,治疗过程中应按照RECIST 1.1标准进行评估。
3 临床风险事件的管理和控制
ADC药物由大分子单克隆抗体、连接子和小分子的细胞毒药物偶联而成。因此,其不良反应发生的机制主要来自以下几个方面:首先是大分子单克隆抗体的脱靶效应;其次来源于小分子细胞毒药物;最后,连接子可能被特定酶所降解,进而导致某些特定组织器官的损伤。其中,ADC药物导致的不良反应大多与载药密切相关,与常见的细胞毒药物引起的不良反应谱类似。
EV及RC48的载药为MMAE,是海兔毒素10的合成衍生物,属于微管蛋白抑制剂,其通过抑制微管蛋白聚合而起到有效抑制有丝分裂的作用,从而实现抗肿瘤的目的[19]。MMAE导致的不良反应,除了细胞毒药物引起的消化道与骨髓抑制以外,值得关注的不良反应为脱发与神经毒性。SG使用的载药为SN-38,为拓扑异构酶Ⅰ抑制剂,其作用机制为抑制细胞DNA复制所必需的拓扑异构酶Ⅰ,诱导DNA发生单链损伤、阻断DNA复制而产生细胞毒性,该载药值得关注的不良反应为骨髓抑制与腹泻[20]。
由于抗体、连接子和细胞毒性药物不同,各ADC药物的不良反应存在差异。本共识按照不良反应发生的不同系统将3种ADC药物常见的不良反应进行分类,分别为皮肤反应、眼毒性、消化道反应、血液学毒性、神经毒性、肝毒性、肺毒性、代谢异常以及其他不良反应等,后文将对发生率较高或具有特定意义的不良反应的安全性管理进行简要介绍,总体不良反应情况见表3[9,21]。

表3 3种ADC药物不良反应表
3.1 皮肤黏膜系统不良反应
3.1.1皮肤反应 ADC药物引起的皮肤不良反应多见于EV治疗的患者,EV导致的皮肤反应发生率为43.9%,其中20.3%为严重皮肤反应[8]。常见的皮肤反应包括皮疹、瘙痒、皮肤干燥、斑丘疹等,严重皮肤反应包括大疱性皮炎、剥脱性皮炎,还可能发生中毒性表皮坏死综合征(Stevens-Johnson syndrome,SJS)和中毒性表皮坏死(toxic epidermal necrolysis, TEN)。大部分皮肤反应在EV治疗第1周期即出现,少部分在后续治疗中发生。应用SG的患者发生皮疹的比例为6.0%,而在使用RC48治疗的患者中,发生瘙痒的比例为16.3%[9-10]。
应用ADC药物治疗期间应监测患者皮肤状况,同时关注有无口腔黏膜炎和结膜炎,在有临床指征时考虑使用局部皮质类固醇和抗组胺药。对于覆盖10%~30%体表面积的2级皮肤反应应高度警惕,如果进一步加重恶化,或发生覆盖30%以上面积的3级皮肤反应,应暂停使用ADC药物治疗,尽快就诊皮肤专科进行治疗直至皮肤状况改善或解决,再考虑在药物支持情况下恢复ADC药物使用。对于出现4级或复发性3级皮肤反应的患者,应当立即请皮肤专科医生诊治并永久停用ADC药物治疗。
3.1.2眼毒性 眼毒性为应用EV需要特别关注的不良反应,EV导致的眼部疾病发生约为40%,大多涉及角膜,这与角膜分布有药物作用的靶点Nectin-4有关,包括角膜炎、视力模糊、流泪增多、结膜炎及干眼症等。发病到出现症状性眼疾的中位时间为1.6(0.3~19.1)个月。使用EV治疗期间应监测患者的眼部状况,可考虑使用人工泪液进行干眼症预防。若眼部症状出现或未得到解决,应进行眼科评估。若眼科检查后显示有必要,可考虑使用局部类固醇药物治疗。对于有症状的眼部疾病,应考虑中断或减少EV剂量[18]。
3.2 消化系统不良反应消化系统不良反应包括消化道反应和肝毒性反应。消化道反应是ADC药物常见的不良反应,包括恶心、呕吐、纳差和腹泻等。SG导致恶心、呕吐和腹泻的发生率分别为60%、30%和65%[9]。使用EV治疗的患者发生恶心和腹泻的比例分别为23%和24%,而使用RC48治疗患者恶心和呕吐的发生率为21%和14%,腹泻则罕见发生[8,10]。对于恶心、呕吐,可应用止吐药物进行预防。
其中SG导致的腹泻需要关注,其发生率为65%,主要与载药SN-38有关,包括早发性腹泻和迟发性腹泻[9]。早发性腹泻是因为胆碱能作用所致,通常是暂时的,可同时伴有流涎增多、出汗、心动过缓和肠蠕动亢进引起的腹部绞痛。对于短时间内出现胆碱能综合征的患者可静脉或皮下注射阿托品。迟发型腹泻通常在应用SG 24 h后发生,持续时间可能较长,可导致脱水、电解质紊乱或感染。一旦发生迟发性腹泻需及时给予易蒙停治疗,在出现粪便不成形、稀便或排便频率增多时即开始治疗,首剂4 mg,之后每2 h给予2 mg直至腹泻停止后12 h,同时维持水和电解质平衡。不推荐连续使用以上剂量易蒙停超过48 h,因为有出现麻痹性肠梗阻的风险。
转氨酶升高为ADC药物治疗常见的不良反应,部分伴有胆红素升高。EV、SG和RC48报道的谷丙转氨酶(alanine aminotranferase, ALT)或谷草转氨酶(aspartate aminotransferase, AST)升高的比例分别为9%~12%、26%~28%和32.6%,且绝大多数为轻到中度[10,17-18],经保肝对症治疗后多能快速恢复。若患者发生药物相关的≥3级转氨酶升高,建议每周2次进行血生化检查;若患者在暂停用药28 d后仍未恢复至常见不良反应评价标准(Common Terminology Criteria for Adverse Events, CTCAE)(评分为0~2级或开始治疗前水平),则建议停止治疗,参见表4。应对使用上述药物治疗的患者进行常规肝功能监测,并在发生肝功能异常时及时进行干预。
3.3 血液系统不良反应血液系统不良反应是ADC药物常见的不良反应,包括中性粒细胞减少症、贫血、血小板减少症,主要与偶联的细胞毒药物导致的骨髓抑制有关。
SG发生任意级别中性粒细胞减少的比例为46.0%,其中34.0%为3级及以上,10.0%发生中性粒细胞减少性发热,因此给药期间需要密切监测血液学毒性[9]。EV发生中性粒细胞减少的比例分别为10.0%,其中3级以上6.0%。应用RC48的患者41.9%发生中性粒细胞减少,其中3级以上14.0%[10]。在任意治疗周期的第1天,绝对中性粒细胞计数低于1 500个/mm3;或任意治疗周期的第8天,中性粒细胞计数低于1 000个/mm3,或应暂停使用SG[17]。出现发热性中性粒细胞减少症时,给予经验性抗生素治疗并完善病原学检查,并考虑预防性应用升白细胞药物。
SG贫血发生率为33.0%,其中3级以上者占14.0%;EV和RC48贫血发生率分别为12.0%和26.0%,3级以上发生率较低;三者发生血小板减少的比例都相对较低。贫血和血小板减少可依据一般化疗药物处理原则进行,必要时给予输血和药物支持治疗。
3.4 神经系统不良反应EV和RC48均有导致周围神经病变的风险,EV报道的发生率为33.8%,RC48为14%,与其偶联的微管蛋白抑制剂MMAE相关[8,10]。同时,使用RC48治疗的患者中有60.5%发生感觉迟钝[10]。SG在尿路上皮癌中报道的周围神经病变的发生率仅为4%[9]。周围神经病变发生率与药物剂量相关,均以1~2级周围神经病变为主[22]。
在接受EV和RC48治疗过程中,应积极监测是否有周围神经病变发生。周围神经病变分为感觉神经病变和运动神经病变,感觉神经病变包括各种感觉减退、感觉过敏、感觉倒错和烧灼性疼痛等各种神经痛的症状;运动神经病变主要为四肢无力,严重者可出现站立不稳、无法行走,甚至卧床。当患者出现周围神经病变时,可给予甲钴胺及其他B族维生素营养神经治疗;对于神经痛,可选择普瑞巴林、阿替林、文拉法辛或度洛西汀等对症治疗,并请神经内科协助诊治[21]。当治疗过程中出现较为严重的周围神经病变(2级及以上)时,如肢体无力、行走不稳,或因肢体麻木疼痛,经对症治疗后仍影响日常生活时,应暂缓 ADC药物治疗;如症状改善,患者能够生活自理时,可考虑重新开始治疗,并调整 ADC药物剂量至下一剂量水平(详情参见表4);若症状无明显改善应建议永久性停药。周围神经病变一旦出现恢复时间较长,建议密切监测并及时进行减量或停药处理。

表4 ADC药物用药减量方案
此外,EV和RC48偶联的MMAE可能具有植物神经毒性,从而诱发麻痹性肠梗阻。RC48报道的肠梗阻发生率约为5.3%,在用药过程中需注意保持大便通畅。一旦发生肠梗阻需暂时停药、灌肠通便,待肠道功能恢复后再继续给药。
3.5 呼吸系统不良反应3种ADC药物呼吸系统不良反应为肺毒性反应,均罕见报道。对于ADC药物联合PD-1单抗治疗时,药物性肺损伤的发生率可能升高,可能与ADC药物进一步激活体内的免疫反应产生协同作用相关。药物相关性肺损伤多表现为间质性肺病(interstitial lung damage, ILD)。
在接受ADC药物联合免疫治疗期间,如患者出现咳嗽、呼吸困难、发热和/或任何新的恶化呼吸道症状时,应立即报告,同时密切关注患者是否具有ILD的症状、体征和影像学改变,及时发现ILD的证据,可疑ILD患者应及时请呼吸科会诊并指导进一步的治疗。
3.6 代谢系统不良反应常见的代谢系统不良反应包括血糖升高以及血甘油三酯升高。使用EV的受试者中约14%出现血糖升高,7%为3级或4级。在使用RC48治疗的患者中,11.6%发生血糖升高,23.3%发生血甘油三酯升高,均为轻度不良反应[10]。SG在尿路上皮癌中报道的血糖升高发生率<1%且≤2级。
应在EV治疗期间密切关注可能患有糖尿病或高血糖患者的血糖水平;但血糖升高亦可发生于既往无糖尿病史的患者中,若血糖升高(>13.9 mmol/L),应暂停治疗,并警惕出现血糖升高引起的酮症酸中毒。血糖降至13.9 mmol/L以下,可考虑恢复同一剂量水平的ADC药物治疗并加强血糖监测和降糖治疗。RC48所导致的高血糖可参考以上原则进行处理。
专家共识推荐:ADC药物由于独特的组织结构与作用机制,不同于既往的化疗药物、靶向药物以及免疫治疗药物,其不良反应主要来自针对靶点的单克隆抗体产生脱靶效应以及偶联的细胞毒药物等,可累及多个脏器系统,严重者可威胁生命,处理不良反应过程中应充分结合MDT机制,早期发现、及时处理,避免出现严重的不良反应。
EV靶向的Nectin-4分子与正常皮肤组织和角膜上皮的表达有关,因此应用EV时需要特别关注皮肤反应和眼毒性,定期进行皮肤科和眼科的评估。而针对ADC药物偶联细胞毒药物导致的不良反应中,消化道反应、骨髓抑制、神经毒性是常见的不良反应。SG导致的腹泻与中性粒细胞减少的发生率比较高,而EV和RC48需要特别关注是神经毒性。对于ADC药物联合PD-1/PD-L1单抗等治疗,对可能合并更重的不良反应,应高度警惕。
4 减量及停药原则
ADC药物相关不良反应主要依据CTCAE进行分级,根据发生级别的不同进行减量或停药的处理(表4)。临床上在不良反应的管理中要对特殊的不良反应予以重视,建立并积极开展MDT会诊,保障患者的用药安全。总体原则是1级不良反应可继续用药;2级不良反应绝大多数可维持原剂量继续用药,部分不良反应如血小板减少、神经毒性及角膜病变需暂停用药,待恢复至1级后继续用药;3级不良反应,应及时暂停ADC药物治疗,在不良反应恢复至1级后给予减量治疗;4级不良反应或反复多次发生3级反应则应考虑停止治疗(表5)。

表5 ADC药物剂量调整基本原则
专家共识推荐:对于ADC药物应用过程中可能发生的不良反应,治疗前应给予积极预防治疗;用药后应密切监测相关不良反应,及时诊断并给予对应处置方案,同时重新评估药物治疗方案,必要时进行延期治疗或减量处理;对于严重不良反应要及时停药,积极开展多学科会诊,探讨解决方案。
5 特殊人群处理
5.1 糖尿病患者ADC药物影响体内糖脂代谢,建议糖尿病患者将血糖控制稳定后再开始治疗。EV和RC48报道的血糖升高发生率均超过10%,SG报道的血糖升高发生率更低,不到1%。
5.2 眼部疾病患有活动性角膜炎或角膜溃疡的患者不建议应用EV治疗。
5.3 肾功能不全肾功能不全患者无需调整EV剂量,包括重度肾功能不全(肌酐清除率<30 mL/min)。SN-38几乎不从肾进行清除,但对于肾功能不全或终末期肾病无药代动力学数据。RC48对于轻、中度肾功能损害患者无需进行剂量调整,尚无重度肾功能损害患者的研究数据。
专家共识推荐:对于ADC药物治疗前患者的基础器官功能需进行充分评估,对于有特定基础疾病的患者需排除禁忌证后在严密监测下应用,以保障患者的用药安全。
6 小 结
由于ADC药物在国内临床尚未普及应用,以上不良反应主要依据说明书和临床研究数据,部分药物未披露完整临床研究数据。新药在临床实际应用过程中仍需进一步积累经验,本共识为临床应用提供参考,确认了上市药品的有效性,增进了临床医生对ADC药物在实际使用情况下对广泛人群安全性的了解,有助于不断完善ADC药物的不良反应管理。
编辑与撰写专家(按姓氏拼音排序)
毕 兴 新疆医科大学附属肿瘤医院泌尿外科
曹 明 上海交通大学医学院附属仁济医院泌尿外科
范晋海 西安交通大学第一附属医院泌尿外科
范欣荣 北京协和医院泌尿外科
关 豹 河南省肿瘤医院泌尿外科
李 源 中南大学湘雅二院泌尿外科
李向东 中山大学附属肿瘤医院泌尿外科
刘希高 山东大学齐鲁医院泌尿外科
吕 强 江苏省人民医院泌尿外科
任 珂 重庆医科大学附属第一医院泌尿外科
沈益君 复旦大学附属肿瘤医院泌尿外科
盛锡楠 北京大学肿瘤医院泌尿肿瘤内科
瓦斯里江 医科院肿瘤医院泌尿外科
王 凯 辽宁省肿瘤医院泌尿外科
王 坤 天津市肿瘤医院泌尿外科
王永华 青岛大学附属医院泌尿外科
吴开杰 西安交通大学第一附属医院泌尿外科
鄢 阳 上海市第十人民医院泌尿外科
杨恺惟 北京大学第一医院泌尿外科
叶明佶 湖南省肿瘤医院泌尿外科
曾 浩 四川大学华西医院泌尿外科
张亚群 卫生部北京医院泌尿外科
审稿与讨论专家(按姓氏拼音排序)
陈 鹏 新疆医科大学附属肿瘤医院泌尿外科
苟 欣 重庆医科大学附属第一医院泌尿外科
郭 军 北京大学肿瘤医院泌尿肿瘤内科
何志嵩 北京大学第一医院泌尿外科
贺大林 西安交通大学第一医院泌尿外科
胡 滨 辽宁省肿瘤医院泌尿外科
李 源 中南大学湘雅二院泌尿外科
刘 明 卫生部北京医院泌尿外科
刘卓炜 中山大学附属肿瘤医院泌尿外科
牛海涛 青岛大学附属医院泌尿外科
史本康 山东大学齐鲁医院泌尿外科
魏 强 四川大学华西医院泌尿外科
谢 宇 湖南省肿瘤医院泌尿外科
薛 蔚 上海交通大学医学院附属仁济医院泌尿外科
杨铁军 河南省肿瘤医院泌尿外科
姚 欣 天津市肿瘤医院泌尿外科
姚旭东 上海市第十人民医院泌尿外科

