Pnpla3 I148M和Tm6sf2 E167K双突变纯合小鼠模型的构建
王孟轲, 刘守胜, 褚雪汝, 王艺奋, 辛永宁
1 青岛大学附属青岛市市立医院 a.感染性疾病科, b.临床研究中心, 山东 青岛 266071;2 中国海洋大学 医药学院, 山东 青岛 266071
非酒精性脂肪性肝病(NAFLD)是指除酒精和其他明确的损肝因素所致的、以弥漫性肝细胞大泡性脂肪变性为主要特征的临床病理综合征[1-3]。有研究[4-6]发现NAFLD与胰岛素抵抗和遗传易感性显著相关。含patatin样磷脂酶域3(patatin-like phospholipase domain containing 3, Pnpla3)位于22号染色体上[7], 主要表达于脂肪组织和肝脏[8]。跨膜蛋白6超家族成员2基因(transmembrane 6 superfamily member 2,Tm6sf2)位于第19号染色体上,TM6SF2主要定位于内质网膜,主要表达于肝脏和小肠[9],这两个器官参与全身脂质稳态的调节[10]。全基因组关联和外显子组测序结果显示Pnpla3 I148M和Tm6sf2 E167K基因的遗传变异与NAFLD的易感性和进展相关,Pnpla3 I148M是指该蛋白第148位异亮氨酸被蛋氨酸取代,Tm6sf2 E167K是指该蛋白第167位谷氨酸被赖氨酸取代,Pnpla3和Tm6sf2基因的遗传变异与肝脂肪含量增加、进展为非酒精性脂肪型肝炎、肝硬化和肝细胞癌密切相关[11-13]。人群研究[14-15]发现Pnpla3 I148M和Tm6sf2 E167K双突变对NAFLD的发展产生叠加效应,协同参与肝脏脂肪变性的发展。但是Pnpla3 I148M联合Tm6sf2 E167K对NAFLD的共同作用及机理尚不明确,因此本研究旨在构建Pnpla3 I148M和Tm6sf2 E167K双突变小鼠模型,探究其在常规饮食条件下体内脂质代谢的变化,为探究Pnpla3 I148M和Tm6sf2 E167K双突变在NAFLD发病中的联合作用及相关机制提供良好的动物模型。
1 材料与方法
1.1 材料 Tm6sf2 E167K小鼠与Pnpla3 I148M小鼠均为本课题组所有(青岛大学附属青岛市市立医院肝病研究室),所有小鼠均饲养于SPF级动物房。实验动物生产许可证:SCXK(苏)2018-0008,实验动物使用许可证: SYXK(鲁)20200009。TC、TG、AST和ALT检测试剂盒购买自南京建成生物工程研究所;血糖仪和血糖试纸购买自日本OMRON公司;胰岛素检测试剂盒购买自上海酶联生物科技有限公司。
1.2 Pnpla3148M/MTm6sf2167K/K小鼠的繁育策略 Pnpla3148I/M和Tm6sf2167E/K杂合小鼠通过各自自交,分别得到Pnpla3148M/M和Tm6sf2167K/K单突变纯合小鼠,通过Pnpla3148M/M单突变纯合小鼠与Tm6sf2167K/K单突变纯合小鼠交配,得到Pnpla3148I/MTm6sf2167E/K双突变杂合小鼠,最后通过Pnpla3148I/MTm6sf2167E/K双突变杂合小鼠自交,得到Pnpla3148M/MTm6sf2167K/K双突变纯合小鼠(图1)。统计Pnpla3148I/MTm6sf2167E/K双突变杂合小鼠自交后的子代中Pnpla3148M/MTm6sf2167K/K小鼠、Pnpla3148M/M单突变纯合小鼠、Tm6sf2167K/K单突变纯合小鼠、杂合小鼠(包括Pnpla3 I148M或Tm6sf2 E167K单突变杂合小鼠及双突变杂合小鼠)和Wt小鼠的数量,计算各种基因型小鼠数量占总体的比例,检验是否符合孟德尔遗传分离定律。
1.3 Pnpla3148M/MTm6sf2167K/K小鼠的基因鉴定 剪取1~2周龄小鼠0.3 cm小鼠尾尖于1.5 mL EP管中,加入60 μL碱性裂解液A(A液:25 mmol/L氢氧化钠;20 μmol/L 乙二胺四乙酸二钠),95 ℃金属浴40 min后加入60 μL裂解液B(B液:40 mmol/L Tris-Cl),机械研磨3 min,6000 r/min离心6 min得到上清液即为粗提所得DNA,以其作为模板进行PCR扩增。将PCR扩增产物进行琼脂糖凝胶电泳,根据条带大小来鉴定Tm6sf2基因型,利用基因测序方法鉴定Pnpla3基因型。Tm6sf2和Pnpla3的PCR引物见表1,Pnpla3测序引物见表2。
1.4 小鼠口服普通糖耐量试验(oral glucose tolerance test,OGTT) 选择8周龄同窝别Pnpla3148M/MTm6sf2167K/K(n=6)、Pnpla3148M/MTm6sf2167E/E(n=6)、Pnpla3148I/ITm6sf2167K/K(n=6)和Wt(n=6)雄性小鼠,提前数天给小鼠做掐尾训练。

表2 Pnpla3小鼠基因型测序引物序列Table 2 Primer sequences for Pnpla3 mouse genotype sequencing
实验当天于早上8点给予小鼠禁食6 h,禁食结束后称量体质量并检测鼠尾静脉空腹血糖,然后给每只小鼠进行葡萄糖灌胃(2 g葡萄糖/kg体质量)[16]。分别测量灌胃后30、60、120 min时的小鼠尾静脉血糖,记录血糖值并制作OGTT曲线。
1.5 小鼠生化指标检测 选择8周龄同窝别Pnpla3148M/MTm6sf2167K/K(n=6)、Pnpla3148M/MTm6sf2167E/E(n=6)、Pnpla3148I/ITm6sf2167K/K(n=6)和Wt(n=6)雄性小鼠,禁食禁水6 h后,称量体质量,利用4%水合氯醛对小鼠进行麻醉后取血(采用乙二胺四乙酸二钠抗凝),2500×g,4 ℃离心20 min,取上层血浆。然后解剖出小鼠的主要组织器官进行形态学对比,并计算肝脏指数。按照说明书方法测量小鼠血浆TC、TG、AST、ALT和胰岛素水平。
1.6 Pnpla3148M/MTm6sf2167K/K小鼠肝组织学评估 取上述8周龄雄性小鼠的肝脏,用0.9%等渗生理盐水清洗后用4%多聚甲醛固定,脱水后用石蜡包埋并切片,分别做小鼠肝组织的HE染色和油红O染色,光学显微镜观察并拍照。
1.7 统计学方法 数据使用 GraphPad prism 8软件处理,多组间比较采用方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 Pnpla3148M/MTm6sf2167K/K小鼠的基因鉴定 取小鼠鼠尾DNA进行PCR扩增,扩增后将产物进行1.5%琼脂糖凝胶电泳。Tm6sf2基因型的鉴定结果为:琼脂糖凝胶电泳结果只有一条203 bp条带则是Tm6sf2167K/K纯合突变小鼠,只有一条147 bp条带则是Tm6sf2167E/E野生小鼠,同时扩增出上述两条条带则是Tm6sf2167E/K杂合小鼠。Pnpla3基因型的鉴定结果为:琼脂糖凝胶电泳显示扩增出506 bp条带后进行基因测序,测序结果证实第444位密码子由ATT突变为ATG,为Pnpla3148M/M小鼠,若同时存在ATT和ATG两种碱基类型,则为Pnpla3148I/M小鼠(图2)。
2.2 孟德尔遗传分离定律检测 将Pnpla3148I/MTm6sf2167E/K小鼠进行自交,统计子代Pnpla3148M/MTm6sf2167K/K、Pnpla3148M/MTm6sf2167E/E、Pnpla3148I/ITm6sf2167K/K、杂合(Pnpla3148I/MTm6sf2167E/K、Pnpla3148I/MTm6sf2167E/E、Pnpla3148I/ITm6sf2167E/K、Pnpla3148M/MTm6sf2167E/K和 Pnpla3148I/MTm6sf2167K/K)和Wt小鼠的数量,结果见表3,各种基因型小鼠数量总体比例大致为1∶1∶1∶12∶1,符合孟德尔遗传分离定律,并且子代小鼠生长状况正常,无死亡。这些结果说明Pnpla3148I/MTm6sf2167E/K双突变小鼠能够进行正常繁育后代,并且后代可以正常存活。
2.3 不同基因型小鼠体质量和肝指数的差异检测 Pnpla3148M/MTm6sf2167K/K、Pnpla3148M/MTm6sf2167E/E、Pnpla3148I/ITm6sf2167K/K和Wt小鼠以普通饮食喂养8周,检测不同基因型小鼠的体质量变化。结果显示,Pnpla3148M/MTm6sf2167K/K基因型小鼠与其他三种基因型小鼠体质量无明显差异(P值均>0.05),检测小鼠肝湿重发现Pnpla3148M/MTm6sf2167K/K小鼠高于Wt小鼠的肝湿重(P<0.05),但通过计算各组小鼠的肝指数发现,Pnpla3148M/MTm6sf2167K/K基因型小鼠的肝指数与其他三种基因型小鼠的肝指数比较,差异无统计学意义(P值均>0.05)(图3)。
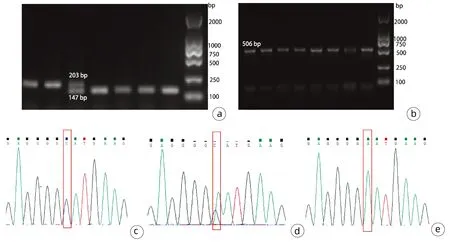
注:a,Tm6sf2 E167K突变小鼠基因型鉴定电泳结果;b,Pnpla3 I148M突变小鼠基因型鉴定电泳结果;c、d和e为Pnpla3 I148M突变小鼠 基因型鉴定测序结果(c,Pnpla3148M/M;d,Pnpla3148I/M;e,Pnpla3148I/I)。图2 Pnpla3 I148M和Tm6sf2 E167K突变小鼠基因型鉴定和测序结果Figure 2 Genotype identification and sequencing results of Pnpla3 I148M and Tm6sf2 E167K mutant mice
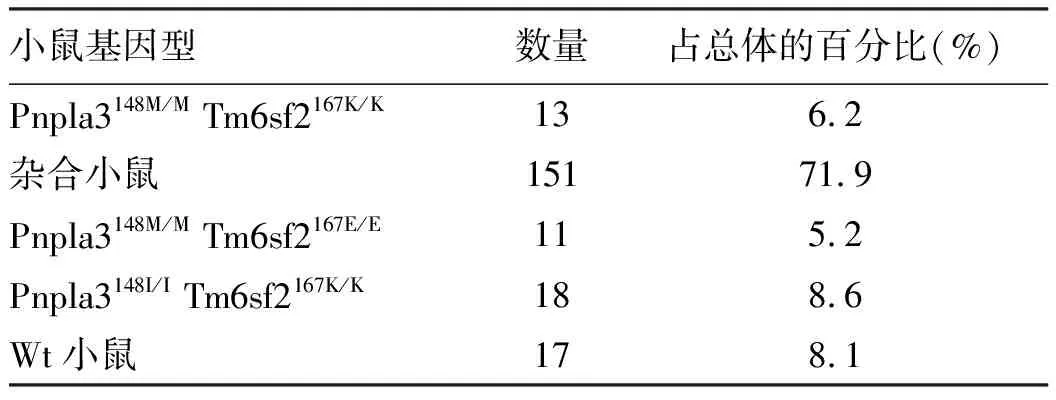
表3 Pnpla3148I/M Tm6sf2167E/K小鼠自交后子代各基因型数量Table 3 Number of progenies with each genotype afterPnpla3148I/ MTM6SF2167E/K mice self-breeding
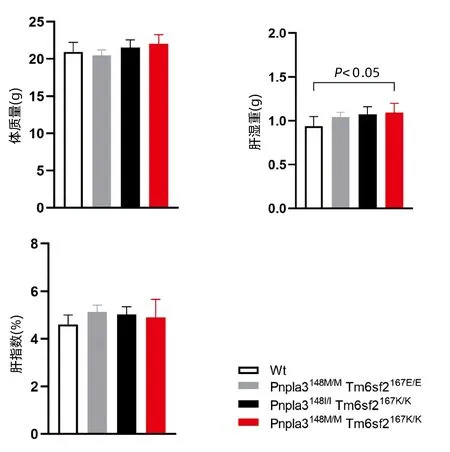
图3 四种基因型小鼠在8周龄时的体质量、肝湿重和肝指数比较
2.4 不同基因型小鼠各组织的表型比较 分别解剖8周龄的Pnpla3148M/MTm6sf2167K/K、Pnpla3148M/MTm6sf2167E/E、Pnpla3148I/ITm6sf2167K/K和Wt小鼠的脑、甲状腺、心脏、肺、肝脏、脾脏、胃、肠、肾和睾丸,对比四组小鼠各个器官的大小和形态,发现四组小鼠之间的器官形态无明显差异(图4)。
2.5 不同基因型小鼠的葡萄糖代谢差异 对8周龄的Pnpla3148M/MTm6sf2167K/K、Pnpla3148M/MTm6sf2167E/E、Pnpla3148I/ITm6sf2167K/K和Wt雄性小鼠的空腹血糖进行检测,结果显示Pnpla3148M/MTm6sf2167K/K空腹血糖低于Tm6sf2167K/K单突变小鼠和Wt小鼠,差异均有统计学意义(P值均<0.05),而与Pnpla3148M/M单突变小鼠无明显差异(P>0.05),提示Pnpla3 I148M突变会导致小鼠空腹血糖下降。OGTT曲线下面积比较结果显示,Pnpla3148M/MTm6sf2167K/K小鼠OGTT曲线下面积较Tm6sf2167K/K单突变小鼠升高,差异有统计学意义(P<0.05),较Pnpla3148M/M单突变小鼠和Wt小鼠无明显差异(P值均>0.05),提示Pnpla3148M/MTm6sf2167K/K双突变较Tm6sf2167K/K单突变更容易导致小鼠葡萄糖耐受能力的下降;对四组小鼠的胰岛素水平检测结果显示,胰岛素水平在不同基因型小鼠中的水平无明显差异(P值均>0.05)。Pnpla3148M/MTm6sf2167K/K小鼠的胰岛素抵抗指数(HOMA-IR)较Wt小鼠有所降低,这与两组小鼠之间的空腹血糖含量趋势一致(图5)。
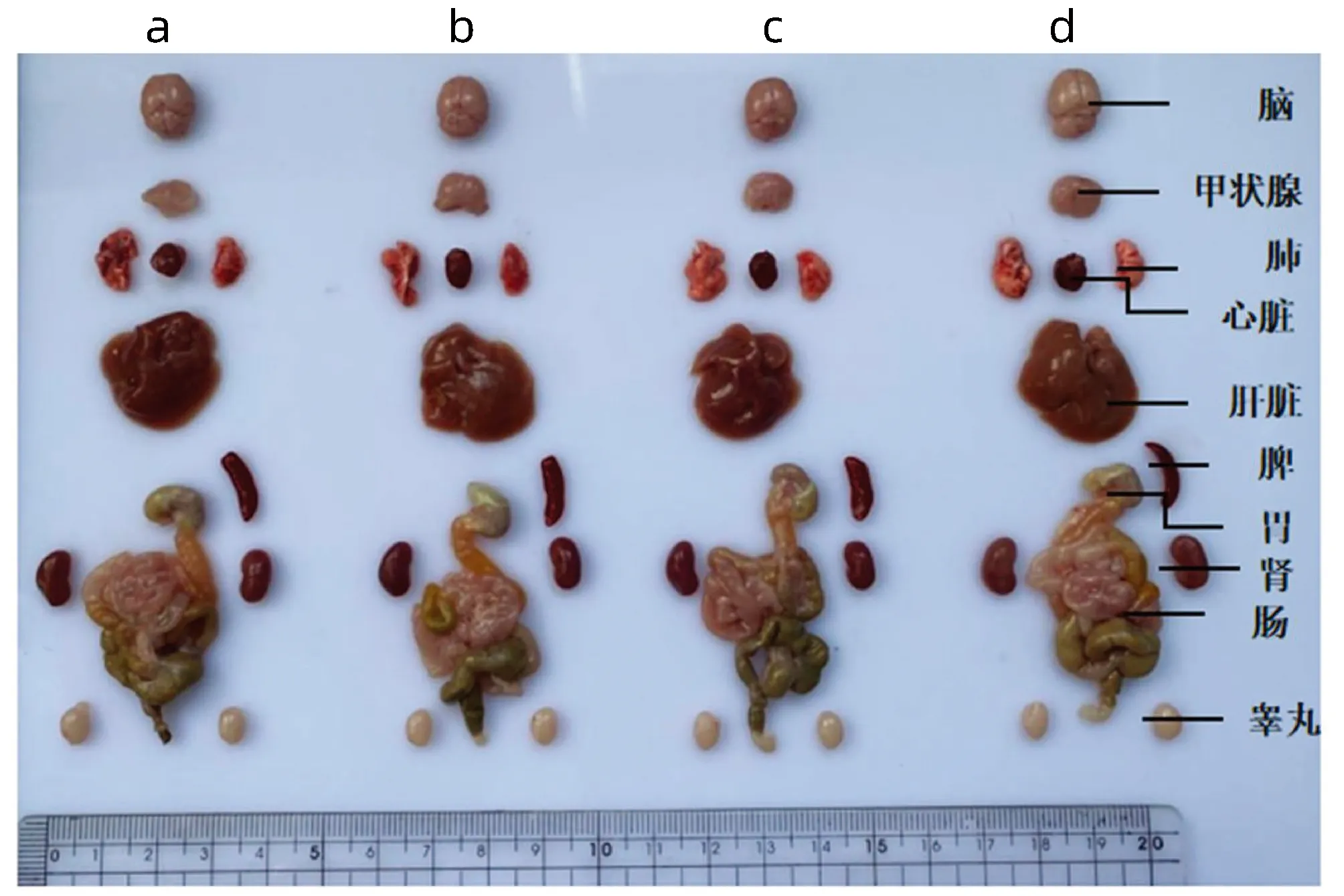
注:a,Pnpla3148M/M Tm6sf2167K/K 基因型小鼠; b,Pnpla3148M/M Tm6sf2167E/E基因型小鼠;c,Pnpla3148I/I Tm6sf2167K/K基因型小鼠; d,Wt小鼠。
2.6 不同基因型小鼠血浆生化指标检测 对8周龄Pnpla3148M/MTm6sf2167K/K、Pnpla3148M/MTm6sf2167E/E、Pnpla3148I/ITm6sf2167K/K和Wt雄性小鼠的血浆TG、TC、AST和ALT水平进行检测,结果显示Pnpla3148M/MTm6sf2167K/K小鼠血浆中的TG、TC、ALT和AST水平和另外三种基因型小鼠比较,差异均无统计学意义(P值均>0.05)(图6)。
2.7 不同基因型小鼠肝脏HE染色和油红O染色结果
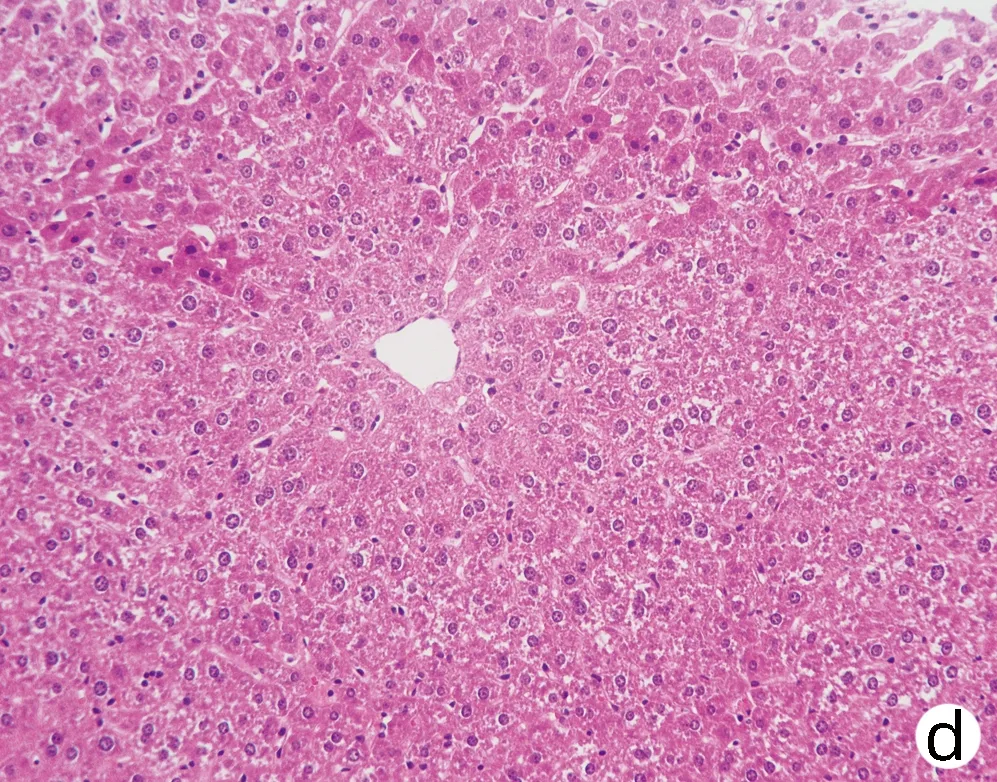
对8周龄Pnpla3148M/MTm6sf2167K/K、Pnpla3148M/MTm6sf2167E/E、Pnpla3148I/ITm6sf2167K/K和Wt雄性小鼠的肝脏进行HE染色和油红O染色,结果显示Pnpla3148M/MTm6sf2167K/K小鼠与Pnpla3 I148M、Tm6sf2 E167K单突变和Wt小鼠肝组织学之间无明显差异(图7);油红O染色结果表明Pnpla3148M/MTm6sf2167K/K小鼠比Pnpla3148M/M单突变小鼠和Wt小鼠肝脏内脂滴水平有所增多,提示Pnpla3 I148M和Tm6sf2 E167K双突变较Pnpla3 I148M单突变小鼠和Wt小鼠的肝脏更易发生脂质积累,但同Tm6sf2 E167K单突变小鼠相比无明显差异(图8)。
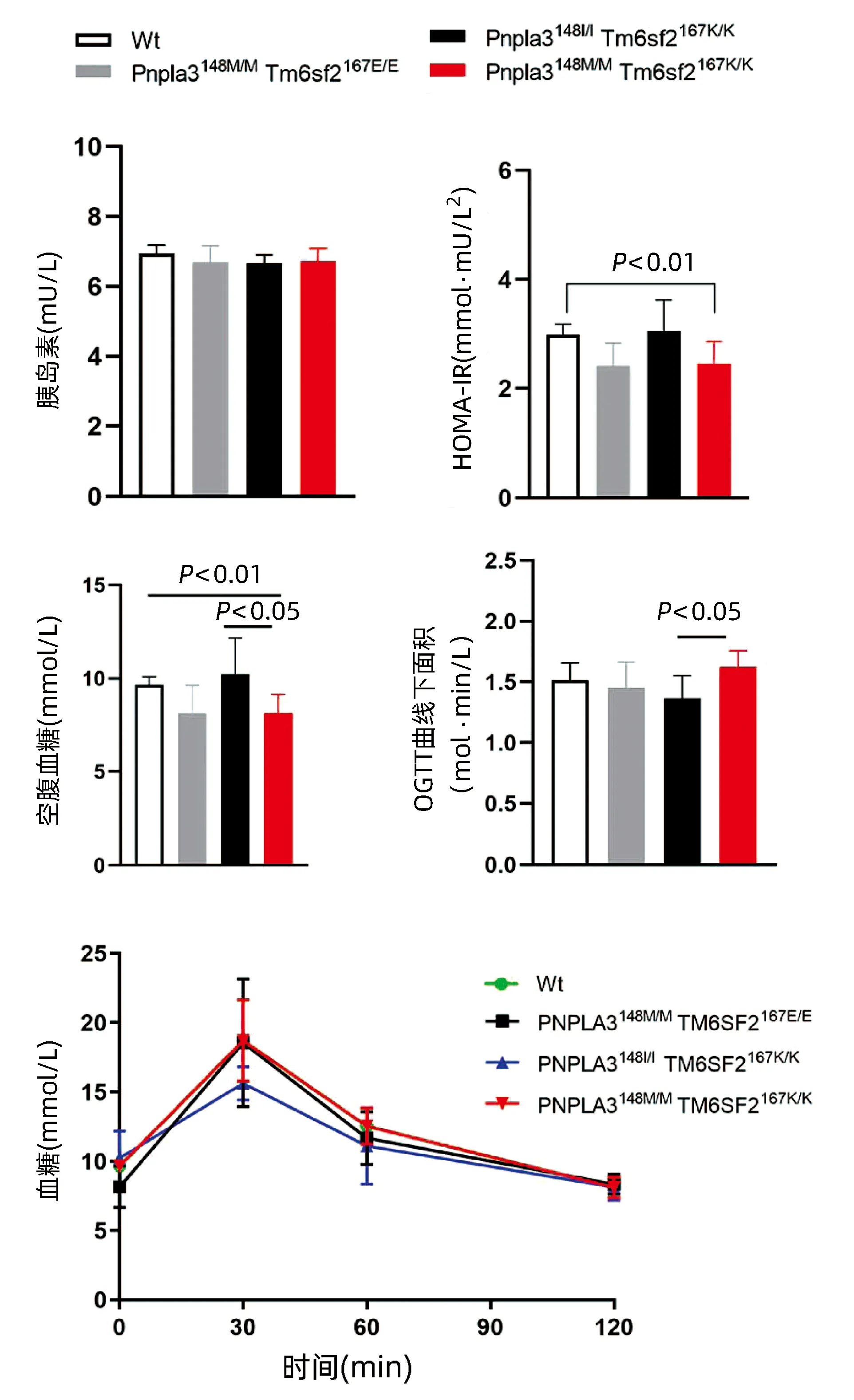
注:*P<0.05;**P<0.01。图5 四种基因型小鼠葡萄糖耐量比较Figure 5 Comparison of glucose tolerance of micewith four genotypes
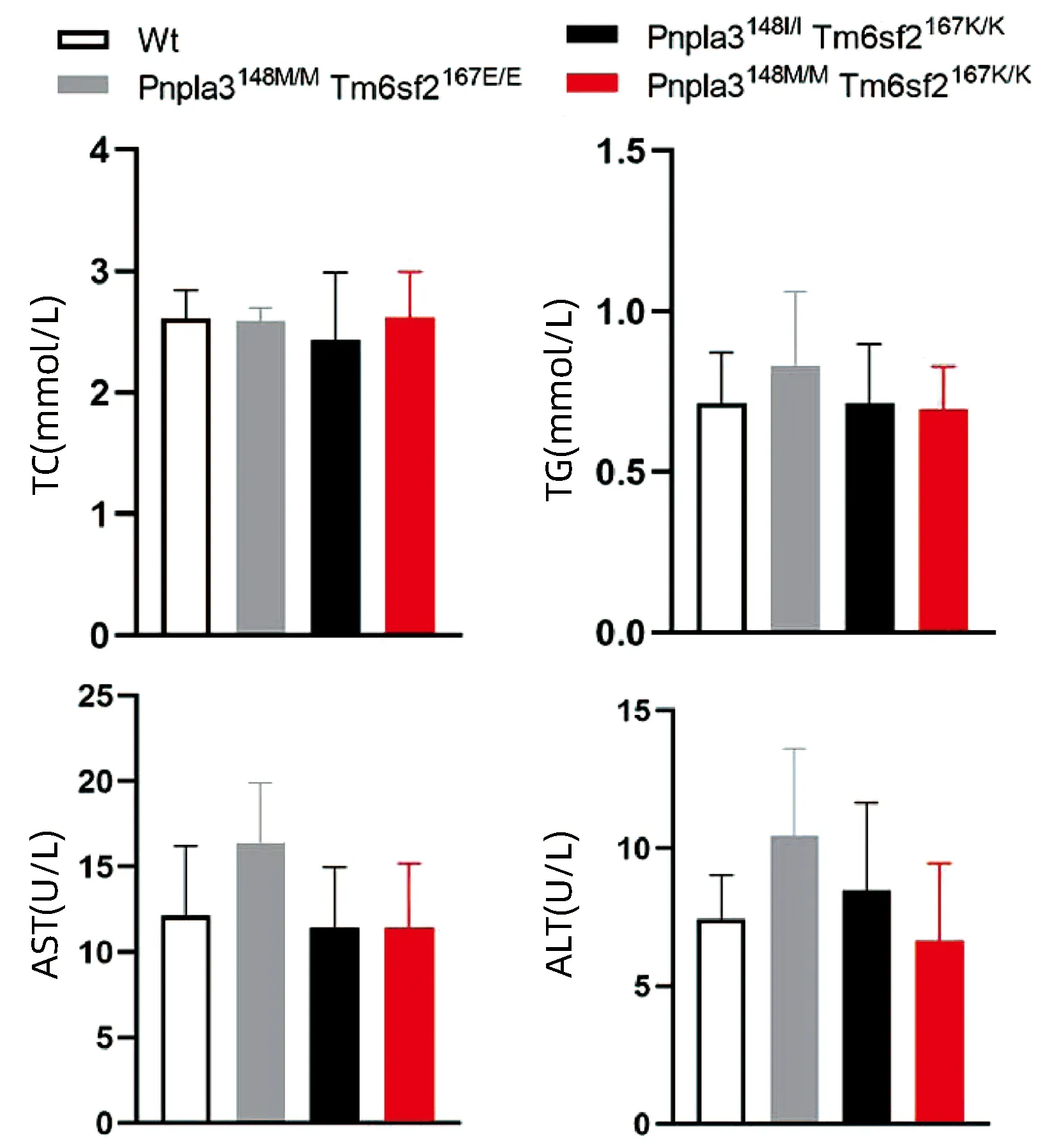
图6 四种基因型小鼠血浆生化水平Figure 6 Plasma biochemical levels of mice withfour genotypes
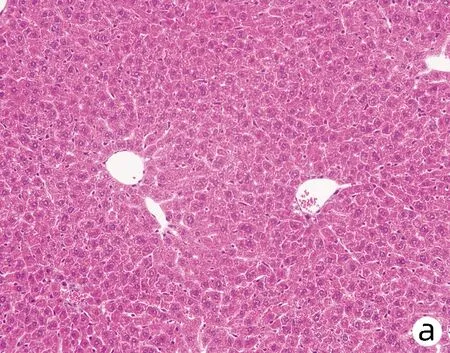
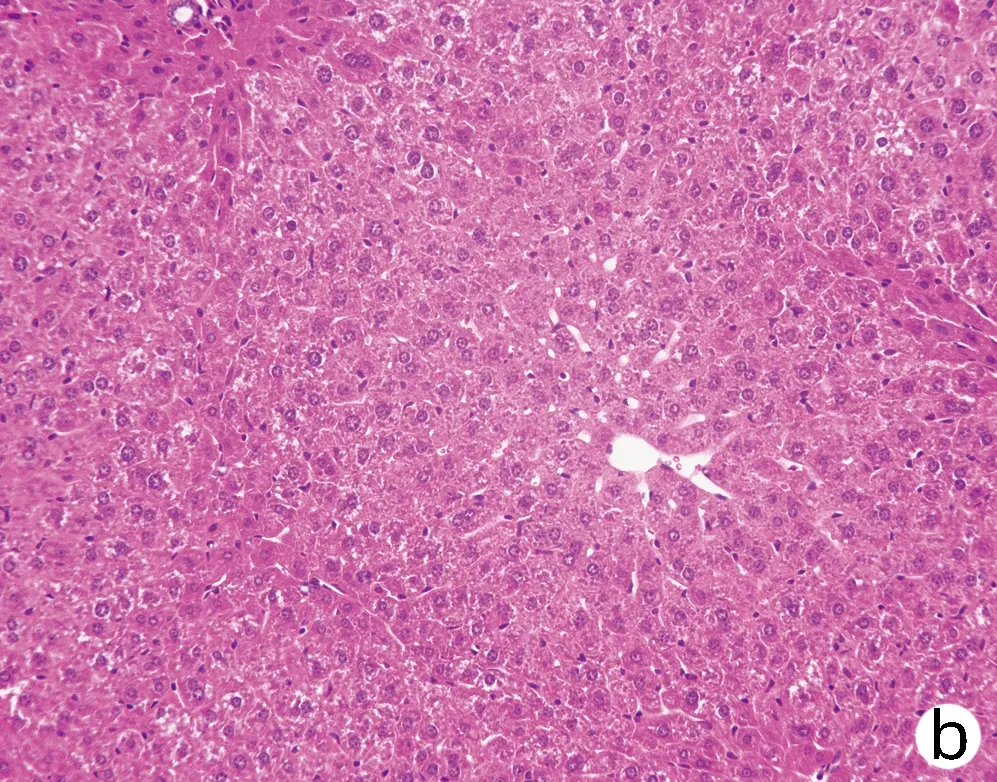

注:a,Wt;b,Pnpla3148M/M Tm6sf2167E/E; c,Pnpla3148I/I Tm6sf2167K/K;d,Pnpla3148M/M Tm6sf2167K/K。图7 四组基因型小鼠肝脏HE染色(×200)Figure 7 HE staining of liver of mice with fourgenotypes (×200)

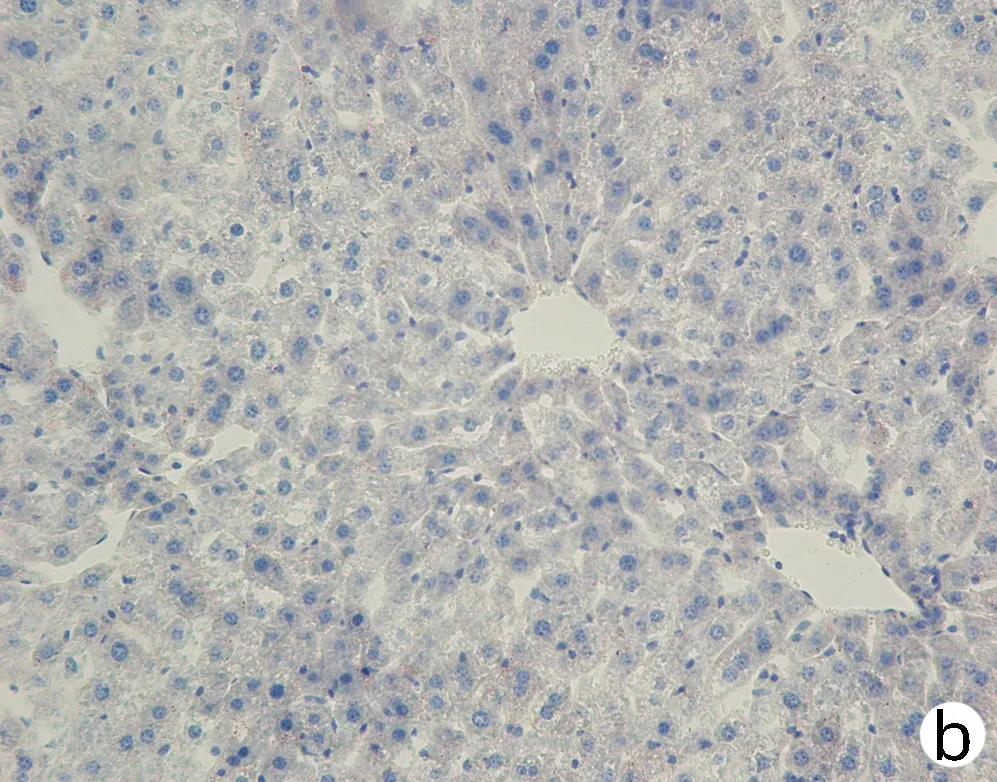
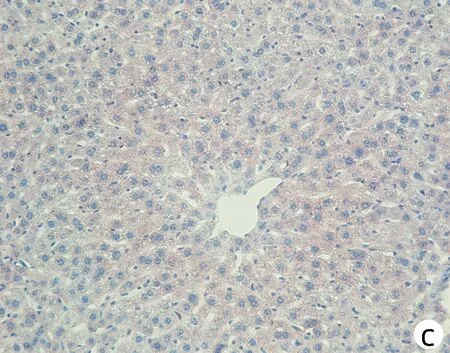
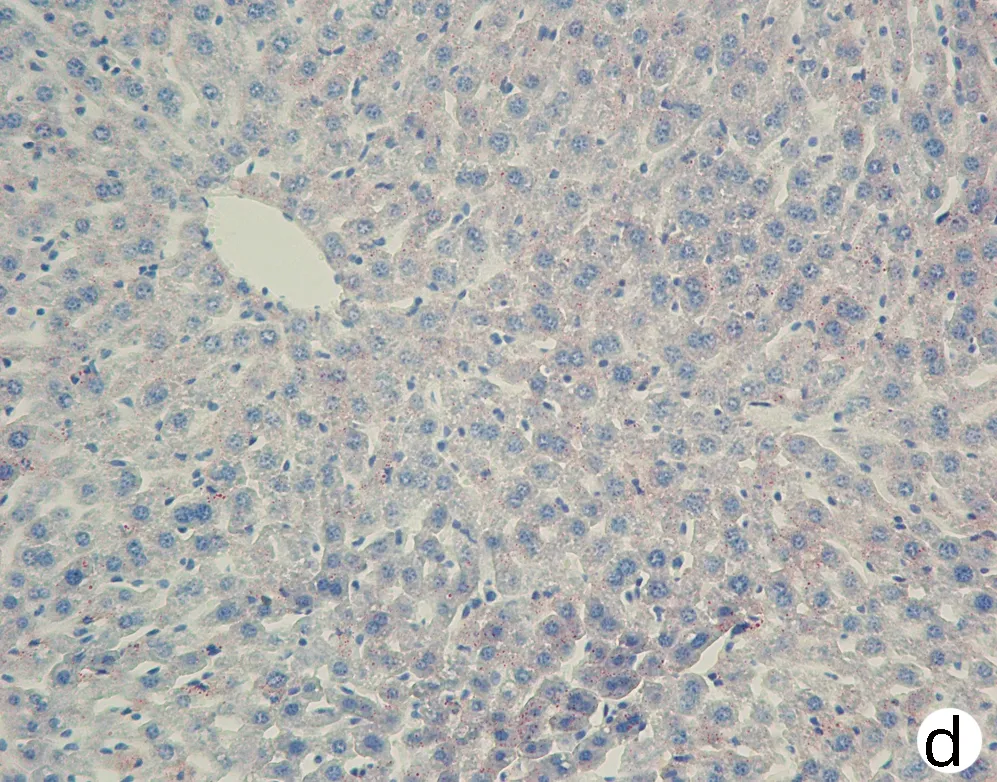
注:a,Wt;b,Pnpla3148M/M Tm6sf2167E/E; c,Pnpla3148I/I Tm6sf2167K/K;d,Pnpla3148M/M Tm6sf2167K/K。图8 四组基因型小鼠肝脏油红O染色(×200)Figure 8 Oil red O staining of liver of mice with fourgenotypes (×200)
3 讨论
NAFLD患病人数的逐年增加给社会带来了沉重的医疗和经济负担,在全球范围内,NAFLD的平均发病率为25%[17]。尽管目前关于NAFLD的研究已经取得了显著进展,但是其发病机制至今尚未完全阐明。前期笔者的研究发现,Pnpla3 I148M和Tm6sf2 E167K在细胞水平上可发挥联合作用从而共同调节细胞内的脂质代谢过程[18],但未在动物水平进行验证。因此本文通过杂交繁育获得了Pnpla3148M/MTm6sf2167K/K双突变小鼠,为进一步在动物水平探究 PNPLA3 I148M 及 TM6SF2 E167K 双突变引发肝脏脂肪变性的作用及分子机制奠定动物模型基础。
在本研究中,完成Pnpla3148M/MTm6sf2167K/K双突变小鼠模型构建后,对Pnpla3148M/MTm6sf2167K/K双突变小鼠的表型做了初步研究。本研究把PNPLA3 I148M 和 TM6SF2 E167K 双突变杂合小鼠交配的后代分为Pnpla3148M/MTm6sf2167K/K、Pnpla3148M/MTm6sf2167E/E、Pnpla3148I/ITm6sf2167K/K和Wt四组。统计Pnpla3148I/MTm6sf2167E/K小鼠自交后代的存活数量,发现PNPLA3I148M和 TM6SF2 E167K 双突变小鼠能够正常存活,无胚胎致死情况发生。 Pnpla3148M/MTm6sf2167K/K小鼠的体质量较其他3种基因型小鼠体质量无明显差异,进一步对小鼠各器官形态进行观察发现,Pnpla3148M/MTm6sf2167K/K小鼠各器官形态较其他3种基因型小鼠各器官形态无明显差异。检测小鼠葡萄糖代谢指标,糖耐量试验发现Pnpla3148M/MTm6sf2167K/K和Pnpla3148M/M单突变小鼠空腹血糖无明显差异,但Pnpla3148M/MTm6sf2167K/K小鼠的空腹血糖低于Tm6sf2167K/K单突变小鼠和Wt小鼠,提示Pnpla3 I148M和Tm6sf2 E167K双突变会降低小鼠的空腹血糖;OGTT曲线下面积是评价葡萄糖耐量的指标,结果显示Pnpla3148M/MTm6sf2167K/K小鼠OGTT曲线下面积高于Tm6sf2167K/K单突变小鼠,表明Pnpla3148M/MTm6sf2167K/K双突变小鼠的葡萄糖耐受能力较Tm6sf2167K/K单突变小鼠有所下降。
通过对小鼠血脂和肝功指标的检测发现,Pnpla3148M/MTm6sf2167K/K双突变小鼠血浆中TC、TG、ALT和AST与其余三种基因型小鼠无明显差异。肝脏油红O染色提示Pnpla3148M/MTm6sf2167K/K双突变较Pnpla3148M/M单突变小鼠和Wt小鼠更容易发生肝脏的脂质积累,但Pnpla3148M/MTm6sf2167K/K双突变小鼠同Tm6sf2167K/K单突变小鼠的肝内脂滴水平无明显差异。
本研究成功构建了Pnpla3148M/MTm6sf2167K/K双突变小鼠模型,该模型有利于在动物水平探究 Pnpla3 I148M 及 Tm6sf2 E167K 双突变引发肝脏脂肪变性的作用及分子机制,揭示 Pnpla3 I148M 和Tm6sf2 E167K 双突变在NAFLD发病过程中的交互作用。
伦理学声明:实验所用动物均按照青岛大学附属医院医学实验动物伦理委员会批准的原则进行。伦理审批编号:AHQU-MAL20180504,伦理通过时间2018年5月4日。
利益冲突声明:本研究不存在研究者、伦理委员会成员以及与公开研究成果有关的利益冲突。
作者贡献声明:王孟轲进行课题设计与实施、撰写论文;刘守胜进行课题设计、论文审阅;褚雪汝、王艺奋进行课题实施、数据收集;辛永宁进行课题设计、实验指导和提供经费。

