基于葡萄糖激酶和葡萄糖-6-磷酸脱氢酶的NADPH高效再生
于 平,杨柳贞,马 健,张琪立,陈庆伟
(浙江工商大学食品与生物工程学院 杭州 310018)
烟酰胺腺嘌呤二核苷酸磷酸,又称还原型辅酶II(NADPH),在细胞合成代谢中作为供氢体提供还原力参与酶促反应[1],然而,目前在工业生物催化应用研究中,通常需人为添加外源辅酶NADPH 以完成催化反应。由于NADPH 是一种昂贵、稳定性差、难以重复利用的试剂,通过不断添加外源辅酶NADPH 会导致成本高昂且效率低,因此构建辅酶NADPH 再生系统,对于经济、高效的生物催化氧化工艺至关重要。辅酶再生的基本原理是氧化态的辅酶NADP+通过氧化-还原反应转化为还原态辅酶NADPH,实现辅酶NADPH 原位再生[2-3]。经过科研工作者们不懈的努力,建立了很多辅酶NADPH 的再生方法,如电化学法、光化学法、化学法原位再生、酶法再生以及构建辅酶循环再生系统,改造辅酶合成途径,调控辅酶再生代谢途径,寻找辅酶替代物等[4]。生物细胞胞内代谢是酶制备与酶催化最有效的过程[5-6]。生物细胞内含有多种酶和辅酶,其代谢系统具有一定的协调性和稳定性,利用细胞内的代谢途径和关键酶实现辅酶NADPH 胞内再生是一条重要的途径[7]。通常使用基因工程技术,将辅酶NADPH 再生关键酶基因导入工程菌进行表达,实现辅酶胞内高效再生[8]。
目前广泛应用的微生物细胞内NADPH 的合成代谢途径主要包括4 类:戊糖磷酸途径(PPP 途径)、糖酵解途径(EMP 途径)、酒精发酵途径(ED途径)和三羧酸循环(TCA 循环)等[9]。在这些合成代谢途径中所涉及的一些酶属于合成NADPH 的关键酶,将其运用于代谢工程中可增加NADPH的利用率并增强生物转化过程。Spaans 等[10]综述了细菌和古生菌代谢途径中辅酶NADPH 再生的关键酶:1)参与中心碳代谢反应,包括PPP 途径和ED 途径的葡萄糖-6-磷酸脱氢酶(G6PDH)和6-磷酸葡萄糖酸脱氢酶(6PGDH),TCA 循环的异柠檬酸脱氢酶(IDH)和苹果酸酶(ME),EMP 途径的甘油醛-3-磷酸脱氢酶(GAPN) 和葡萄糖脱氢酶(GDH);2)参与非中心碳代谢反应,包括能量非依赖性可溶性转氢酶(STH),依赖于能量或质子转移的膜结合转氢酶(H+-TH),铁氧还蛋白-NADP+氧化-还原酶,胞质NADP+还原氢化酶(SH)以及NAD+激酶(NADK)。郑雅楠等[11]构建了己糖激酶与葡萄糖-6-磷酸脱氢酶共表达的大肠杆菌,以葡萄糖为底物实现了辅酶NADPH 的高效再生,并将辅酶再生体系与醇脱氢酶AdhR 联合催化,使不对称还原4-氯乙酰乙酸乙酯的催化活力提高至原始值的2.5 倍。Pham 等[12]构建重组大肠杆菌P450pyrTM-GDH,可通过辅因子循环进行P450催化的羟化反应,并且也将GDH 与多组分P450单加氧酶共表达以增强氧化作用。将全细胞作为生物催化剂,可通过NADPH 的细胞内再循环提高脂环族底物在非活化碳原子上的高度区域和立体选择性羟基化,提高生产率[13]。Poulsen 等[14]在黑曲霉(Aspergillus niger)内过量表达PPP 中的关键酶G6PDH、6PGDH 和转酮醇酶(TKT),培养野生型和工程菌株。结果表明,过量表达6PGDH 使内源性NADPH 浓度增加2~9 倍。Lim 等[15]分别将编码G6PDH 与6PGDH 的基因zwf 和gnd 导入大肠杆菌中进行表达,结果发现与编码6PGDH 的基因gnd 相比,编码G6PDH 的基因zwf 将NADPH 的水平提高了3 倍,使得内源性NADPH/NADP+的比例提高了6 倍。
本研究主要利用基因工程技术,将合成NADPH 的关键酶基因即葡萄糖激酶与葡萄糖-6-磷酸脱氢酶基因(glk-zwf)构建到大肠杆菌BL21(DE3)中,实现辅酶NADPH 高效循环再生,并探究异丙基-β-D-硫代半乳糖苷(IPTG)浓度、诱导温度、接种量、装液量对辅酶NADPH 再生的影响;通过正交设计优化试验,探讨重组菌株产辅酶NADPH 的最佳工艺条件,为实现工业化生产辅酶NADPH 提供理论基础。
1 材料与方法
1.1 材料、试剂和仪器
1.1.1 菌种和质粒 大肠杆菌K12(Escherichia coli K12)、大肠杆菌DH5α(E.coli DH5α)、大肠杆菌BL21(E.coli BL21)和质粒pETDuet-1 均来源于实验室保存的菌株。
1.1.2 主要试剂 蛋白胨、酵母提取物、氯化钠、氨苄青霉素、琼脂粉、异丙基-β-D-硫代半乳糖苷(IPTG)、蛋白电泳上样缓冲液、三羟甲基氨基甲烷(Tris)、甘氨酸(Glycine)、十二烷基硫酸钠(SDS)、硼酸、EDTA 二钠等购自上海生工生物有限公司;基因组提取试剂盒、质粒提取试剂盒、核酸胶回收试剂盒、PCR 产物纯化试剂盒、大肠杆菌感受态制备试剂盒、DNA 聚合酶 (PrimeSTAR Max DNA Polymerase)、限制性核酸内切酶(NdeI、XhoI)、T4连接酶、DL2000 DNA Marker、DL5000 DNA Marker 等购自大连Takara 宝生物工程有限公司。
1.1.3 仪器与设备 PCR 仪,德国EPPENDORF公司;凝胶成像分析系统,美国BIO-RAD 公司;LRH-250 生化培养箱,上海领仪科技有限公司;SKY-200B 台式恒温振荡器,上海苏坤实业有限公司;YXQ-LS-50SII 高压灭菌锅,上海博讯医疗生物仪器股份有限公司;TGL-16G 高速冷冻离心机,广州卢瑞明仪器有限公司;Agilent 1100 高效液相色谱仪,美国安捷伦科技有限公司。
1.1.4 培养基与试剂配制
1.1.4.1 LB 培养基 蛋白胨10 g/L、酵母提取物5 g/L、氯化钠10 g/L,pH 7.0~7.2,121 ℃,灭菌20 min。
1.1.4.2 标准品NADPH 母液 准确称取0.0050 g NADPH 到小烧杯中,用超纯水定容到10 mL 容量瓶中,即得600 μmol/L NADPH 母液,-20 ℃冰箱保存。
1.1.4.3 考马斯亮蓝染色液 准确称取0.5 g 考马斯亮蓝R-250 置于1 L 大烧杯中,依次加入225 mL 甲醇、225 mL 蒸馏水和50 mL 冰醋酸,混匀。
1.1.4.4 脱色液 300 mL 甲醇、600 mL 蒸馏水、100 mL 冰醋酸,混匀,常温放置。
1.2 试验方法
1.2.1 葡萄糖激酶基因(glk)与葡萄糖-6-磷酸脱氢酶基因(zwf)的克隆 以大肠杆菌K12 基因组为模板,在50 μL 体系中分别进行PCR 扩增glk与zwf 目的基因片段。PCR 扩增体系:大肠杆菌K12 基因组1 μL,上下游引物各1.5 μL,高保真酶混合液(PrimeSTAR Max Polymerase)25 μL,无菌蒸馏水21 μL。PCR 反应条件:95 ℃预变性10 min;95 ℃变性30 s,退火15 s,72 ℃延伸15 s,30个循环;72 ℃进一步延伸10 min;4 ℃保存。设定glk 基因退火温度为55 ℃,zwf 基因退火温度为56℃。将PCR 扩增产物进行1%琼脂糖凝胶电泳检测。本试验中采用重叠延伸PCR 技术获得包含2个目的基因glk 和zwf 序列的全长PCR 产物(glkzwf)。将割胶回收纯化后的glk 和zwf 基因片段各取1 μL 共同作为模板,以glk-F 和zwf-R 各1.5 μL 作为引物,高保真酶混合液25 μL,无菌蒸馏水21 μL。重叠延伸反应条件:95 ℃预变性5 min;95℃变性30 s,68 ℃退火30 s,72 ℃延伸2.5 min,循环2 次后退火温度降2 ℃再延伸,以此类推,直到设定退火温度为58 ℃;最后72 ℃延伸10 min,4℃保存。将PCR 扩增产物进行1%琼脂糖凝胶电泳检测,把目的基因片段(glk-zwf)大小为2 442 bp 的条带进行割胶回收纯化。
1.2.2 重组质粒pETDuet-1-glk-zwf 的构建 将获得的目的基因片段(glk-zwf)和质粒pETDuet-1,分别用NdeI 和XhoI 进行双酶切,酶切温度为37 ℃,时间6 h。酶切结束后进行回收纯化,双酶切产物用T4DNA 连接酶连接,连接温度16 ℃,时间14 h。将连接产物转化到大肠杆菌DH5α 感受态细胞中,挑取氨苄青霉素抗性平板上的单菌落于液体LB 培养基(含100 μg/mL 的氨苄青霉素)培养过夜,提取质粒,进行质粒大小验证、双酶切验证以及PCR 验证,再进一步送到上海生工测序验证,从而筛选得到重组质粒pETDuet-1-glk-zwf。按照TaKara 大肠杆菌感受态制备试剂盒说明书制备感受态细胞,酶切产物纯化和质粒提取参照Takara 公司的PCR 产物纯化试剂盒和质粒提取试剂盒。重组质粒构建流程图如下图1所示。

图1 重组质粒pETDuet-1-glk-zwf 构建流程图Fig.1 Flow chart of the construction of recombinant plasmid pETDuet-1-glk-zwf

表1 葡萄糖激酶基因(glk)与葡萄糖-6-磷酸脱氢酶基因(zwf)克隆所用的引物序列Table 1 Primer sequences used in the cloning of the genes glk and zwf
1.2.3 重组菌株诱导表达 分别将质粒pETDuet-1 和重组质粒pETDuet-1-glk-zwf 导入到大肠杆菌BL21 感受态细胞中,得到重组菌株大肠杆菌BL21/pETDuet-1 和重组表达菌株大肠杆菌BL21/pETDuet-1-glk-zwf。按1%接种量接种原始菌株大肠杆菌BL21 和构建好的重组菌大肠杆菌BL21/pETDuet-1、大肠杆菌BL21/pETDuet-1-glkzwf 于10 mL LB 液体培养基(含100 μg/mL 的氨苄青霉素) 中,37 ℃、180 r/min 摇床振荡培养16 h。再按1%接种量转接至装液量为50 mL/250 mL LB 液体培养基中,37 ℃、180 r/min 摇床振荡培养至OD600nm为0.6~0.8 时,向培养基中加入0.1 mmol/L 的IPTG,28 ℃低温继续诱导培养24 h 后收集菌体。
1.2.4 细胞超声破碎 取诱导培养后的菌液,在8 000 r/min、4 ℃条件下离心10 min,去掉上清液,收集菌体。加入磷酸缓冲液重悬,置于超声破碎仪器中进行细胞破碎,150 W 工作5 s,停止5 s,重复90 次。破碎后的菌液在8 000 r/min、4 ℃条件下离心10 min,收集上清液和沉淀重悬液进行SDSPAGE 分析。蛋白凝胶电泳使用10%分离胶和5%浓缩胶,电泳结束后用考马斯亮蓝R-250 染色液染色,然后用脱色液进行脱色,凝胶成像仪观察电泳情况。
1.2.5 IPTG 浓度对NADPH 再生的影响 设置IPTG 浓度分别为 0.05,0.15,0.25,0.35,0.45 mmol/L;按1%接种量接种于50 mL/250 mL LB 发酵培养基,诱导温度24 ℃,诱导24 h。
1.2.6 诱导温度对NADPH 再生的影响 设置诱导温度分别为16,20,24,28,37 ℃,选取IPTG 诱导浓度为0.15 mmol/L,按1%接种量接种至50 mL/250 mL LB 发酵培养基,诱导24 h。
1.2.7 接种量对NADPH 再生的影响 分别设置1%,2%,3%,4%,5%接种量接种于50 mL/250 mL LB 发酵培养基,选取IPTG 诱导浓度0.15 mmol/L,诱导温度24 ℃,诱导24 h。
1.2.8 装液量对NADPH 再生的影响 在250 mL 的三角锥形瓶中设置装液量为25,50,75,100,125 mL LB 发酵培养基,选取IPTG 诱导浓度0.15 mmol/L,诱导温度24 ℃,1%接种量,诱导24 h。
1.2.9 正交试验优化辅酶NADPH 再生的培养条件 根据上述单因素实验确定诱导温度、IPTG 浓度、接种量、装液量的最佳取值范围,进一步采用SPSS 软件设计四因素三水平的正交试验,以诱导温度(A)、IPTG 浓度(B)、接种量(C)、装液量(D)作为正交试验的自变量,以辅酶NADPH 产量作为因变量,以1、2、3 作为4 个自变量因素水平的编码,正交试验因素与水平的设计如表2所示。

表2 正交试验因素与水平的设计Table 2 Factors and levels of orthogonal experiment
1.2.10 诱导时间对辅酶NADPH 再生的影响 诱导时间的长短直接关系到辅酶NADPH 最终合成量的高低。基于1.2.9 节正交试验优化好的培养条件,按照1.5%的接种量接种重组大肠杆菌,装液量为100 mL/250 mL,IPTG 浓度0.25 mmol/L,诱导72 h,每隔一定时间进行取样测定NADPH 的产量,探究不同诱导时间对NADPH 产量的影响。
1.3 辅酶NADPH 产量测定方法
采用高效液相色谱法(HPLC)检测细胞破碎离心后上清液中的辅酶NADPH 产量,检测条件为:色谱柱:Waters Atlantis T3(3.0 mm×150 mm,3 μm);流动相:20 mmol/L 磷酸钾缓冲液,pH=7.3;进样量:5 μL,柱温:30 ℃;检测波长:340 nm;流速:0.4 mL/min,运行时间15 min。
1.4 统计分析
试验数据的统计分析采用SPSS 17.0 软件,绘图采用Origin 8.5 软件。
2 结果与分析
2.1 目的基因glk 和zwf 的扩增与重组质粒的鉴定
以大肠杆菌K12 基因组为模板,进行葡萄糖激酶基因(glk)和葡萄糖-6-磷酸脱氢酶基因(zwf)的PCR 扩增,经1%琼脂糖凝胶电泳检测,结果如图2所示。图2a 目的基因片段glk 大小为966 bp,图2b 目的基因片段zwf 大小为1 476 bp,泳道1 和2 中的基因条带与的基因片段大小符合。以glk 基因和zwf 基因为模板,经重叠延伸PCR 扩增,结果如图2c 所示,目的基因片段glk-zwf 理论大小为2 442 bp,泳道1 和2 中的基因条带与目的基因片段大小符合。

图2 glk 和zwf 基因电泳图谱Fig.2 Electrophoresis map of glk and zwf genes
随机挑取抗性平板上长出的4 个单菌落至LB 培养基中 (含100 μg/mL 的氨苄青霉素),37℃、180 r/min 摇床振荡过夜培养24 h,提取质粒并分别命名为P1、P2、P3 和P4。分别以质粒P1、P2、P3 和P4 为模板,进行重叠延伸PCR 扩增,结果如图3所示。重组质粒pETDuet-1-glk-zwf 的大小为7 862 bp,可初步判断质粒P1、P2 和P4 为阳性克隆。挑选P1 进行测序,通过Blast 比对分析发现,重组质粒P1 中的外源基因片段与NCBI 数据库公布的glk-zwf 序列比对结果均为100%,说明重组质粒pETDuet-1-glk-zwf 构建成功。

图3 质粒大小鉴定(a)、双酶切鉴定(b)和重叠延伸PCR 鉴定电泳图(c)Fig.3 Electrophoresis diagram of plasmid size identification (a),double enzyme digestion identification (b)and overlap PCR identification (c)
2.2 重组菌株的SDS-PAGE 分析
重组菌株大肠杆菌BL21/pETDuet-1-glk-zwf经IPTG 诱导表达后进行SDS-PAGE 分析,结果如图4所示。泳道3 蛋白电泳条带大小分别接近54.0 ku 和35.0 ku,与理论值一致,可见重组菌株实现了可溶性表达。
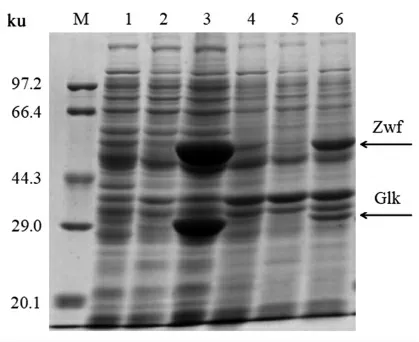
图4 SDS-PAGE 蛋白电泳结果Fig.4 Results of SDS-PAGE protein electrophoresis
2.3 NADPH 标准曲线的绘制
配制了不同浓度的NADPH 标准溶液,用HPLC 法进行检测,将峰面积作为纵坐标,NADPH浓度作为横坐标,进行线性拟合,绘制标准曲线,结果如图5所示。标准溶液NADPH 的线性回归方程为y = 2.5104x-15.75936,相关系数为R2=0.99679,显示线性拟合良好。
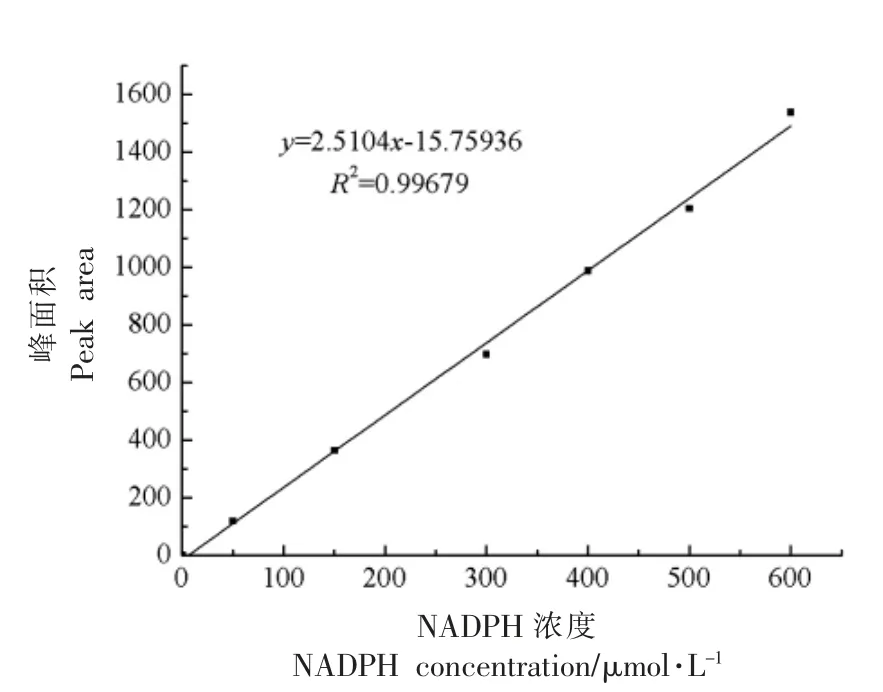
图5 NADPH 浓度标准曲线Fig.5 Standard curve of NADPH concentration
2.4 HPLC 法测定重组大肠杆菌中辅酶NADPH再生的能力
为了验证所构建的重组大肠杆菌BL21/pETDuet-1-glk-zwf 是否具有辅酶NADPH 再生的能力,对重组菌株进行IPTG 诱导表达,收集菌体,进行细胞破碎,取破碎上清液通过HPLC 法检测重组菌株中辅酶NADPH 再生的能力。标准品NADPH 的保留时间为9.220 min (图6a);样品NADPH 的保留时间为9.220 min(图6b),与标准品NADPH 的保留时间一致,由此推断出重组菌株具有辅酶NADPH 再生的能力。
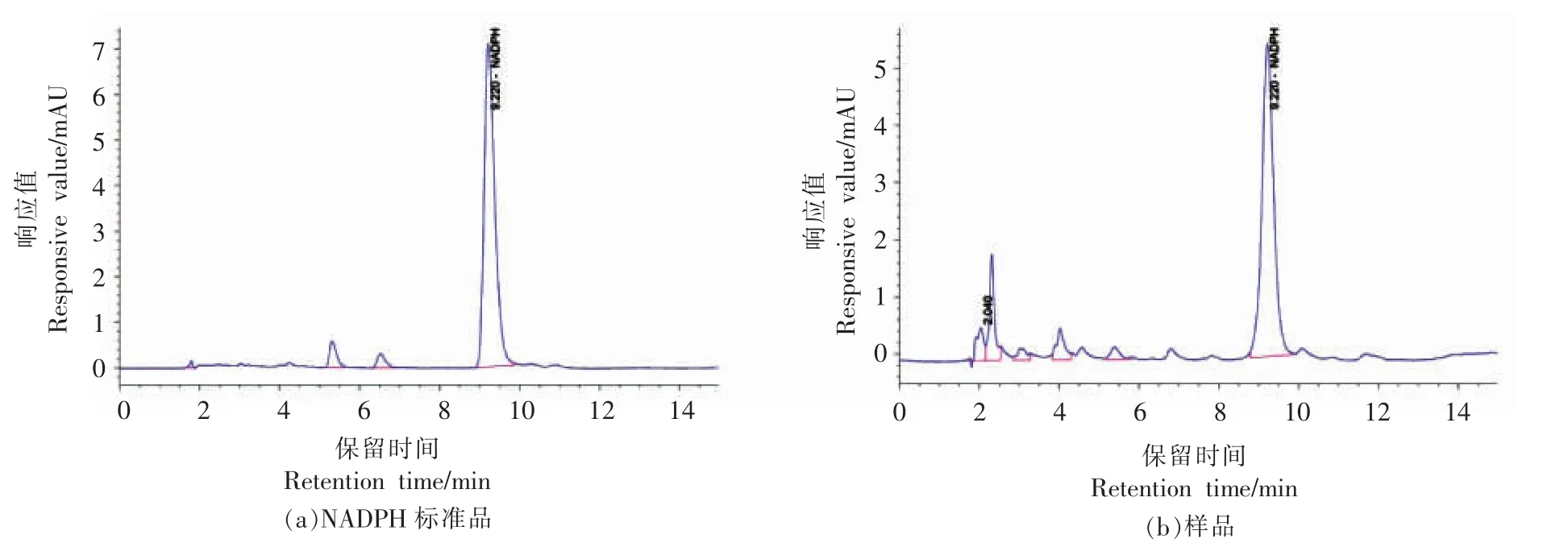
图6 标准品和样品中NADPH 的HPLC 检测图谱Fig.6 High performance liquid chromatogram of NADPH in standard and sample
2.5 IPTG 浓度对辅酶NADPH 再生的影响
由图7a 可知,IPTG 浓度在0.05~0.15 mmol/L之间,NADPH 产量变化不大,当发酵培养基体系中所含IPTG 浓度为0.15 mmol/L 时,辅酶NADPH产量达到最高,此时辅酶最高产量为81.05 μmol/L;然而随着IPTG 浓度的继续增大,辅酶产量下降明显,特别是IPTG 浓度为0.45 mmol/L 时,重组细胞遭到IPTG 毒性的影响,菌体生长受到抑制,生长量低,对重组工程菌株合成辅酶NADPH造成了严重的影响,故选择0.15 mmol/L 作为重组菌株的最佳IPTG 诱导浓度。
2.6 诱导温度对辅酶NADPH 再生的影响
由图7b 可知,不同诱导温度对辅酶NADPH产量产生了显著影响,随着诱导温度的升高,辅酶NADPH 产量显著上升,当诱导温度为24 ℃时,辅酶NADPH 产量最高,此时产量为115.93 μmol/L,然而随着诱导温度的继续上升,辅酶NADPH 产量呈现下降趋势,并且当诱导温度达到32 ℃时,HPLC 无法检测到辅酶NADPH,说明高温不利于重组工程菌中辅酶NADPH 的合成。综上,选择24 ℃作为重组大肠杆菌BL21/pETDuet-1-glk-zwf最佳诱导温度。
2.7 接种量对辅酶NADPH 再生的影响
接种量与重组菌株生长量有着密切关系,进而影响到NADPH 的再生。通过在发酵培养基体系中添加不同接种量,来探究接种量对辅酶NADPH 再生的影响,结果如图7c 所示。不同接种量对辅酶NADPH 产生了显著影响,辅酶NADPH再生产量随着接种量的逐渐升高而明显降低,当接种量为1%时,NADPH 产量达到最高(118.75 μmol/L),由此推断可能因为接种量过高导致初期菌体生长量过高,发酵培养基营养物质消耗过快,从而导致辅酶NADPH 产量不高。综上,选择1%为最佳接种量。
2.8 装液量对辅酶NADPH 再生的影响
装液量与发酵过程中的溶氧量有关,通过在同一发酵瓶中添加不同体积LB 发酵培养基,探究不同装液量对辅酶NADPH 再生的影响,结果如图7d 所示。不同装液量对辅酶NADPH 产生了显著影响,装液量过低,虽然摇瓶中溶氧量高,但是菌体生长过于旺盛,反而不利于目的产物的合成,此时辅酶产量只有27.20 μmol/L;当装液量为125 mL/250 mL,产量最高为136.15 μmol/L,而当摇瓶中装液量75 mL/250 mL 辅酶NADPH 产量可达134.67 μmol/L,两者辅酶NADPH 产量相差不大,考虑到生产成本,选择75 mL/250 mL 为最优装液量。

图7 表达条件对重组菌株产辅酶NADPH 的影响Fig.7 Effect of the expression condition on the production of coenzyme NADPH by recombinant strains
2.9 正交试验优化结果
分别选取了诱导温度、IPTG 浓度、接种量和装液量4 个因素的最佳取值范围,进行了9 个试验点的正交优化试验,对正交表L9(34)试验结果采用直观(极差)分析方法进行分析,结果如表3所示。

表3 正交试验设计优化的结果Table 3 Results of orthogonal experimental optimization

(续表3)
因素极差越大,对指标影响就越显著。由表3可以看出,诱导温度因素极差r 最大,表明诱导温度作为主要因素,对辅酶NADPH 产量的影响最显著,因此在重组菌株合成辅酶NADPH 的过程中应该合理控制诱导温度,应进行低温诱导。由表4方差分析同样可以看出,4 个因素对辅酶产量的影响程度大小为:诱导温度>装液量>接种量>IPTG 浓度;以4 个因素水平作为横坐标,以NADPH 产量作为纵坐标,绘制因素与指标趋势图,如图8所示。

表4 主体间效应的检验Table 4 Tests of between-subjects effects
从图8可以直观地看出,试验的最优组合为A1B3C3D3,即诱导温度20 ℃、IPTG 浓度0.25 mmol/L、接种量1.5%、装液量100 mL,对此组合进行3次平行验证试验,在此条件下,辅酶NADPH 的产量为139.57 μmol/L。

图8 4 因素与指标趋势图Fig.8 Graph of four factors and indicator trends
2.10 诱导时间对辅酶NADPH 再生的影响
诱导时间对辅酶NADPH 再生的影响如图9所示。在诱导时间0~48 h 范围内,辅酶NADPH 的产量随着诱导时间的增加而显著增加,最高产量为151.79 μmol/L,而在诱导时间超过48 h 以后,辅酶NADPH 的含量随着诱导时间的延长呈现出下降趋势,可能因为诱导时间越长,副产物代谢积累越多,加快营养物质的消耗,不利辅酶NADPH的合成。

图9 1 L 摇瓶中重组大肠杆菌产辅酶NADPH 的时间过程Fig.9 Time course of the production of coenzyme NADPH by recombinant E.coli in a 1 L shake flask
3 结论
本研究克隆了NADPH 再生的2 个关键酶基因即葡萄糖激酶基因(glk)与葡萄糖-6-磷酸脱氢酶基因(zwf),并将其导入到大肠杆菌BL21(DE3)中,成功构建了重组工程菌大肠杆菌BL21/pETDuet-1-glk-zwf,葡萄糖激酶与葡萄糖-6-磷酸脱氢酶均得到了可溶性表达,实现了辅酶NADPH 的高效再生。同时研究了IPTG 浓度、诱导温度、接种量、装液量对辅酶NADPH 再生的影响,其中诱导温度因素影响最为显著,通过正交设计优化试验,获得了重组工程菌株产辅酶NADPH 的最佳工艺条件:诱导温度20 ℃、IPTG 浓度0.25 mmol/L、接种量1.5%、装液量100 mL/250 mL。在此条件下进行3 次平行验证试验,辅酶NADPH 平均产量为139.57 μmol/L。随后研究重组菌株在最佳工艺条件下进行1 L 发酵摇瓶发酵产辅酶NADPH 的时间过程,经IPTG 诱导培养48 h 后,辅酶NADPH产量高达151.79 μmol/L。研究结果为辅酶NADPH循环再生产业化生产和应用提供了良好的理论基础。
——一道江苏高考题的奥秘解读和拓展

