苯甲酸对土壤反硝化过程氧化亚氮排放的影响
贾文慧,张新星,李睿琦,高志岭
(河北农业大学 资源与环境科学学院/河北省农田生态环境重点实验室,河北 保定 071000)
20 世纪,大气中N2O 的浓度增加了约20%,目前仍在以0.2% ~0.3% 的速率增加[1-2]。联合国气候变化专门委员会第四次评估报告表明[3],农业源贡献了全球N2O 排放量的60%。而在中国,农业源贡献了全国N2O 排放量的92.47%,其中农田施肥是农业源N2O 排放的主要来源,约占全国N2O 排放的73.96%[4]。土壤中反硝化过程是N2O 排放的主要途径,在不同的土壤环境中可导致25% ~90% 的氮肥损失。反硝化作用不仅会降低农田氮肥利用率,同时产生的氮氧化物对环境也有严重的负面影响。因此,抑制土壤反硝化过程、降低N2O 气体排放是降低环境污染风险、提高氮素利用率的有效途径[5-8]。
苯甲酸广泛存在于植物及畜禽粪便中[9-12]。在植物体内苯甲酸是物质合成及分解过程中的重要中间产物,可通过根系分泌及组织腐解进入土壤。苯甲酸常作为植物化感物质出现,影响植物的生长及生理性状。研究表明,随着外源添加苯甲酸浓度的增加,对穿心莲的生长、西瓜根细胞中氧化物酶(POD)活性及超氧化物歧化酶(SOD)活性由促进转为抑制;添加苯甲酸后会抑制西瓜及黄瓜叶片中硝酸还原酶的活性,降低黄瓜叶片叶绿素含量及西瓜叶片硝态氮含量[13]。苯甲酸除了具有影响植物生长及生理性状的作用外,对参与土壤氮循环转化的微生物的活性及功能也有一定的影响。研究表明,小麦秸秆腐解产生的苯甲酸对反硝化细菌枯草芽孢杆菌的生长与反硝化活性均有抑制作用[14]。此外,苯甲酸还是断奶仔猪、生长育肥猪的饲料添加剂。苯甲酸进入机体后,在肝脏内与甘氨酸结合形成马尿酸,之后随尿液中排出体外[11-12]。有研究表明[12],牧场尿斑会显著降低N2O 的排放,这可能是由于动物尿液中马尿酸分解产生的苯甲酸造成的。针对含有马尿酸及苯甲酸的合成尿液及尿液的研究证明了苯甲酸具有降低N2O 排放的能力,但在不同土壤条件下结果并不一致[15-17],目前尚未有直接的证据表明苯甲酸可通过影响反硝化过程从而抑制N2O 的排放。基于此,本研究探索了添加苯甲酸对于黄瓜大棚土壤N2O 的排放和土壤中普遍存在的反硝化细菌铜绿假单胞菌代谢活性的影响,旨在阐明苯甲酸在农田土壤N2O 排放控制中的作用。
1 材料与方法
1.1 试验材料
供试土壤:潮褐土取于保定市徐水区黄瓜大棚,取土深度为0 ~20 cm,所有土壤样品自然风干后过2 mm 筛,备用。供试土壤的容重为1.28 g/cm3,pH 为8.2, 有机质和全氮分别为20.36 和1.90 g/kg,NH4+-N 和NO3--N 的含量分别为41.76 和25.4 mg/kg。
供试药品:苯甲酸,LB 肉汤培养基。
供试菌株:铜绿假单胞菌Pseudomonas aeruginosa(ATCC13985,美国农业部菌种保存中心)。
1.2 试验设计
1.2.1 苯甲酸对铜绿假单胞菌厌氧代谢活性的影响
将甘油瓶中的铜绿假单胞菌接种到灭菌的LB肉汤培养基中,28 ℃下培养过夜,将处于指数生长期的细菌用9%的NaCl 水溶液重复洗涤3 次,之后加入50 mL 9%的NaCl 水溶液饥饿培养2 h,以耗竭自身养分。培养结束后离心,将菌体用LB 肉汤培养基稀释,并调整其OD600值到0.1。
代谢强度的测定在含有氧化还原染料氯化四唑的Biology MT2 96 孔板中进行[6-8],通过氧化还原染料变色程度判断细菌厌氧呼吸代谢活性强度。每孔中加入OD600为0.1 的菌液97 μL,并以2.5%的添加量将不同浓度的苯甲酸添加到96 孔板中,使各处理中苯甲酸终浓度分别为0.5、1、2、4 mmol/L,并以添加等量水的处理为空白对照(CK)。每个处理设置4 个重复孔。为创造反硝化过程发生的厌氧环境,在每孔中加入60 μL 矿物油覆盖。将MT2 平板置于28 ℃恒温培养箱中培养,每隔6 h 在酶标仪590 nm 下进行代谢强度的测定。
1.2.2 苯甲酸对土壤反硝化过程及N2O 排放的影响
(1)室内模拟试验采用静态箱法进行测定:试验装置为内径11 cm、高度20 cm、底部封底的PVC罐子。将过筛后的风干土填充至10 cm 深,将土壤含水量调节为85%土壤孔隙含水量(WFPS)。设置5个苯甲酸浓度,分别为0、1、2、4 和6 mmol/kg 干土。硝态氮用量折合田间施氮量约为200 kg/hm2。培养时罐子上覆盖透气保水的保鲜膜。每个处理15 个重复,其中3 个重复用于N2O 气体的动态取样,其余重复用土壤理化指标的测定。本试验在25 ℃下恒温模拟,每天通过称重补水以确保含水量恒定。
(2)N2O 采集与测定方法[18]:在整个培养周期内(18 d),于每天早上10:00—11:00 采集气体样品。采气时,密封盖与箱体连接,关闭箱体上的阀门,使箱体顶部形成1 个密闭的静态箱,通过开闭阀门采集N2O 样品。采集样品时用盖子密封箱体,封闭时间为30 min,分别在第0 和30 min 时用50 mL 注射器采集气体样品30 mL,注入10 mL 真空瓶。24 h 内利用气相色谱仪(Agilent 6820)测定气体样品的浓度。检测器为ECD,检测温度为330 ℃。
(3)土壤样品采集及测定方法:根据气体排放特征,分别于试验的第1 天、第4 天、第7 天、第13 天和第18 天对土壤进行破坏性取样,用于土壤pH 值、铵态氮、硝态氮及苯甲酸含量的测定。
(4)土壤NH4+-N 和NO3--N 测定:用2 mol/L的KCl 溶液以1∶5 的土液比将土壤和KCl 溶液进行混合,振荡1 h 后过滤,收集滤液。滤液使用化学分析仪(SmartChem200)测定NH4+-N 和NO3--N浓度。
(5)土壤苯甲酸含量测定[19]:称取5 g 样品置于30 mL 乙酸乙酯中,恒温30 ℃下160 r/min 振荡过夜。将振荡液离心,上清液在35 ℃下旋转蒸发至干,1.5 mL 色谱纯甲醇复溶,用0.2 μm 有机滤膜过滤后待测。使用安捷伦高效液相色谱进行测定苯甲酸含量,固体相色谱柱为Thermo C18(250*4.6 mm,5 μm)。乙腈和1%的冰乙酸按1∶3 比例混合组成流动相。样品检测时,上样量为10 μL,流速0.9 mL/min,样品分析过程中,保持柱温在25 ℃,检测波长230 nm。
1.3 计算方法与数理统计
1.3.1 计算方法
N2O 排放速率[18]:

式中:F为N2O 排放速率(mg/m2·h);dC/dt为观测时间箱内气体浓度随时间变化的直线斜率(mg/m3·h);H为箱体有效高度(m);T0为标准状态下空气的绝对温度(K);T实际空气温度(℃)。
N2O 累积排放量[18]:
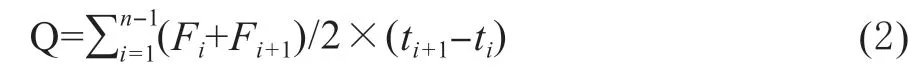
式中:Q 为试验期间N2O 排放总量(mg/m2);n为试验期间测定总次数;i为按时间排序的采样测定时间;Fi为第i次测定事件的N2O 排放速率(mg/m2·h);Fi+1为第i+1 次测定事件的N2O、NH3或CH4排放速率(mg/m2·h);ti+1为第i+1 次测定事件的时间(h);ti为第i次测定事件的时间(h)。
1.3.2 数理统计
采用Excel 2010 进行数据统计,并采用SPSS19.0对数据进行相关性分析,显著性差异分析采用Duncan 法。
2 结果与分析
2.1 苯甲酸对反硝化铜绿假单胞菌厌氧代谢活性的影响
铜绿假单胞菌广泛存在于土壤中,具有将NO3-N还原为N2O 的全套基因,对其厌氧代谢活性的影响可在一定程度上反映对土壤反硝化过程的影响。由图1 可知,各处理细菌厌氧代谢强度与细菌生长曲线趋势一致,均经历了平缓期、快速增长期及稳定期。在培养的0 ~12 h 内,添加苯甲酸的处理细菌厌氧代谢活性均显著低于CK 处理,且随着添加浓度的增加代谢强度抑制率增加,说明在培养初期苯甲酸的添加抑制了铜绿假单胞菌的生长,12 h 时苯甲酸对细菌代谢活性抑制作用最强,各处理抑制率分别达23.4%、39.2%、44.1% 及52.8%。12 h 后,CK处理细菌代谢活性增幅减慢,24 h 之后代谢强度稳定不变;从培养的第18 h 开始,添加苯甲酸对铜绿假单胞菌厌氧代谢活性的影响逐渐由抑制转为促进。

图1 苯甲酸对反硝化细菌厌氧代谢活性的影响Fig.1 Effect of benzoic acid on anaerobic metabolic activity of denitrifying bacteria
2.2 苯甲酸对土壤N2O 排放的影响
2.2.1 N2O 排放通量 由图2 可知,添加苯甲酸强烈影响土壤N2O 的排放,且各处理N2O 排放动态特征存在巨大差异。未添加苯甲酸的CK 处理N2O 排放呈先升高后降低的趋势。在培养的2 ~4 d,CK处理N2O 排放通量达到峰值2.21 ~2.38 mg/(m2·h),显著高于添加苯甲酸2、4 及6 mmol/kg 的处理,之后排放量在2 d 内迅速降低至趋近于0。添加苯甲酸1 mmol/kg 及2 mmol/kg 的处理在前5 d 内气体排放通量变化趋势与CK 处理一致,呈先升高后降低的趋势,并在培养的2 ~4 d 达到第一个峰值。培养5 d 后,添加苯甲酸1 mmol/kg 及2 mmol/kg 的处理N2O 排放量又逐渐升高,并分别在培养的第9 天及第7 天达到第二个峰值2.87 mg/(m2·h)及1.03 mg/(m2·h),之后排放量逐渐降低,分别在培养的第13 天及第9 天趋近于0。添加苯甲酸4 mmol/kg 及6 mmol/kg的处理N2O 排放均在培养的第二天达到峰值1.19 mg/(m2·h)及2.10 mg/(m2·h),之后逐渐降低,至培养的第7 天,排放量逐渐趋近于0。
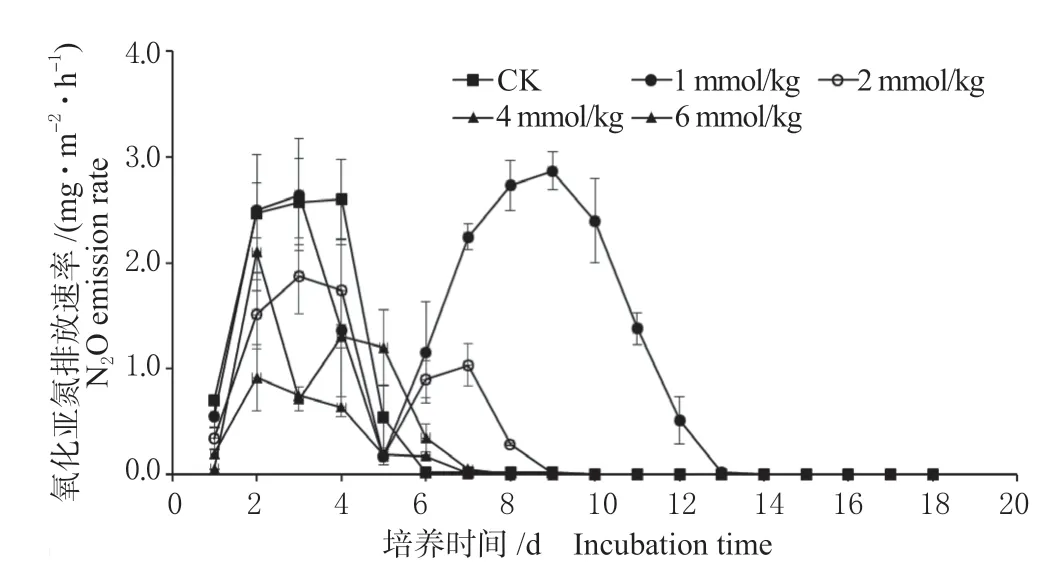
图2 不同浓度苯甲酸处理下N2O 排放速率Fig.2 N2O emission rate under different concentrations of benzoic acid treatment
2.2.2 N2O 累积排放量 培养期内各处理N2O 累积排放量见图3。由图3 可以看出N2O 累积排放量随苯甲酸添加量的增加呈先显著升高后显著降低的趋势。苯甲酸添加量为1 mmol/kg 的处理 N2O 累积排放量最高,达497 mg/m2,比空白对照CK 处理显著高1.36 倍;添加量为2 mmol/kg 的处理气体排放量显著低于添加量为1 mmol/kg 的处理,但与CK 相比无显著变化;与CK 相比,添加量为4 mmol/kg 及6 mmol/kg 处理的N2O 累积排放量分别显著下降了64.1%和43.0%。这表明低浓度苯甲酸可刺激N2O 的排放,但随着苯甲酸添加量的增加,对N2O 排放的作用由促进逐渐转为抑制。
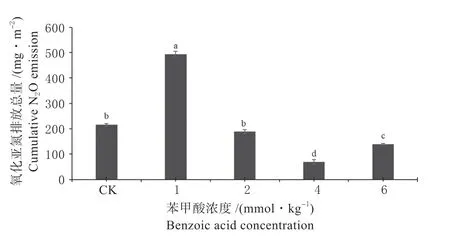
图3 不同浓度苯甲酸处理下N2O 累积排放量Fig.3 Cumulative emission of N2O under different concentrations of benzoic acid treatment
2.3 苯甲酸含量动态变化
苯甲酸可以作为碳源被某些微生物降解。由图4 可知,CK 处理未检测出苯甲酸浓度,表明风干土中苯甲酸含量在检测限以下;添加苯甲酸的处理,苯甲酸的含量随着培养的进行而降低,在第13 天时,添加苯甲酸1 mmol/kg 及2 mmol/kg 的处理苯甲酸含量趋近于0,培养结束时4 mmol/kg 及6 mmol/kg 的处理苯甲酸剩余量分别为0.050 g/kg及0.228 g/kg。
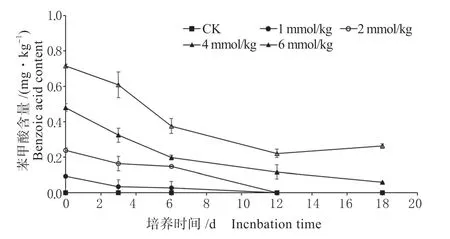
图4 苯甲酸含量动态变化Fig.4 Dynamic change of benzoic acid content
2.4 土壤pH 值动态变化
苯甲酸为有机酸,本身具有酸性,添加进土壤后会降低土壤pH 值,由图5 可知,试验开始时,与CK 处理相比添加苯甲酸的处理的土壤pH 值降低了0.27 ~0.59 个单位,随着培养的进行,苯甲酸逐渐分解,加上反硝化过程对H+的消耗,各处理土壤pH 逐渐回升至培养的第12 天后趋于稳定。
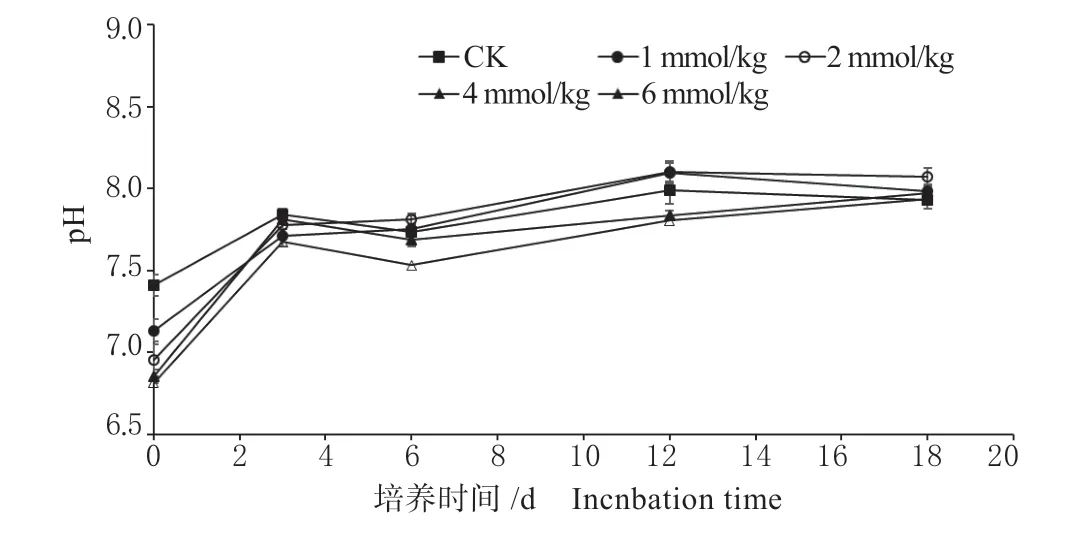
图5 不同浓度苯甲酸处理下土壤pH 值动态变化Fig.5 Dynamic changes of soil pH under different concentrations of benzoic acid
2.5 土壤硝态氮及铵态氮含量动态变化
2.5.1 土壤硝态氮含量动态变化 硝态氮是反硝化底物,硝态氮浓度的变化在一定程度上可反映反硝化进行的程度,由图6 可知,在试验的前4 d,添加苯甲酸的处理土壤中硝态氮的含量均显著高于空白对照处理(CK),添加苯甲酸的各处理间硝态氮降低速率表现为6 mmol/kg>2 mmol/kg>1 mmol/kg>4 mmol/kg,培养7 d 之后至培养结束,CK 处理硝态氮剩余量均显著高于添加苯甲酸的处理。

图6 土壤硝态氮含量动态变化Fig.6 Dynamic change of soil nitrate content
2.5.2 土壤铵态氮含量动态变化 图7 为土壤铵态氮含量变化趋势图。
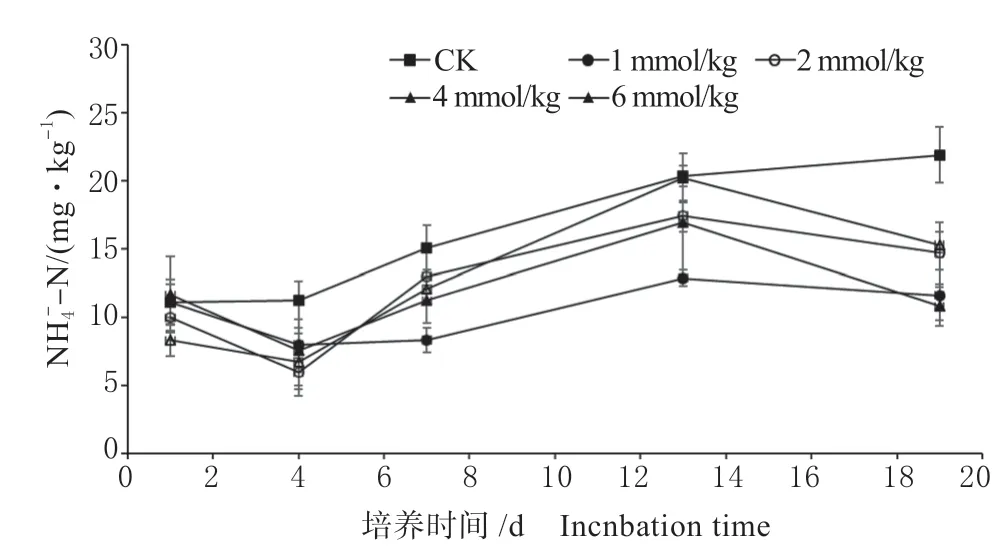
图7 土壤铵态氮含量动态变化Fig.7 Dynamic change of soil ammonium nitrogen content
由图可知,各处理铵态氮含量随着培养的进行均呈增加的趋势,且CK 处理铵态氮含量在培养的第4 天、第7 天、第13 天及第18 天均显著高于添加苯甲酸的处理(第13 天4 mmol/kg 及6 mmol/kg处理除外),添加苯甲酸的处理在培养前4 d 铵态氮的含量无显著差异,在第7 ~13 天,苯甲酸添加量为1 mmol/kg 的处理显著低于其余添加量的处理。
3 讨论
3.1 对细菌厌氧代谢强度的影响
在缺氧状态下,反硝化细菌以硝酸根离子为电子受体进行厌氧呼吸,因此厌氧代谢强度与细菌反硝化过程息息相关。本研究结果表明,在培养初期苯甲酸具有抑制细菌代谢强度的能力,且抑制效果具有剂量依赖性,随着培养时间的延长,添加苯甲酸的处理抑制作用逐渐降低并依据浓度由低到高依次由抑制作用转化为促进作用。造成上述现象的原因可能与培养初期培养系统内pH 值及细菌对苯甲酸的代谢有关。苯甲酸具有酸性,研究中设置的处理初始溶液pH 值随苯甲酸添加量的增加而降低,整体在5.8 ~7.0 范围内(未发表数据),而该细菌最适生长pH 范围为6.8 ~7.4[20]。初期较低的pH值抑制了铜绿假单胞菌的代谢生长,随着培养系统内反硝化过程的进行,氢离子消耗[21-22],添加苯甲酸浓度较高的处理pH 值逐渐回升到适宜细菌生长的范围,其代谢活性被刺激增强。
3.2 苯甲酸对土壤反硝化过程及N2O 排放的影响
本研究中,培养前期,添加苯甲酸处理的硝态氮明显高于CK,而在培养结束时,却显著低于CK处理,且添加苯甲酸处理间无显著差异,这可能是培养前期苯甲酸对反硝化过程抑制强烈,而后期由于降解或转化为苯甲酸盐,对土壤反硝化过程的影响减弱所致。
本研究还发现,与CK 处理相比苯甲酸添加量为1 mmol/kg 时显著促进土壤N2O 排放,≥4 mmol/kg时,N2O 排放量显著低于CK 及添加1 mmol/kg 的处理,这与前人研究苯甲酸浓度为3.9 mmol/kg 时N2O 排放被抑制的结果一致[16]。推测其原因能是:(1)添加低浓度苯甲酸时,由于土壤碱性组分和苯甲酸结合,引起苯甲酸的抑菌作用大幅下降和土壤pH 的降低,可能一定程度促进了反硝化过程和N2O 排放;而在添加高浓度时,强烈的抑菌作用可能超过pH 下降对反硝化过程的促进作用,因此导致N2O 排放下降。(2)土壤反硝化过程中N2O 的生成量受亚硝酸盐还原酶(Nir)、一氧化氮还原酶(Nor)及氧化亚氮还原酶(Nos)活性的影响,在消耗相同底物的前提下,Nos 活性越高时,N2O还原为N2的过程更强烈。Nos 相较于其余3 种酶结合电子的能力较弱,尤其是在供碳量不足的情况下[23]。研究表明,部分土壤反硝化细菌可以将低浓度苯甲酸作为碳源,因此不同土壤反硝化微生物对苯甲酸响应的差异可能是导致上述现象的原因之一。(3)此外,土壤中氮素的转化也会对N2O 的排放产生影响。例如,本研究发现培养期内土壤NH4+-N含量呈升高的趋势,推测可能是在缺氧条件下NO3-异化还原为NH4+,进而降低了N2O 产生的底物[24-25]。由此可见,还需进一步进行开展宏基因组研究,深入揭示苯甲酸对土壤氮素转化和N2O 排放的影响机制。
4 结论
通过外源添加苯甲酸进行了室内细菌及土壤纯培养试验,本研究研究发现:(1)土壤N2O 排放特征受苯甲酸添加量影响显著,其中在低浓度时呈现“双峰”、高浓度时呈“单峰”的特征;(2)苯甲酸对土壤N2O 累积排放量的影响表现为低浓度促进、高浓度抑制的特征;(3)苯甲酸对土壤NO3-转化表现为前期抑制、后期促进的特征,与其对典型反硝化细菌铜绿假单胞菌的影响特征相吻合。因此,合理应用苯甲酸具有降低土壤N2O 排放的潜力,但其适宜用量与N2O 减排机理仍需进一步研究。

