肺炎球菌结合疫苗的研究现状及前景
汪洋,向左云,任江伟,李珏希,黄镇
玉溪沃森生物技术有限公司,云南 玉溪 653100
肺炎球菌(Streptococcus pneumoniae,Spn)是导致儿童感染严重的肺炎、脑膜炎、菌血症等疾病,以及常见的急性中耳炎、鼻窦炎、支气管炎等疾病的主要病原体,也是导致我国儿童及成人高发病率和死亡率的重要原因。肺炎球菌感染是世界上最大的公共卫生问题之一。根据世界卫生组织(World Health Organization,WHO)2012年数据显示,全球每年约880万5岁及以下儿童死亡,其中约47.6万因肺炎球菌感染死亡[1],亚洲与非洲病例数最高,占66%;我国病例数位居全球第二,占12%,仅次于印度。在老年人中,免疫能力的降低直接关系到感染性疾病(如肺炎)发病率和死亡率的升高。在导致肺炎的病原体中,肺炎球菌是公认的主要病因[2]。当前许多国家在治疗肺炎球菌性疾病时仍广泛使用抗生素,但广泛使用、滥用抗生素导致肺炎球菌产生耐药性的问题愈发严重[3],因此,降低抗生素在治疗中的使用率,改用肺炎球菌疫苗预防肺炎球菌性疾病十分必要。本文对肺炎球菌的分子生物学和流行病学特征作一综述,阐明了肺炎球菌结合疫苗(pneumococcal conjugate vaccine,PCV)的研究历史和现状,并对PCV的研究前景进行了展望。
1 病原学
1.1 肺炎球菌生物学特性 肺炎球菌的排列方式通常呈短链状或双排列,革兰染色阳性,可在机体内形成荚膜,仅在含血液或血清的培养基中生长,最适生长条件为37.5℃,10% CO2,pH 7.4~7.8,属兼性厌氧菌,草绿溶血环。肺炎球菌对消毒剂较敏感,抵抗力弱,但抗干燥能力强。其细胞壁外被一层荚膜包裹,这层荚膜主要起保护作用,能够保护细菌细胞壁免受各种细菌侵害并保护细菌免受多核白细胞的吞噬和消化。
1.2 肺炎球菌的抗原及分型 肺炎球菌包含多种抗原,分别为荚膜多糖、C多糖、肺炎球菌溶血素、肺炎球菌表面蛋白A、肺炎球菌表面蛋白C及肺炎球菌表面黏附素A、神经氨酸酶、组氨酸三联体蛋白。其中,荚膜多糖抗原是致病的主要因素,依据荚膜多糖组成的不同,可将肺炎球菌分为多种不同血清型,至今发现的血清型约100种。目前国际上有两种血清分型系统,分别为美国血清分型系统和丹麦血清分型系统。美国血清分型系统是按照发现血清的次序对不同血清型命名,而丹麦血清分型系统则是基于不同型别菌株之间,C多糖与肺炎球菌引起的血清交叉反应分为不同血清群,并用数字表示,同一血清群中不同血清型在数字后用字母表示。
2 流行病学
肺炎球菌一般定植于人体上呼吸道鼻咽部,通过飞沫传播。肺炎球菌性肺炎是由带毒力的肺炎球菌被吸入损伤的下呼吸道内引起,下呼吸道感染是第四大死亡原因,但死亡病例总数已从2000年观察到的310万减少至2019年的260万[4]。肺炎球菌致病血清型的分布和感染流行病学因年龄不同、地理区域不同、季节差异和时间推移等因素一直呈动态变化。
在使用PCV前,全球70%以上儿童均患有6~11种血清型引起的侵袭性肺炎球菌病(invasive pneumococcal disease,IPD)[5]。侵袭性肺炎是指肺炎球菌穿过黏膜屏障侵入至人体内原本无菌的部位或组织,并引发炎症,如脑膜炎或化脓性关节炎等;但不包括鼻咽部细菌向邻近部位传播(如中耳)引发的感染。据统计,血清型1、5、6A、6B、14、19F和23F是导致儿童(5岁以下)患IPD最常见的病因。
在使用PCV7前,美国每年因肺炎球菌感染约导致17 000例5岁以下儿童罹患IPD、700例儿童罹患脑膜炎和200例患儿死亡,6~11月龄儿童IPD年发病率最高,为235/10万[6];2~4岁降至35.2/10万,5~17岁青少年发病率最低(3.9/10万)[7]。加拿大报道的各年龄段IPD发病率与美国相似,但最低龄儿童发病率相对较低,而6~17月龄儿童发病高峰可达161.2/10万[8]。欧洲7月龄至1岁幼儿感染程度最高,2岁以下儿童次之,之后至十几岁稳步下降[9-10]。但欧洲肺炎球菌感染发病率一般明显低于美国[11]。如20世纪90年代末,英格兰和威尔士6~11月龄婴儿IPD发病率为35.8/10万[12],而美国为235/10万;芬兰2岁以下儿童IPD发病率为45.3/10万,该差异在于美国经常对门诊患者进行血培养检测,而欧洲仅经常对住院患者进行血培养检测[13]。
美国使用PCV前因急性中耳炎就诊人数约1 500万 /年[14],费用约50亿美元 /年[15]。肺炎球菌感染是最常报告的中耳炎病因,公开数据显示,18%~55%中耳炎患者的中耳液中可检出肺炎球菌病原体[16]。
2005—2010和2011—2019年分别被视为(早期和晚期)PCV7时代和(早期、中期和晚期)PCV13时代。每个时期的疫苗覆盖率是根据东部(德语区)和西部(法语区/意大利语区)的全国性调查进行估算,有研究使用全国范围的IPD监测数据,对连续时期和地区间的报告发病率比率(incidence rate ratio,IRR)进行了比较。除5岁以下儿童外,所有年龄组非PCV型IPD发病率增加(IRR 2.59,95%CI 2.37~2.83),在PCV13时代晚期,所有年龄组总IPD发病率仅比PCV7时代早期低16%(IRR 0.83,95% CI 0.79~0.88)。瑞士儿童的PCV摄取率西部略高于东部(P<0.001),且西部地区所有年龄组IPD发病率均较低。瑞士两个地区PCV覆盖率的增加导致所有年龄组总体IPD发病率下降,且呈地区依赖性[17]。
肺炎球菌性疾病能够影响多个器官的功能,从而引起多种疾病综合征。肺炎球菌可暂时在鼻咽黏膜内定植,这也是主要的感染区,一般情况下不会引发疾病。但有些血清型会入侵血液,造成菌血症,损伤脑膜引起感染。当肺炎球菌从鼻咽部进入肺部会导致如中耳炎或鼻窦炎等疾病,如果肺炎还伴有菌血症则归类为侵袭性肺炎,IPD的发病率也常被作为严重肺炎球菌性疾病传播的指标。
男性比女性更易感染肺炎球菌[18-23],且肺炎球菌感染发病通常具有季节性高峰,冬天感染的可能性更大。据报道,感染流感病毒以及其他呼吸道病毒是发生严重肺炎球菌性肺炎[24]和侵袭性疾病[25]的危险因素。
缺少母乳喂养也与儿童IPD发病率增加相关[26]。除2岁以下儿童外,65岁以上老人和嗜烟酒人群感染肺炎球菌性疾病的病例数也在升高。除此之外,慢性病患者及身体免疫系统受损患者也易感染肺炎球菌性疾病。
部分地区采用抗生素治疗肺炎球菌性疾病,但已对常用抗生素如青霉素类、大环内酯类、头孢菌素产生了耐药性,因此推荐使用PCV以利于降低肺炎球菌耐药性的产生。
3 PCV
3.1 研发历史1880年,肺炎链球菌(也称为肺炎球菌)首次由法国微生物学家路易斯.巴斯德在狂犬病患者唾液中分离获得[27]。1911年首次开启对疫苗预防肺炎球菌疾病感染的研究,在南非对当地金矿工人进行了肺炎球菌疫苗的首次临床试验,但这些早期试验尚未发现肺炎球菌存在多种血清型及各种血清型肺炎球菌的重要性。1912年,肺炎球菌疫苗的研究有所进展,Rockefeller医学研究所鉴别出Ⅰ、Ⅱ和Ⅲ型3种肺炎球菌菌株。当科学家们使用制备的血清治疗不同种类肺炎球菌时,发现血清中的抗体仅与相应菌株匹配,不能与其他菌株产生作用。1918—1919年流感大流行,且当时一战爆发,导致肺炎发病率显著上升。由于军队需长途跋涉且长期聚集一起,导致肺炎球菌在军队中互相传播、感染,因此选择他们作为肺炎球菌疫苗的试验对象,结果显示,大叶性肺炎病例数减少了近30%。该结果证明了全细胞肺炎球菌疫苗的研发有了跨越性的进步。自此之后,1918—1919年全细胞疫苗在美国军队和南非矿工中被广泛使用。
但在初期试验中,初代肺炎球菌疫苗的保护期较短,仅2~3个月。随后Rockefeller医学研究所Avery和Dodds观察到某些肺炎球菌被一层多糖包围。他们对这一现象进行了研究,发现荚膜多糖是必不可少的毒性因素,同时也是肺炎球菌保护抗原。通过研究证实,荚膜多糖可用于制造疫苗,由此产生第二代肺炎球菌疫苗,即多糖疫苗。1945年,有研究证实了4价肺炎球菌多糖疫苗的保护效果[28]。1946年,施贵宝公司开发出适用于成人和儿童的6价肺炎球菌多糖疫苗。在这两种疫苗开发的同期,青霉素等各类抗生素也相继推出并用于治疗。由于抗生素药物在治疗初期对肺炎球菌性疾病具有显著效果,其迅速发展和大规模使用导致肺炎球菌多糖疫苗的研究发展滞后。
20世纪60年代后,科学家相继发现对青霉素中度耐药的肺炎球菌菌株,于是又开始进行肺炎球菌疫苗的研究。默克公司制备的14价肺炎球菌多糖疫苗在对9 000名南非金矿工人实施接种后,肺炎病例下降了50%,其安全性和有效性得到了证实,于1977年获批上市。之后在进一步监测肺炎球菌致病菌株的基础上,又研发出23价肺炎球菌多糖疫苗,1983年获批上市。1988年3月,WHO建议所有老年人和高危人群均应接种肺炎球菌多糖疫苗。
肺炎球菌多糖疫苗对2岁以下儿童几乎无效,甚至偶尔还会出现抑制人体对肺炎球菌进行免疫应答的情况。研究表明,结合疫苗可用于任何年龄段人群,接种效果也较多糖疫苗更长效持久,因此,多糖疫苗被结合疫苗替代成为肺炎球菌疫苗的发展趋势。2000年,PCV首次以PCV7的形式出现[29],疫苗采用7种最常见的血清型4、6B、9V、14、18C、19F和23F配型,使5岁及以下儿童肺炎球菌性疾病的发病率降低了75%以上[30]。2009年,葛兰素史克公司开发的PCV10(Synflorix;GlaxoSmithKline)在欧洲获批上市,除PCV7涵盖的7个共有血清型外,还包括血清型1、5和7F。PCV13(Prevnar13,辉瑞)于2009年获批上市,除PCV10涵盖的血清型外,还包括血清型3、6A和19A。23价肺炎球菌多糖疫苗(23-valent pneumococcal polysaccharide vaccine,PPV23)(PNEUMOVAX23,默克)涵盖PCV13常见的12种血清型1、3、4、5、6B、7F、9V、14、18C、19F、19A和23F以及11种其他血清型2、8、9N、10A、11A、12F、15B、17F、20、22F和33F[31]。新研制的PCV13使美国该年龄组IPD发病率又减少了64%[32]。然而,这些疫苗的保护具有血清型特异性,其广泛使用导致鼻咽部肺炎球菌的携带率和IPD中血清型发生变化。由于肺炎球菌疫苗提供血清型特异性保护,疫苗的有效性本质上取决于目标人群的血清型分布。因此,需监测肺炎球菌血清型来研制肺炎球菌疫苗并评估其有效性,才能发挥疫苗的最大功效[33]。
WHO估计肺炎球菌疫苗(PPV和PCV)的全球覆盖率为37%,截至2015年底,在129个国家实施[34]。截至2016年9月,已有132个国家(68%)将PCV引入常规婴儿免疫规划,另有6个国家(3.1%)在2016年将PCV引入国家免疫规划[35]。2019年年底,由玉溪沃森生物技术有限公司研制及生产的国产PCV13在我国获批上市,成为首款中国产PCV13。
不包含在PCV13中的7种血清型8、10A、11A、12F、15B、22F和33F,在成人中也会引起侵袭性和非侵袭性肺炎疾病。据估计,这些血清型在2017年导致美国成人9 900例IPD,44 000例住院患者和52 000例门诊患者肺炎,以及4300例死亡[36]。此外,这7种血清型在2017—2018年间约占德国≥60岁成人IPD病例的30%[37],在2019年分别占西班牙18~64岁和≥65岁成人IPD病例的50%和39%[38]。这些血清型还具有其他重要特征,如抗生素耐药性、与脑膜炎和/或更高死亡率的关联、侵袭潜力以及与疾病爆发的关联[39]。辉瑞公司研发的PCV20,将结合疫苗的保护范围扩大至PCV13以外,并在美国获批用于成人[40],该疫苗包含PCV13的组分(包括血清型1、3、4、5、6A、6B、7F、9V、14、18C、19A、19F和23F的多糖结合物)和血清型8、10A、11A、12F、15B、22F和33F的7种另外的多糖结合物,并分别在18~49和60~64岁成人中进行PCV20的Ⅰ和Ⅱ期临床研究。研究发现,PCV20引发了对所有20种疫苗血清型的强烈免疫反应,并具有与PCV13一致的安全性,这给Ⅲ期临床研究提供了支持[41]。作为疫苗Ⅲ期临床开发计划的一部分,美国食品药品监督管理局希望通过比较3个疫苗批次的免疫原性来证明生产一致性的临床评估,特别对于复杂的组合疫苗,如多价PCV[42]。该Ⅲ期研究评估了3个不同批次的PCV20的免疫反应,证明了其批间的一致性及安全性。
3.2 研发现状 婴儿是PCV的主要目标人群,因此,多数肺炎结合疫苗临床试验也重点观察各候选疫苗在婴幼儿中的免疫原性和安全性。目前国内获批上市的PCV为PCV13,生产厂家为玉溪沃森生物技术有限公司、美国辉瑞公司和北京民海生物技术有限公司。
玉溪沃森生物技术有限公司的PCV13于2019年获批上市,与其他公司的PCV13相比,疫苗接种年龄段覆盖广,2月龄(最小6周龄)婴幼儿 ~5岁(6周岁生日前)儿童均可接种且均能获得较好的保护效果。是将肺炎球菌1、3、4、5、6A、6B、7F、9V、14、18C、19A、19F和23F型分别经发酵、纯化获得荚膜多糖抗原,经活化、衍生后,与破伤风类毒素(tetanus toxoid,TT)载体蛋白结合形成多糖-蛋白结合物,按一定配比混合后,加入磷酸铝佐剂制成;有预充注射剂和西林瓶2种剂型。该疫苗在中国境内进行了Ⅰ和Ⅲ期两项临床试验,受试人数分别为120和2 760人。在临床试验中,自第1剂疫苗接种开始至每剂次接种后30 d,进行全身安全性观察,对大部分受试者至最后1剂接种后(全程接种后)180 d进行安全性观察。该疫苗采取经典乙醇沉淀技术与超滤技术结合纯化肺炎球菌多糖,确保了提纯中多糖结构的完整性;采用PBS缓冲体系,并应用耐受性好的TT载体蛋白,保证了疫苗的安全性和免疫活性。
辉瑞公司研发的PCV13(沛儿13)于2010年在美国获批上市,2016年引入国内,用于婴幼儿的主动免疫,以预防由肺炎球菌血清型1、3、4、5、6A、6B、7F、9V、14、18C、19A、19F和23F引起的IPD,在我国批准用于6周龄~15月龄婴幼儿。据WHO推荐,PCV13对婴幼儿IPD的保护效果可与效果已经获得证实的辉瑞沛儿(7价)结合疫苗相对照。在不同阶段的临床研究中还检测了6种新增血清型的免疫应答。日本、美国和德国的研究结果表明,辉瑞公司的PCV13在7种共同血清型的免疫应答方面与沛儿(7价)相似,而6种新增血清型的免疫应答则比沛儿(7价)显著增强。在美国,PCV13已被推荐用于具有潜在免疫缺陷的成年人,且最近被美国免疫实践咨询委员会(Advisory Committee on Immunization Practices,ACIP)推荐用于所有65岁及以上成年人。
北京民海生物技术有限公司研发的PCV13[TT/白喉类毒素(diphtheria toxoid,DT)]于2021年获批上市,适用于6周龄 ~5周岁婴幼儿及儿童。是将肺炎球菌1、5、6A、9V、19A、19F和23F型多糖分别与TT共价结合成多糖蛋白质结合物,肺炎球菌3、4、6B、7F、14和18C型多糖分别与白喉类毒素共价结合成多糖蛋白质结合物,再将13种多糖蛋白结合物按一定比例混合后与磷酸铝佐剂进行吸附制成。
全球范围内已上市及处在临床研究阶段的PCV见表1。
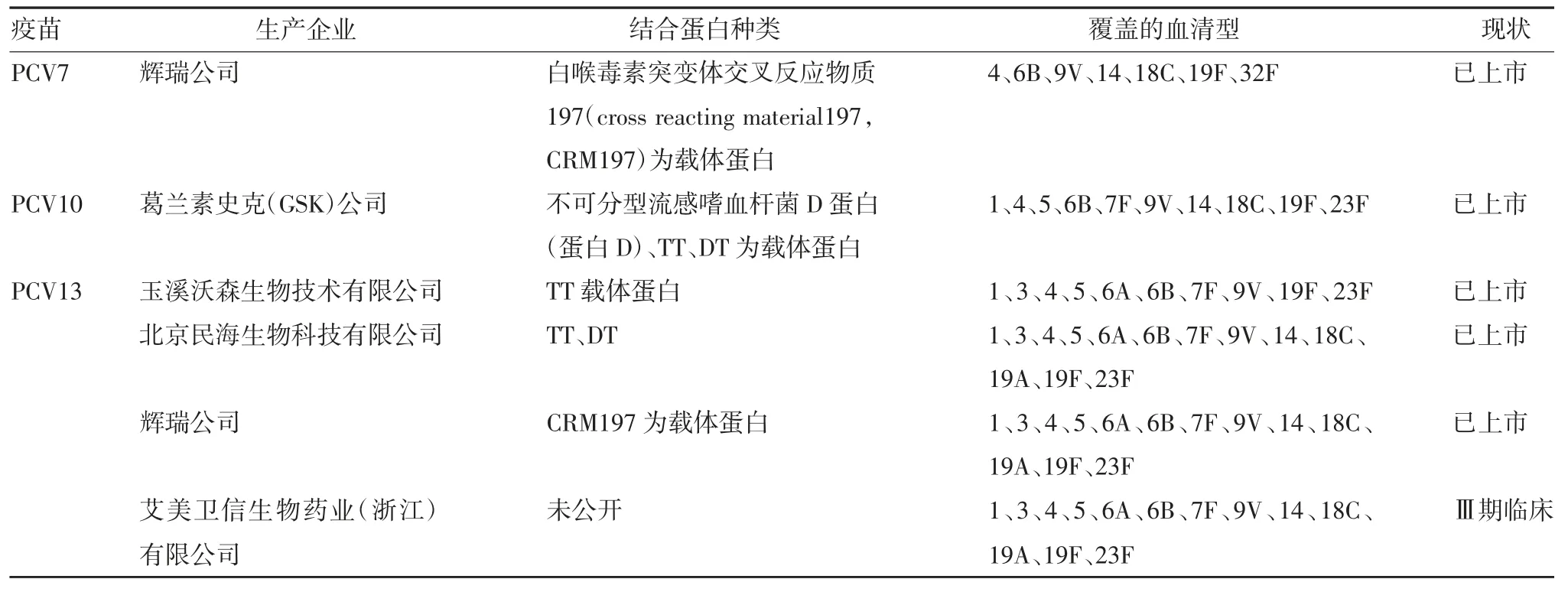
表1 已上市及临床研究阶段的PCVTab.1 PCVs in the market and clinical trial stage

续表1 已上市及临床研究阶段的PCVTab.1(Continued)PCVs in the market and clinical trial stage
4 小结及前景
PCV通过多年的发展及创新,已显著改善了全球肺炎球菌感染的现实状况,未来应从以下几个方面进行研究。
4.1 新一代疫苗的研发 肺炎球菌多糖疫苗为第二代肺炎疫苗,对于免疫系统尚未发育完全的低年龄段人群无保护性,因此,婴幼儿需使用PCV进行免疫。另外,现阶段老年人主要使用PPV23进行免疫,接种后保护性抗体水平可维持约5年。
PCV作为第三代肺炎球菌疫苗,其结合模式成功解决了使婴幼儿获得保护力的问题。20世纪80年代,美国率先开始进行PCV的研制。各公司在研制过程中借鉴了Hib结合疫苗成功研发的经验,根据荚膜多糖以及各自选用的蛋白载体的性质,在确保抗原及免疫原性等不受影响的前提下,选择不同的结合模式进行结合。PCV的制备工艺十分繁杂,涉及到发酵工程、免疫学、分析化学、蛋白质化学等学科领域,以及载体蛋白质、结合模式等环节因素。尽管PCV对婴幼儿等高危人群有较好的安全性及对侵袭性感染预防的有效性,但仍然存在以下几方面问题:①结合疫苗仅对该疫苗对应的血清型肺炎球菌感染具有保护作用。当前临床使用的疫苗配方覆盖了儿童中流行的75%~90%血清型,疫苗的有限血清型覆盖范围可导致非疫苗血清型替代性疾病发生,也会导致不同地区和不同年龄段人群间使用后效果存在显著差异;②结合疫苗生产工艺复杂,仅少数公司才能开发生产此类疫苗,导致疫苗价格昂贵,且产能难以跟上接种需求,阻碍了大规模临床使用。
为提高并加强结合疫苗的免疫原性,已通过动物试验来检测结合疫苗中的新组分以及新佐剂[43-55]。此外,还评价了新的接种途径,结果发现,使用各种佐剂进行鼻腔接种能够在小鼠中诱发很强的血清和黏膜抗体应答,并能保护小鼠抵抗致死性感染[56-58]。即使这些策略能够绕开结合疫苗的某些问题,但仍然不能解决疫苗覆盖率、替代疾病或疫苗生产复杂性的问题。因此,其他类型的免疫原(包括肺炎球菌全菌体疫苗、DNA疫苗和蛋白抗原)正作为新肺炎球菌候选疫苗来进行评价,这些新一代疫苗的开发有可能解决当下非疫苗血清型肺炎球菌流行率增加的问题[59-61],通过引起与特定血清型无关的免疫应答来实现对现有疫苗的补充。近年来,一种肺炎球菌全菌体疫苗被沃尔特里德陆军研究所成功研制出,美国开展了临床研究,来确认其安全性和免疫性。该疫苗生产成本较低,是患有肺部疾病免疫缺陷和染色体断裂儿童免疫的良好选择,还可减少肺炎球菌在鼻咽部的定植,将细菌密度维持在最低水平,有效防止新血清型的传播[62-64]。但肺炎球菌DNA疫苗的研发工作仍然受到限制,如在人体中与祼DNA有关的免疫原性问题。此外,将多种肺炎球菌蛋白质混合后制备成联合疫苗等研究也为新一代肺炎球菌疫苗的研制提供了新的方法。
4.2 疫苗佐剂的开发 佐剂是指添加至疫苗中以提高对抗原的免疫反应的成分。佐剂可根据不同的标准进行分组,如物理化学性质、来源和作用机制。佐剂在疫苗中的应用已近100年,近30年来针对新型佐剂技术的研发也在进行中,其中包括了佐剂系统。佐剂系统是将不同的免疫刺激物进行组合,与抗原协同,以期产生更高的效力。使用佐剂系统有可能减少单剂疫苗所需抗原的剂量,这对于应对疾病大流行、改善全球疫苗供应具有重要意义。在疫苗中添加佐剂也具较多优势,如减少每剂疫苗的抗原量和疫苗接种次数,在某些情况下,会增加抗原成分的稳定性,延长其半衰期并间接提高其免疫原性;添加佐剂对婴幼儿、老年人及免疫功能低下人群使用的疫苗特别有效,可改善其免疫反应;此外,佐剂对于通常太弱而无法单独刺激强大的免疫反应的亚单位疫苗特别有效。
对于PCV而言,结合的形式与蛋白载体的选择本身能够诱导机体产生较好的免疫反应,而佐剂的使用和优化能够增强抗原的稳定性。除1926年发现的铝佐剂(包括氢氧化铝和磷酸铝)外,截至目前,美国FDA批准的新型佐剂仅6种,分别为MF-59、AS01、AS03、AS04、CpG1018和Matrix-M,且均由国外企业生产。从功能上看,目前获批使用的佐剂,大致可分为两种:一种是刺激免疫应答的佐剂,通过与先天性免疫细胞上的受体连接,增强抗原的免疫原性,如CpG1018;另一种是配合疫苗递送的佐剂,将必要量的疫苗抗原和免疫刺激剂呈递给免疫系统以诱导免疫,如铝佐剂、乳剂。
目前国内外已获批上市的PCV均采用磷酸铝作为佐剂,未来在佐剂方面的研究期待有更多突破性的进展,为新型PCV的研发提供更多可能性。
4.3 肺炎结合疫苗的广泛使用 在大多数发展中国家,出生后第1年的免疫接种规划已包括约8~10次的疫苗注射,人们担心额外的注射可能会影响免疫接种规划的实施。为降低成本,近年来对疫苗组合的研究给予了较多关注。因此,疫苗制造商开发了不同的疫苗配方,将其他已获许可的疫苗与新抗原联合起来。
肺炎球菌疫苗的开发和上市是控制IPD的一个重大突破。但出于制造和生产成本的考虑,肺炎球菌多糖蛋白结合的一个主要限制是疫苗制剂中可包含的血清型的数量。为达到最佳效果,疫苗的组成将由特定地区流行的肺炎球菌血清型和目标人群决定。随着PCV不断研发成功上市,导致肺炎球菌疾病流行病学特征不断变化,这也是持续监测该疾病的原因。这种监测将提供关于抗生素耐药性趋势和潜在群体免疫的信息,可更全面地报告疫苗大规模使用后带来的相关健康事件。尽管目前已确认IPD的几个高危人群,但需要对疫苗在该人群中的疗效进行正式评估,以便优化其使用。高风险人群需进行加强免疫,最佳免疫程序是首先接种1剂PCV13,再接种1剂PPV23,但我国目前尚无批准用于老年人使用的PCV13。
就我国而言,在未来几年内,有必要使用血清学和分子生物学方法密切监测肺炎球菌的流行病学特征,积极开展我国全年龄段肺炎球菌感染血清型及疾病的动态监测,为推广PCV13的使用以及研发适合中国国情的新疫苗提供重要的病原菌流行病学依据[65]。期望将来研发出覆盖更多血清型的PCV,最终有效控制肺炎球菌性疾病对人类的威胁。

