柯萨奇病毒A组6型VP1与白喉毒素无毒突变体GRM197融合蛋白的原核表达及其免疫原性
沈钱通,李思奇,安彤,杨宏宏,张柯欣,陈刚,庄昉成,高孟
杭州医学院基础医学与法医学院,浙江 杭州 310053
手足口病(hand,foot and mouth disease,HFMD)是一种高发于3岁及3岁以下儿童的肠道传染病[1-2],在全球多个地区暴发和流行,我国大部分省份也有相关流行报道,且病例数呈逐年上升趋势,因此我国于2008年将该传染病列为法定丙类传染病[3]。早期,肠道病毒71型(enterovirus 71,EV71)和柯萨奇病毒A组16型(coxsackievirus A16,CVA16)是HFMD的主要病原体[4-5];近年,非EV71和非CVA16的其他肠道病毒阳性比例逐渐升高,柯萨奇病毒A组6型(coxsackievirus A6,CVA6)成为HFMD暴发的另一个主要病原体[6-7],因此开展CVA6疫苗的研发十分必要。
CVA6是一种单股正链RNA病毒,其衣壳蛋白由4个亚单位组成,其中VP1蛋白暴露于病毒表面,上面分布病毒的主要抗原表位,是重组疫苗的理想靶抗原[8-9]。单独使用CVA6 VP1蛋白在机体内产生的保护性免疫水平较低,需借助佐剂或其他分子来提高蛋白的免疫原性[10]。CRM197是一种白喉毒素的无毒突变体,已作为免疫佐剂分子应用于疫苗领域,具有良好的安全性[11]。因此,本研究以CRM197作为佐剂,制备CVA6 VP1蛋白与CRM197的融合蛋白,并评价其免疫原性,以期为后续相关疫苗的研发奠定基础。
1 材料与方法
1.1 载体、毒株、菌株及细胞pET-28a、CVA6 XS-45株(GenBank登录号:MH536772.1)、E.coil BL21(DE3)及人恶性胚胎横纹瘤肌肉瘤细胞(RD)均由浙江省医学生物工程疫苗研发重点实验室保存。
1.2 主要试剂及仪器 双色预染蛋白marker购自上海雅酶生物科技有限公司;限制性内切酶和蛋白质marker均购自美国赛默飞世尔科技公司;无缝克隆试剂盒、鼠源his标签单克隆抗体及HRP标记的羊抗鼠lgG购自北京康为世纪生物科技有限公司,DNA marker购自上海捷瑞生物工程有限公司;重组蛋白CVA6 VP1由浙江省医学生物工程疫苗研发重点实验室制备;Ni-NTA亲和层析介质购自英国Amersham Biosciences公司;96孔黑色平底微孔板购自美国康宁公司;Zetasizer激光粒度仪购自英国MalvernPanalytical公司;多功能酶标仪SpectraMaxiD3购自美国MolecularDevices公司。
1.3 实验动物SPF级长爪沙鼠,雌性,4周龄,体重20~22 g,购自北京维通利华实验动物技术有限公司,动物合格证号为:202100325Abbb0100018367。本实验对长爪沙鼠的所有处理均以科研为目的进行养殖和使用,且按照实验动物管理条例中的相关规定进行。
1.4 重组质粒的构建 将GenBank中登录的CRM197蛋白(1007216A)催化结构域A(aa1-191)与CVA6(MH536772.1)的VP1间通过GGGGS进行连接,所得重组融合蛋白命名为CRM197A-CVA6 VP1。以CRM197A-CVA6 VP1的氨基酸序列为模板,用DNA-works软件进行表达基因的密码子优化,优化后的基因序列由中美泰和生物技术(北京)有限公司进行合成,所得基因经NcoⅠ及XhoⅠ限制性内切酶酶切后,插入至经相同酶酶切的载体pET-28a,获得的质粒送北京擎科生物科技有限公司杭州分公司测序,将测序正确的重组表达质粒命名为pET-28a-CRM197ACVA6 VP1。
1.5 重组蛋白的诱导表达 将重组表达质粒pET28a-CRM197A-CVA6 VP1通过热激活法转化至E.coil BL21(DE3),涂布于含5 μg/mL卡那霉素的LB固体培养基中,37℃培养过夜;挑取单菌落,接种于5 mL含5 μg/mL卡那霉素的LB液体培养基,37℃摇床振荡培养过夜;将菌液按1∶100加至含5 μg/mL卡那霉素的LB液体培养基中,继续培养至A600为0.6,加入IPTG至终浓度为1 mmol/L,37℃诱导表达4 h;10 000×g离心15 min,收集菌液,诱导前后菌液均经12%SDS-PAGE及Western blot检测。将诱导前及诱导后菌液经12% SDS-PAGE分离蛋白后,电转移至PVDF膜,用5%脱脂奶粉室温封闭1 h;加入鼠源his标签单克隆抗体(1∶3 000稀释),4℃孵育过夜;PBST洗涤5次,每次5 min,加入HRP标记的羊抗鼠lgG(1∶5 000稀释),37℃孵育1 h;PBST洗涤5次,每次5 min,化学发光法显色并曝光。
1.6 重组蛋白的纯化 用Tris缓冲液(20 mmol/L Tris,500 mmol/L NaCl,pH 7.8)重悬菌体,冰水浴中超声破碎,10 000×g离心15 min,收集沉淀,获得包涵体蛋白;包涵体用溶解液(50 mmol/L Tris,500 mmol/L NaCl,8 mmol/L尿素,50 mmol/L咪唑,pH 7.7)完全溶解后,经Ni-NTA亲和层析纯化,纯化蛋白经12% SDS-PAGE分析。纯化蛋白置于10 kD透析袋中,用透析液(20 mmol/L甘氨酸,1 mmol/L EDTA,5%甘油,pH 9.1)进行透析复性,所得复性蛋白经过滤除菌,即为重组蛋白CRM197ACVA6 VP1,经12% SDS-PAGE分析及粒径、电位、荧光光谱检测。
1.6.1 粒径及电位检测 取1 mL复性后蛋白,于室温平衡5 min,用Zetasizer激光粒度仪在动态光散射下通过测量悬浮体系中颗粒的布朗运动信息,经Zetasizer软件计算蛋白粒径;再利用激光多普勒效应测量带电粒子电泳运动速度,并根据亨利方程通过电泳速度得到检测蛋白的Zeta电位。
1.6.2 荧光光谱检测 取600 μL复性后蛋白,室温静置10 min,加入96孔黑色平底微孔板中,200 μL/孔,设3个复孔,用多功能酶标仪Spectra-MaxiD3中的化学发光模块(Lum),于280 nm激发光下,扫描300~400 nm范围内的最大发射波长。
1.7 重组蛋白免疫原性检测
1.7.1 动物分组及给药 经沙鼠腹腔注射铝佐剂吸附的重组蛋白CRM197A-CVA6 VP1,20 μg/(只·0.5 mL),同时设对照组(注射等体积的铝佐剂),10只 /组。1周后进行加强免疫,免疫途径及剂量同初次免疫。初次免疫后4周,经沙鼠眼眶采血,分离血清。
1.7.2 结合抗体效价的检测 用重组蛋白CVA6 VP1包被96孔板,于4℃封闭过夜;将沙鼠血清进行倍比稀释(1∶100~1∶102 400),加入96孔板,100 μL/孔,同时以血清稀释液(含1% BSA的PBS)作为阴性对照,37℃孵育1 h;用PBST洗涤5次,加入HRP标记的羊抗沙鼠IgG(1∶20 000),37℃孵育30 min;用PBST洗涤5次,加入TMB显色液显色,用酶标仪检测A450。以阴性对照孔平均A450的2.1倍为阈值,大于该阈值的最大稀释倍数为血清结合抗体效价。
1.7.3 中和抗体效价的检测 采用细胞微量中和法。将RD细胞按1×105个/孔加入96孔板,37℃培养至长满单层。将沙鼠血清进行倍比稀释(1∶8~1∶256),分别与100 TCID50CVA6等体积混合,37℃孵育2 h;将混合物加至96孔板中,100 μL/孔,各稀释度均设6个复孔,同时设细胞对照组(未加病毒)及病毒对照组(未加小鼠血清),于35℃,5% CO2培养箱中培养7 d,显微镜下连续观察细胞病变情况,待病变稳定后,按Reed-Muench公式法计算血清中抗体效价[12]。
1.8 重组蛋白的免疫保护效力的检测 将沙鼠按1.7.1项进行分组及给药,于初次免疫后4周,经沙鼠腹腔接种CVA6病毒液,1×104TCID50/只,连续观察15 d沙鼠的存活情况。
1.9 统计学分析 应用SSPS 19.0软件进行统计学分析,数据采用均值 ±标准差()表示,组间比较采用配对t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 重组质粒的鉴定 重组表达质粒pET-28a-CRM197A-CVA6 VP1测序结果与目的碱基序列相同,表明重组质粒构建正确。
2.2 表达产物的鉴定
2.2.1 SDS-PAGE分析 诱导后菌液经12%SDSPAGE分析,于相对分子质量约55 700处可见目的蛋白条带,大小与预期相符,诱导前菌液未见该蛋白条带,见图1。

图1 诱导前后菌液的SDS-PAGE分析Fig.1 SDS-PAGE profile of bacterial liquid before and after inducation
2.2.2 Western blot分析 诱导后菌液可与his标签抗体发生特异性反应,于相对分子质量约55 700处可见特异性结合条带,大小与预期相符,见图2。
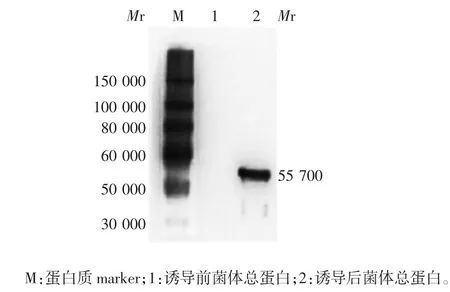
图2 诱导前后菌液的Western blot检测Fig.2 Western blotting of bacterial liquid before and after induction
2.3 纯化产物的鉴定
2.3.1 SDS-PAGE分析 纯化重组蛋白的相对分子质量约55 700,主要以包涵体形式存在,纯度为14.5%;纯化蛋白经透析复性后,于相对分子质量约55 700处可见目的蛋白条带,纯度提高至88.3%。见图3。
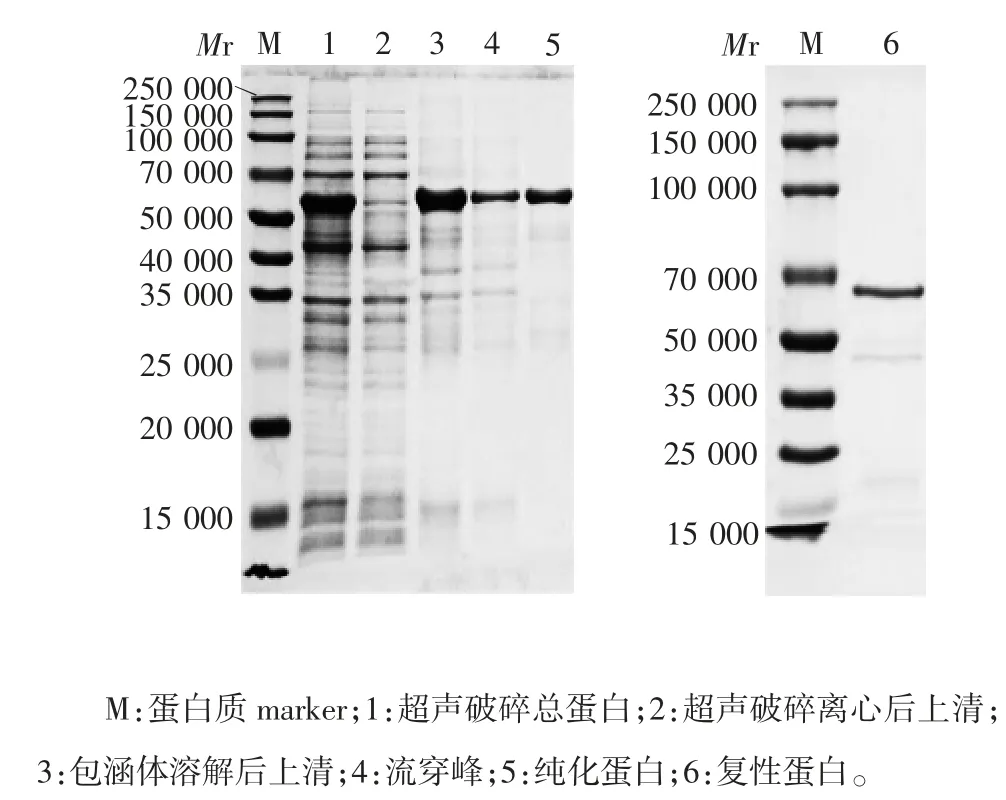
图3 纯化重组蛋白CRM197-CVA6 VP1的SDS-PAGE分析Fig.3 SDS-PAGE profile of recombinant protein CRM197ACVA6 VP1
2.3.2 粒径及电位 重组蛋白粒径大小为81.16 nm,目的蛋白占比100%,表明蛋白复性折叠完全且蛋白溶液内无其他大颗粒杂质;重组蛋白电位为23.12 mV。
2.3.3 荧光光谱 荧光光谱结果显示,重组蛋白经280 nm激发,检测到最大发射波长为353 nm。
2.4 重组蛋白的免疫原性 试验组及对照组沙鼠血清中结合抗体效价的几何平均数分别为44 565和0,中和抗体效价的几何平均数分别为30.4和0,两组间结合抗体效价和中和抗体效价的几何平均数差异均有统计学意义(t分别为3.65和6.96,P<0.05)。
2.5 重组蛋白的免疫保护效力 对照组沙鼠于攻毒后第3天开始出现死亡,第13天全部死亡;试验组沙鼠在攻毒过程中未发生死亡,保护率达100%。见图4。

图4 各组沙鼠的存活情况Fig.4 Survivals of gerbils in various groups
3 讨论
随着HFMD病原谱的变化,CVA6疫苗的研发对该疾病的防控具有十分重要的意义。常规的HFMD疫苗主要是通过灭活人工培养的病毒来制备[13],该制备方式由于涉及生产用基质细胞的培养,成本较高,产能也受到较大限制。以CVA6的衣壳蛋白为靶抗原开发亚单位疫苗可有效提高疫苗的产能,降低成本[14],但单纯亚单位疫苗的免疫效力较差。前期研究以单独的CVA6蛋白作为抗原免疫沙鼠,所产生的中和抗体水平仅为4.44,且在攻毒保护试验中结果也不理想[10]。因此,需借助其他佐剂分子来提高疫苗的免疫效果。CRM197主要作为载体蛋白应用于结合疫苗,也可将其与目的蛋白融合表达以提高蛋白免疫原性。李琼等[15]将CRM197全长或截短的片段与流感病毒胞外区蛋白M2e融合表达,获得的融合蛋白可显著增强M2e的免疫原性,并在动物实验中诱导产生高滴度抗体。ZHANG等[16]将CRM197片段A与HIV病毒中的4E10表位融合,发现CRM197A-4E10融合蛋白可在小鼠体内诱发人免疫缺陷病毒(human immunodeficiency virus,HIV)特异性抗体应答,同时具有更广泛的中和活性。本研究将CRM197A作为载体蛋白与CV-A6 VP1蛋白进行融合表达,获得的重组蛋白可在沙鼠体内产生较高免疫原性,中和抗体水平几何平均数达30.4,并具有良好的主动免疫保护,保护率达100%。
综上所述,本实验采用E. coli 原核表达系统对CVA6 VP1 及CRM197A 进行了融合表达,且具有良好的免疫原性,后续将在本研究的基础上对CRM197ACVA6 VP1 重组蛋白的细胞免疫及免疫持久性进行进一步研究。

