基于表面等离子共振技术检测免疫球蛋白G与Fc段受体结合活性
陈莹莹 丁 黎
中国药科大学药学院,江苏南京 211198
单克隆抗体药物因高特异性、低副作用和作用机制明确等优点,被广泛应用于肿瘤、自身免疫性疾病和传染性疾病的治疗,是当下的研究热点。截至2021年12月,美国食品药品监督管理局(Food and Drug Administration,FDA)已批准了83款传统单克隆抗体新药,其中大部分已获批的单克隆抗体药物类型为免疫球蛋白G(immunoglobulin G,IgG)[1-2]。IgG由两条相同的重链和两条相同的轻链组成,在木瓜蛋白酶的作用下IgG可被降解为三个片段,即两个抗原结合片段(antigen-binding fragment,Fab)和一个可结晶(crystallizable fragment,Fc)段[3]。其中IgG与Fc段受体的结合与多种生物学功能相关,分析IgG与Fc段受体的相互作用是单克隆抗体药物质量控制中重要组成部分。目前,常用于检测IgG与Fc段受体结合活性的方法为表面等离子共振(surface plasmon resonance,SPR)技术,其已被中华人民共和国药典(2020版)、美国药典(2016版)和日本药典(2016版)收录[4]。本文综述基于SPR技术检测IgG与Fc段受体结合活性的方法,并总结不同方法结果之间的差异和可能引起这些差异的原因,以期为基于SPR技术的方法开发和应用提供一些思路。
1 SPR技术
SPR技术是一种光学检测技术。当一束光以一定角度和波长射入金属表面时,形成的消逝波会和等离子波产生共振,此时反射光的能量大大减弱,当反射光完全消失时,对应的入射角被称为共振角[5]。共振角与金属表面结合的分子质量相关,表面等离子共振技术利用这一原理,通过分析共振角的变化实现对分子相互作用的检测。
1990年,Pharmacia Biosensor AB公司(现为Cytiva公司)发布了第一台商业化SPR仪器—Biacore。在过去的30年里,Biacore在商业化SPR仪器中一直处于领先位置。根据完整的实验传感曲线,可将实验步骤分为5个阶段:固定配体;分析物与配体结合;分析物与配体解离;芯片再生;数据分析。
与传统检测分子相互作用方法相比,SPR技术具有操作简单、耗时短、灵敏度高、可以无标记地实时测量动力学数据等优点[6]。不过,SPR技术也存在一定的局限性。首先,将配体固定在芯片上时,无法确定配体的方向,可能会增加后续配体与分析物结合的位阻效应;第二,一些分析物与芯片表面存在非特异性结合;第三,分析物与配体的结合可能会受到物质迁移限制的影响。
2 基于SPR技术检测IgG与Fc段受体结合活性
2.1 基于SPR技术检测IgG与Fcγ受体(Fcγ receptors,FcγRs)的结合活性
2.1.1 FcγRs FcγRs是一类能与IgG Fc段特异性结合的细胞表面蛋白,IgG与之结合后,可激活免疫细胞,发挥抗体依赖的细胞介导的细胞毒性作用(antibody-dependent cell-mediated cytotoxicity,ADCC)和抗体依赖的细胞介导的吞噬作用(antibody dependent cellular phagocytosis,ADCP),达到杀伤靶细胞的作用[3]。FcγRs与IgG的铰链区与CH2结构域交界处结合,结合比例为1∶1[3]。FcγRs被细分为三大类:FcγⅠ型受体(Fcγreceptor Ⅰ,FcγRⅠ)、FcγⅡ型受体(FcγreceptorⅡ,FcγRⅡ)、FcγⅢ型受体(FcγreceptorⅢ,FcγRⅢ)。FcγRⅠ与IgG1的 结 合 亲 和 力 最 高。FcγRⅡ分 为FcγRⅡa、FcγRⅡb、FcγRⅡc三个亚型[3]。其中,FcγRⅡb是目前已知唯一抑制性受体,其被激活后限制或抑制细胞的相应功能,调控免疫应答[7]。FcγRⅢ分为FcγRⅢa和FcγRⅢb两种亚型[3]。FcγRs在人体内存在高度基因多态性,一些FcγRs基因多态性如FcγRⅢav158和FcγRⅢaf158对抗体治疗效果存在显著的影响[8]。因此在检测IgG与FcγRs结合活性时需要考虑受体基因多态性。
2.1.2 基于SPR技术检测IgG与FcγRs结合活性研究人员开发了多种检测IgG与FcγRs结合活性的方法。氨基偶联策略是最简单的固定配体方法,其通过共价偶联蛋白赖氨酸残基和多肽链N端的伯氨基,因此该方法无法确定配体被固定的方向[9]。目前,氨基偶联策略可能带来的问题可以通过间接捕获的方式避免。间接捕获方法通过芯片表面的捕获蛋白(如Anti-His抗体、链霉亲和素、Protein A)捕获带有对应标签的配体。不过,研究人员发现使用Anti-His抗体捕获配体时,最终传感曲线达到平衡后存在向下飘移现象[10]。除了表内列举的四种常用的固定配体策略,Cambay等[11]开发了以合成多肽Kcoil为捕获分子定向捕获Ecoiled-FcγRs的方法,与Anti-His抗体捕获策略和链霉亲和素捕获策略相比,该方法显示出更好的稳定性和重复性。见表1。
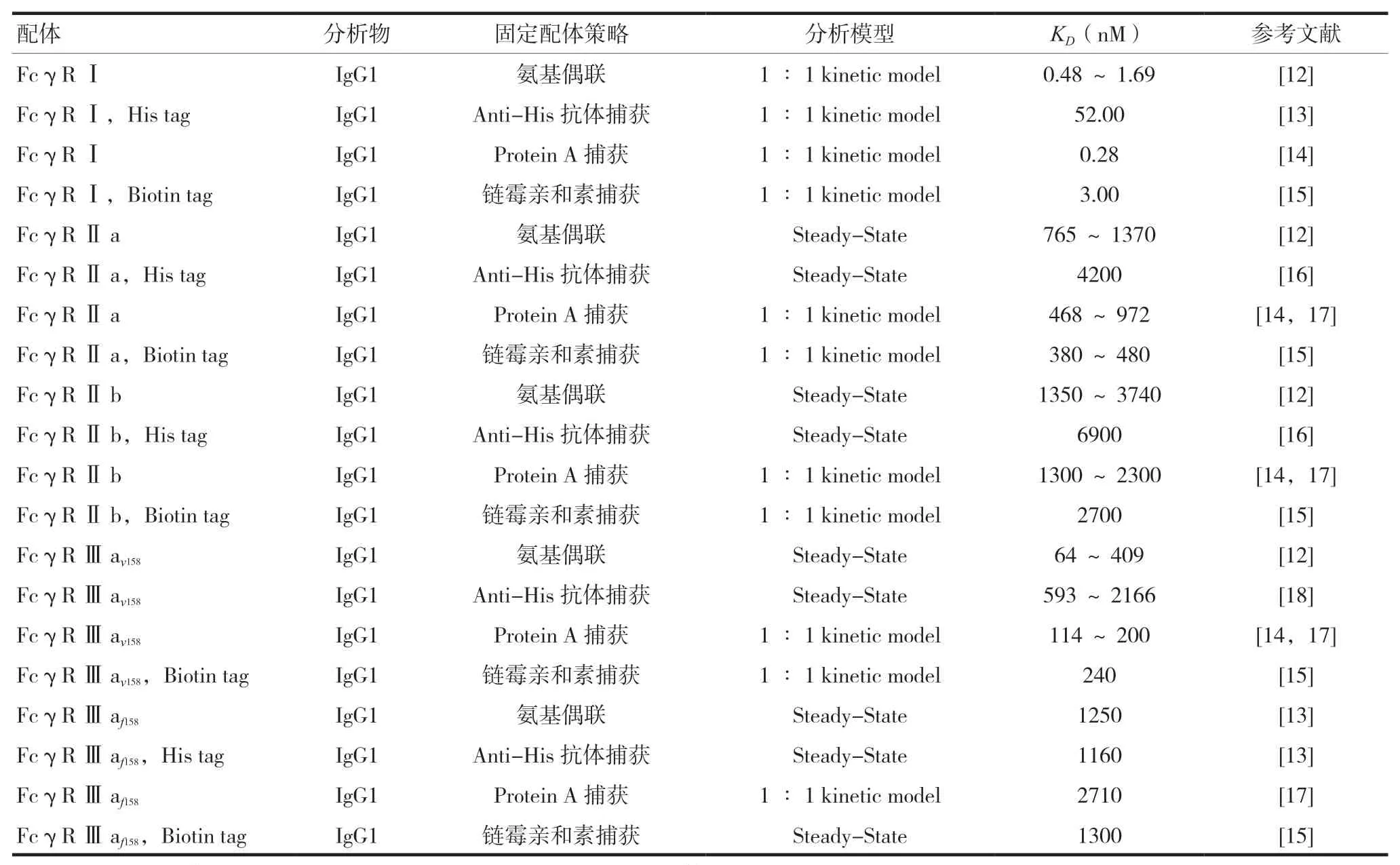
表1 基于SPR技术检测IgG与FcγRs结合活性
2.2 基于SPR技术检测IgG与新生儿Fc受体(neonatal Fc receptor,FcRn)结合活性
2.2.1 FcRn FcRn是一种与IgG半衰期密切相关的细胞表面蛋白,表达范围广泛。FcRn与IgG的结合位点位于CH2与CH3结构域的交界处,结合比例为2∶1[3,19]。相关研究表明,IgG与FcRn的结合亲和力与IgG的半衰期之间存在相关性,因此研究IgG与FcRn的结合亲和力对预估单克隆抗体药物的药代动力学有重要意义[20]。
2.2.2 基于SPR技术检测IgG与FcRn结合活性目前主要有三种实验方式检测IgG与FcRn的亲和力。Wang等[21]通过实验指出方法二可以更灵敏地反映电荷分布对IgG与FcRn相互作用的影响。目前,三种方法的结果都可被接受,但不可忽略不同的实验方法的差异,也无法直接比较通过不同方法测得的亲和力得出IgG与FcRn的结合活性差异。见表2。

表2 基于SPR技术检测IgG与FcRn结合活性
2.3 基于SPR技术检测IgG与补体1q(complement 1q,C1q)结合活性
2.3.1 C1q C1q参与补体系统经典途径的激活,C1q与抗体Fc段暴露的补体位点结合后,启动补体蛋白的蛋白分解级联,释放过敏毒素,并在靶细胞表面形成膜攻击复合物,发挥补体依赖的细胞毒作用(complement dependent cytotoxicity,CDC)[3]。研究表明,在单克隆抗体靶向肿瘤细胞的治疗中,抗体介导的CDC效应发挥了重要作用[25]。C1q与IgG的结合位点位于CH2结构域,结合比例为1∶6[26]。在生理条件下,C1q与在细胞膜表面形成的IgG六聚体结合从而激活经典途径,但IgG单体与C1q的结合力很弱[27]。因此在溶液中检测C1q与IgG结合活性时,需要关注实验条件下C1q与IgG结合比例。
2.3.2 基于SPR技术检测IgG与C1q结合活性目前已报道的基于SPR技术分析IgG与C1q结合活性方法比较少。Patel等[28]设计并比较了四种IgG捕获蛋白(protein A、protein G、protein A/G、protein L)检测IgG与C1q结合活性方法,最终选择protein L为捕获蛋白,检测了四种IgG亚型与C1q的亲和力。Jovic等[29]在此基础上,开发并验证了一种筛选IgG的方法,接着使用此方法比较了一系列工程化改造IgG并获得与细胞实验一致的结果。目前基于SPR技术检测IgG与C1q结合活性存在一些挑战。首先,由于IgG与C1q相互作用机制比较复杂,无法确定芯片上IgG与C1q的结合比例。其次,由于C1q蛋白结构复杂且存在大量带电残基,常常与芯片存在非特异性结合。
3 总结
综上所述,由于IgG与Fc段受体相互作用的复杂性,设计相关实验方法时需要注意固定配体策略、分析物流速、缓冲液等因素,最终得到的传感曲线应当尽可能符合简单的数据分析模型。其中,需要特别关注固定配体策略对实验结果影响,建议在实验中比较分析多种策略的结果来减少实验误差。当然,随着IgG与Fc段受体相互作用机制的深入研究以及蛋白偶联技术的发展,SPR技术在检测IgG与Fc段受体分子结合活性方面一定会有更优的表现。

