miR-21靶向调控PTEN/PI3K/Akt通路对胆管癌细胞恶性生物学行为的影响
施 喆, 周丽媛, 赵国栋, 孙树刚, 薛 亮
河北工程大学附属医院 a.普外科, b.妇科, 河北 邯郸 056000
胆管癌源是肝胆系统中高度致命的恶性肿瘤,近年来全球范围内发病率不断上升[1-2]。目前胆管癌病因尚不明确,手术切除是其主要的根治性手段。但由于胆管癌早期症状不明显且诊断困难,大多数患者初诊时已处于晚期,总体手术切除率极低[3]。此外,胆管癌具有高侵袭转移性,恶性进展迅速,导致总体预后差、病死率高,严重威胁人类健康[4]。因此探索新的胆管癌治疗方式具有重要意义。已知肿瘤的发生和发展是由多基因调控,其中原癌基因和抑癌基因的激活与失活发挥重要功能[5]。随着肿瘤细胞增殖凋亡研究深入,多数原癌基因、抑癌基因及其信号转导通路成为肿瘤靶向治疗的关键点[6]。蛋白酪氨酸磷酸酶(phosphatase and tensin homolog deleted on chromosome ten,PTEN)/磷酸肌醇-3-激酶(phosphoinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路在恶性肿瘤细胞的增殖分化过程中起重要作用[7]。PTEN是目前公认的抑癌基因之一,研究[8]表明过表达PTEN可抑制PI3K/Akt信号通路并抑制胆管癌细胞迁移能力。微小核糖核酸(micro ribonucleic acid,miRNA)可靶向调控基因转录后翻译或使其降解,研究[9-10]表明miRNA-21(miR-21)参与胆管癌细胞增殖、分化、凋亡、迁移和侵袭,并具有抑制结直肠癌的增殖和调控PTEN/PI3K/Akt通路的作用。然而miR-21能否通过靶向PTEN/PI3K/Akt信号通路调控胆管癌细胞的恶性生物学行为仍不清楚。鉴于此,本研究选取人胆管癌细胞株QBC939开展细胞实验,揭示miR-21靶向PTEN/PI3K/Akt通路调控人胆管癌细胞株QBC939恶性行为的分子机制。
1 材料与方法
1.1 实验材料
1.1.1 实验细胞与试剂 人胆管癌细胞株QBC939(由武汉细胞研究所提供);脂质体转染(LipofectamineTM2000)试剂盒(购自北京索莱宝科技有限公司,生产批号:11668-027);人miR-21模拟物(hsa-miR-21 mimics,合成序列:5′-UAGCUUAUCAGCUGAUGUUGA-3′)(pGFP-hsa-miR-21 mimics)过表达质粒、hsa-miR-21抑制剂(hsa-miR-21 inhibitor,合成序列:5′-UUCUCCGAACGUGUCACGUTT-3′)(pGFP-hsa-miR-21 inhibitor)质粒、hsa-miR-21 inhibitor阴性对照(negative control inhibitor,NC inhibitor,合成序列:5′-CAGUACUUUUGUGUAGUAGUACAA-3′)(pGFP-NC inhibitor)质粒、miR-21 mimics、miR-21 mimics阴性对照(negative control mimics,NC mimics)(合成序列:5′-UUGUACUACACAAAAGUACUG-3′)[均由和元生物技术(上海)股份有限公司合成];四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)溶液(购自上海麦克林生化科技有限公司,生产批号:M864643);凋亡检测试剂盒(购自杭州诺扬生物技术有限公司,生产批号:FXP023-020-20);基质胶(Matrigel)(购自上海慧颖生物科技有限公司,生产批号:356234);侵袭小室(Transwell)(购自北京明阳科华生物科技有限公司,生产批号:BD-353503);miR-21、PTEN、PI3K、Akt、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)和内参β-肌动蛋白(β-actin)基因所需实时-逆转录聚合酶链反应(real-time reverse transcription polymerase chain reaction,RT-qPCR)引物、野生型和突变型PTEN-3′UTR引物(均由重庆威斯腾生物医药科技有限责任公司合成);总RNA提取试剂盒[购自天根生化科技(北京)有限公司,生产批号:DP419];二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒(购自北京索莱宝科技有限公司,生产批号:PC0020);兔抗人PTEN、PI3K、Akt、磷酸化Akt(p-Akt)、mTOR和β-actin单克隆抗体(一抗)、羊抗兔PTEN、PI3K、Akt、p-Akt、mTOR和β-actin荧光标记多克隆抗体(二抗)(均购自上海联迈生物工程有限公司,生产批号:H00005728-K、ab226826、PAB1310、PAB19236、PAB18865、ab179467、ab195056、ab40755、ab372015、ab531250、5048S、ab11003);双荧光素酶报告基因检测试剂盒[购自翌圣生物科技(上海)股份有限公司,生产批号:11401];PureLinkTMPro 96基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒(购自赛默飞世尔科技公司,生产批号:K182104A);不产色链霉菌第二型(Streptomyces achromogenes Ⅱ,Sac Ⅱ)和流感嗜血杆菌d第三型(Haemophilus influenzae d Ⅲ,Hind Ⅲ)内切酶(均购自北京博迈斯科技发展有限公司,生产批号:R0157S、R0104V);pmiRGLO载体(购自湖南科爱医疗器械有限公司,生产批号:VT1439);质粒提取试剂盒(购自上海力敏实业有限公司,生产批号:12145)。
1.1.2 实验设备 MTP-601F型酶标仪[购自天美(中国)科学仪器有限公司];Agilent NovoCyte Quanteon型流式细胞仪[购自安捷伦科技(中国)有限公司];BD-YG3002型荧光显微镜(购自深圳市博视达光学仪器有限公司);TS100型倒置显微镜(购自武汉医捷迅安商贸有限公司);H12943型划痕仪(购自北京恒奥德仪器仪表有限公司);MA-6000型PCR仪(购自苏州雅睿生物技术股份有限公司);MS型实时凝胶电泳系统(购自北京兴联商贸有限公司);Image J v1.8.0软件(购自美国国立卫生研究院)。
1.2 方法
1.2.1 细胞培养及转染 将人胆管癌细胞株QBC939接种至含10%胎牛血清的无菌1640液体细胞培养基(RPMI-1640)中,37 ℃、5% CO2恒温箱培养。将培养至对数期的癌细胞接种至6孔板,待细胞贴壁至70%左右时更换培养液。以LipofectamineTM2000脂质体法进行转染,严格按照试剂盒说明进行操作:加入转染试剂后,逐滴加入hsa-miR-21 mimics过表达报告基因质粒,培养4~6 h后更换培养基继续培养48 h,将该组细胞记为过表达组;同法获得转染hsa-miR-21 inhibitor报告基因质粒和NC inhibitor报告基因质粒的QBC939细胞,分别记为沉默组和空载组;同时将未经处理的QBC939细胞株记为空白对照组。每组5个复孔,并通过荧光显微镜检测转染效率。
1.2.2 MTT比色法检测各组细胞增殖抑制率 胰蛋白酶消化,每孔加20 μL 5 mg/mL MTT溶液,4 h后弃培养液,加入150 μL二甲基亚砜,振荡5 min,在酶标仪上用490 nm波长测定OD值,计算0~72 h每组细胞增殖活性。每组实验重复3次,取OD的平均值。
1.2.3 流式细胞仪检测各组细胞凋亡率 胰蛋白酶消化,离心,预冷磷酸盐缓冲溶液(PBS)洗涤细胞,调整细胞浓度1×106个/mL。加入10 μL磷脂结合蛋白V避光室温反应10 min,预冷PBS洗涤,加入4 μL碘化丙啶,流式细胞仪检测细胞凋亡率。
1.2.4 Transwell实验检测细胞侵袭能力 向Transwell中加60 μL 1.5 mg/mL的Matrigel,均匀铺在小室上层滤膜,37 ℃孵育1 h成膜以模拟基底膜结构。调整细胞浓度为1×105个/mL,将细胞加入Transwell小室上室内,每孔200 μL,下孔加入RPMI-1640培养基后于37 ℃、5% CO2恒温箱培养24 h。随后分别经过PBS洗涤、多聚甲醛固定、蒸馏水洗涤结晶紫染色以及洗涤风干等步骤后获取基底膜。倒置显微镜下分4个区域,每个区域随机选取1个视野,观察拍照并计数。每组3张膜,穿膜细胞数取平均值。
1.2.5 细胞划痕实验 将各组细胞接种到6孔板中,细胞达到95%融合,用划痕仪对准6孔板下端中央部位轻轻划痕。RPMI-1640培养基轻轻漂洗3次后,37 ℃、5%CO2恒温箱培养48 h,倒置显微镜拍照,观察划痕愈合情况。
1.2.6 RT-qPCR检测miR-21、PI3K、Akt、mTOR和PTEN mRNA表达 提取各组细胞总RNA。逆转录合成cDNA,根据引物序列进行PCR反应。反应条件:95 ℃ 5 s变性;55 ℃ 30 s退火;72 ℃ 30 s,40个循环;72 ℃10 min。引物序列见表1。本研究选取β-actin作为内参基因,采用相对定量法[11]比较各组细胞待测基因mRNA表达差异。待测基因ΔΔCt值=[待测基因mRNA平均Ct值(转染组)- β-actin mRNA平均Ct值(转染组)]-[待测基因mRNA平均Ct值(空白对照组)- β-actin mRNA平均Ct值(空白对照组)]。以2-ΔΔCt表示各组待测基因 mRNA表达的倍比关系。
1.2.7 蛋白质免疫印迹法(Western blotting,WB)检测PTEN、PI3K、Akt和mTOR蛋白表达 收集各组细胞,加入细胞裂解液,提取细胞总蛋白质。BCA法测定蛋白浓度,调整蛋白终浓度为5 μg/μL。WB凝胶电泳,然后转移至聚偏二氟乙烯膜,脱脂奶粉封闭,加入一抗,4 ℃孵育过夜,将聚偏二氟乙烯膜置于含有二抗试管中,室温孵育,显色反应,扫描胶片后用Image J软件分析蛋白印迹灰度值。

表1 PCR反应引物序列Table 1 The primer sequences of PCR reaction
1.2.8 双荧光素酶报告基因实验 采用TargetScan数据库[12]预测miR-21的靶基因。构建野生型和突变型PTEN-3′UTR报告基因质粒。野生型PTEN-3′UTR报告基因质粒:获取细胞总DNA后,根据设计好的引物(引物包含Sac Ⅱ和Hind Ⅲ酶切位点),以细胞总DNA为模板经2次PCR扩增出所需片段;对琼脂糖电泳回收的PCR扩增条带进行Sac Ⅱ和Hind Ⅲ双酶切,同时将报告质粒pmiRGLO进行双酶切,回收两者双酶切电泳条带;连接两者双酶切产物;将连接产物转化到大肠杆菌DH5α感受态细胞中;选取合适单菌落,提取重组质粒,经鉴定序列信息与NCBI数据库收录序列一致。野生型PTEN-3′UTR引物序列:上游引物5′-CCACCAGAGCTCTCTTGTGCTGTGCAGCAG-3′,下游引物5′-CCAACGAAGCCTGTGATGGCATTCACTGAACC-3′。突变型PTEN-3′UTR报告基因质粒:通过引物搭桥法对PTEN-3′UTR进行定点突变,用设计好的上下游引物分别PCR扩增出PTEN-3′UTR上游和下游突变产物;搭桥PCR程序进行搭桥连接,以搭桥PCR产物为模板,PCR扩增并电泳回收,后续过程同野生型PTEN-3′UTR报告基因质粒构建过程一致,经鉴定连接产物的序列一致。突变型PTEN-3′UTR引物序列:上游引物5′-AACCGCGGTAAGAGAAATAAGCACCGTTTTCCAAG-3′,下游引物5′-AAAACGGTGCTTATTTCTCTTACCGCGGTTCAGATGTCTGAAGAT-3′。将野生型和突变型PTEN-3′UTR报告基因质粒、miR-21 mimics及NC mimics转染至QBC939细胞中,48 h后进行双荧光素酶检测。各组相对荧光强度=各组萤火虫荧光强度/海肾荧光强度。

2 结果
2.1 各组细胞转染效率 荧光显微镜下观察,转染成功细胞表达绿色荧光,未转染成功细胞无荧光。空载组、过表达组和沉默组转染效率分别为(90.27±18.03)%、(91.43±18.26)%和(92.16±18.41)%(图1)。

图1 转染后QBC939细胞荧光图(×100)
2.2 各组细胞增殖活性和凋亡率 MTT 结果显示,在转染处理后24~72 h,与空白对照组和空载组比较,过表达组QBC939细胞增殖活性明显提高(P值均<0.05)(图2),凋亡率显著下降(P值均<0.01)(图3,表2);与空白对照组、空载组和过表达组比较,沉默组细胞增殖活性显著降低(P值均<0.01)(图2),而凋亡率显著上升(P值均<0.01)(图3,表2)。
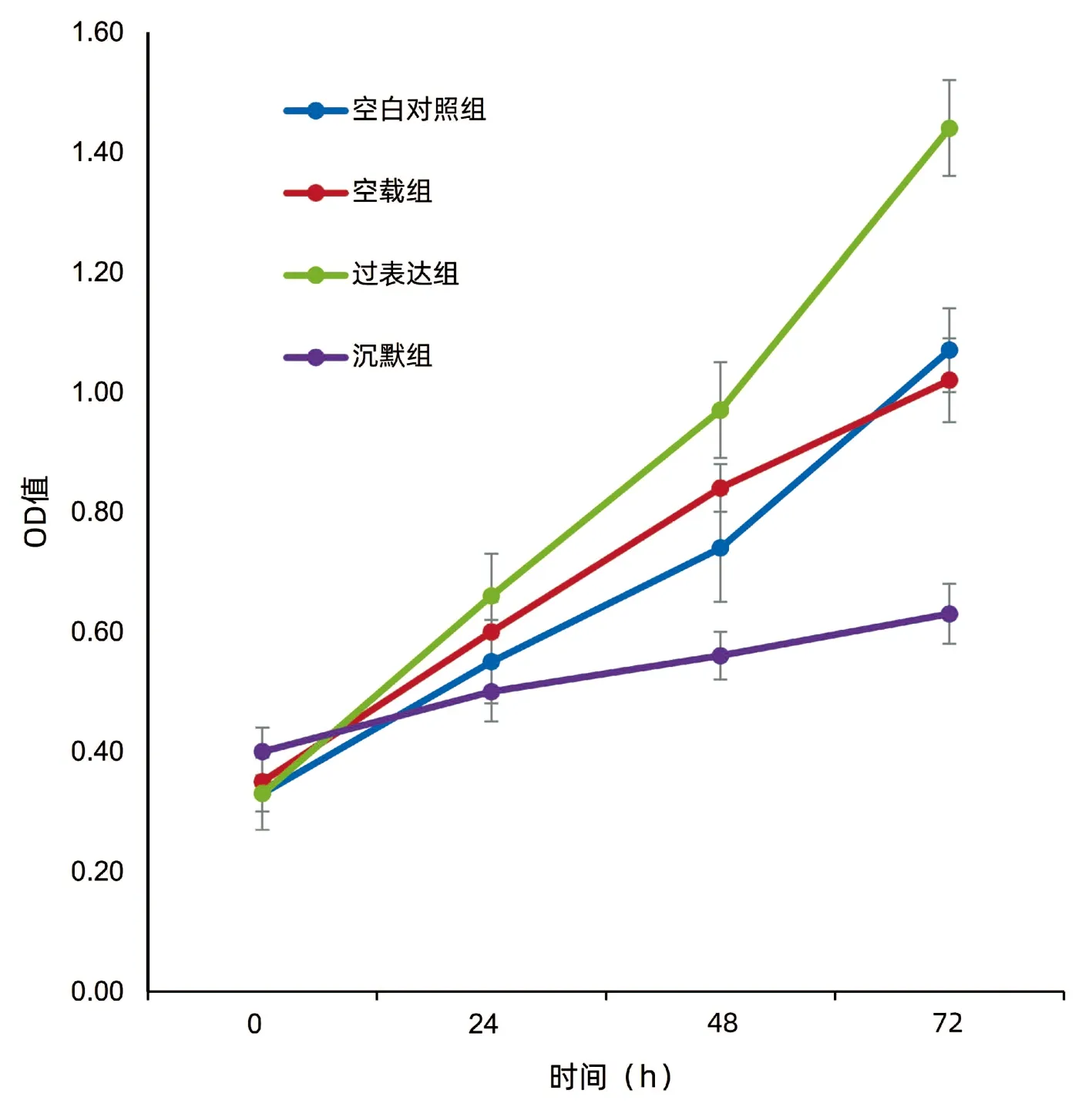
图2 各组QBC939细胞增殖活性

表2 各组QBC939细胞凋亡率Table 2 The apoptosis rates of QBC939 cells in each group
2.3 各组细胞迁移和侵袭活性 与空白对照组和空载组比较,过表达组QBC939细胞迁移率和穿膜数目均显著增高(P值均<0.01);与空白对照组、空载组和过表达组比较,沉默组迁移率和穿膜数目均显著下降(P值均<0.01)(表3,图4、5)。
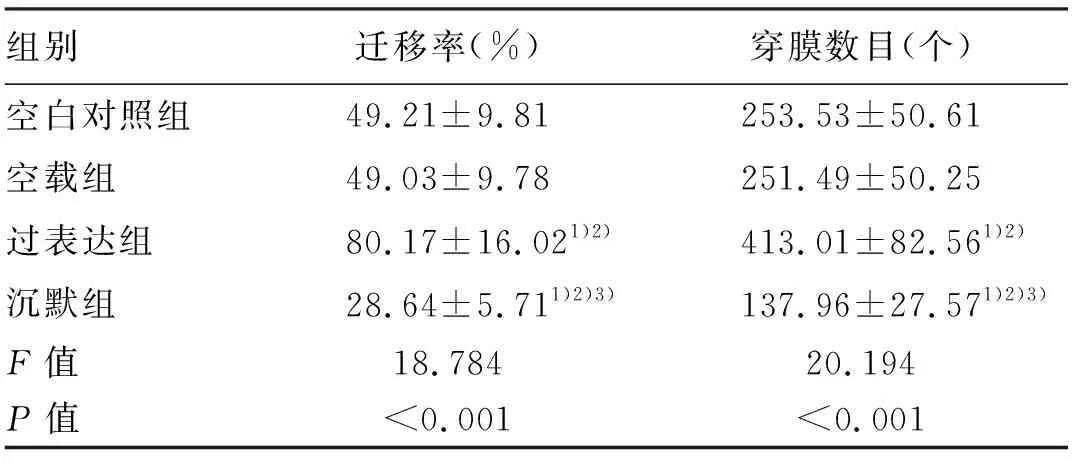
表3 各组QBC939细胞体外侵袭实验结果Table 3 Results of in vitro invasion experiments of QBC939 cells in each group
2.4 各组细胞miR-21、PI3K、Akt、mTOR和PTEN mRNA表达 与空白对照组和空载组比较,过表达组miR-21、PI3K、Akt和mTOR mRNA表达均升高,PTEN mRNA表达下降,差异均有统计学意义(P值均<0.05);与空白对照组、空载组和过表达组比较,沉默组miR-21、PI3K、Akt和mTOR mRNA表达均下降,PTEN mRNA表达升高,差异均有统计学意义(P值均<0.05)(图6)。

图3 流式细胞检测各组QBC939细胞凋亡率Figure 3 Flow cytometry examined apoptosis rates of QBC939 cells in each group

图4 划痕实验结果

图5 Transwell小室试验结果(结晶紫染色,×100)

注:与空白对照组比较,#P<0.05;与空载组比较,△P<0.05;与过
2.5 各组细胞PI3K、Akt、p-Akt、mTOR和PTEN蛋白表达 与空白对照组和空载组比较,过表达组PI3K、Akt、p-Akt和mTOR蛋白表达均显著升高,PTEN蛋白表达显著下降(P值均<0.01);与空白对照组、空载组和过表达组比较,沉默组PI3K、Akt、p-Akt和mTOR蛋白表达均显著下降,PTEN蛋白表达显著升高(P值均<0.01)(图7,表4)。
2.6 miR-21靶向PTEN的验证 TargetScan数据库预测PTEN为miR-21潜在靶基因,PTEN基因3′UTR与miR-21有6个碱基位点互补配对(图8)。双荧光素酶报告基因实验显示,miR-21 mimics和野生型PTEN-3′UTR质粒共转染细胞的相对荧光强度较NC mimics和野生型PTEN-3′UTR质粒共转染细胞显著降低(P<0.05);miR-21 mimics和突变型PTEN-3′UTR质粒共转染细胞中相对荧光强度较NC mimics和突变型PTEN-3′UTR质粒共转染细胞差异无统计学意义(P>0.05)(图9)。

图7 各组细胞PI3K、Akt、p-Akt、mTOR和PTEN蛋白表达量Figure 7 Expression levels of PI3K, Akt, p-Akt, mTOR,and PTEN proteins in each group
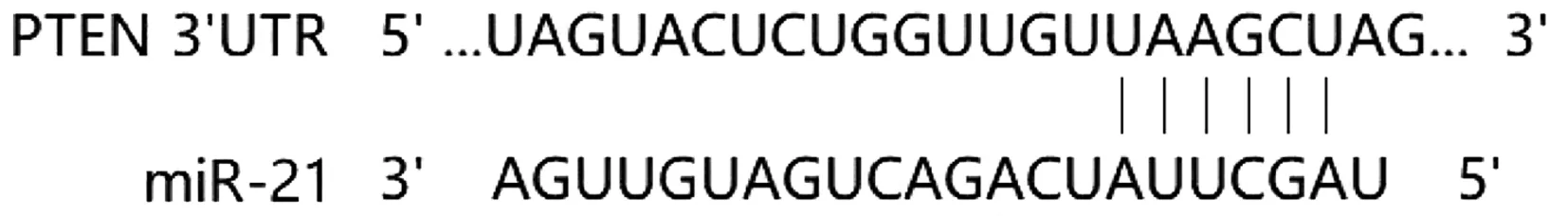
图8 数据库预测miR-21和PTEN的互补序列
3 讨论
胆管癌作为高度恶性的实体肿瘤,其传统手术切除率低,患者预后差,严重威胁人类健康。现如今靶向药物的开发和应用为肿瘤治疗提供了新的思路。既往研究[8-10]表明miR-21可调控抑癌基因PTEN表达,而PTEN/PI3K/Akt信号通路在胆管癌增殖分化过程中发挥重要作用。然而miR-21能否靶向PTEN/PI3K/Akt信号通路调节胆管癌恶性行为未知。鉴于此,本研究选取胆管癌细胞株QBC939,研究miR-21基因干扰靶向PTEN/PI3K/Akt信号通路调节胆管癌恶性行为的分子机制。

表4 各组细胞PI3K、Akt、p-Akt、mTOR和PTEN蛋白相对表达量Table 4 Relative expression levels of PI3K, Akt, p-Akt, mTOR, and PTEN proteins in each group

注:与转染NC mimics细胞比较,P<0.05。
本研究结果显示,在QBC939细胞中过表达miR-21可增加细胞的增殖活性、减少细胞的凋亡并提高细胞的迁移率和穿膜数目;当沉默miR-21后,细胞的增殖活性降低、细胞凋亡率增加、迁移率和穿膜能力降低。说明miR-21过表达可显著促进癌细胞增殖、迁移和侵袭,抑制癌细胞凋亡,促进胆管癌细胞恶性行为。有研究[13]指出,胆管癌细胞高增殖率和低凋亡率与胆管癌细胞活性增强相关,癌细胞迁移和侵袭与基质金属蛋白酶9和波形蛋白的表达水平相关,据此推测本研究中miR-21调节胆管癌细胞的增殖活性、凋亡率、迁移和侵袭行为可能与调节癌细胞的细胞活性、基质金属蛋白酶9以及波形蛋白表达水平相关。
为进一步明确miR-21是否能作用于PTEN/PI3K/Akt通路,进而调控胆管癌细胞的增殖、迁移和浸润等恶性行为,本研究发现当转染miR-21 mimics过表达miR-21时,PI3K、Akt和mTOR mRNA和蛋白质表达水平均升高,而PTEN mRNA和蛋白质表达水平均下降,说明活化miR-21可增加PI3K/Akt通路的活性。当抑制miR-21表达时,PI3K、Akt和mTOR mRNA和蛋白质表达水平均下降,PTEN mRNA和蛋白质表达水平均升高,表明抑制miR-21可抑制PI3K/Akt 通路的活性。一般Akt的激活都是磷酸化的途径,总量基本稳定,但p-Akt水平改变。但是在本研究中,随着miR-21的过表达或沉默,Akt总量也发生了改变。既往研究[14]表明,泛素化是一种对靶蛋白进行特异性修饰的过程,可调控细胞增殖、细胞周期、凋亡等多种进程,泛素-蛋白酶体系统在肿瘤进程中发挥重要作用。据此推测miR-21可能通过泛素化干扰了Akt蛋白的降解过程,过表达miR-21导致Akt降解受阻,Akt总量增加,而沉默miR-21促进Akt的降解导致总量下降。也可能是miR-21影响了Akt蛋白的表达。
本研究中双荧光素酶结果显示,miR-21 mimics可显著抑制野生型PTEN-3′UTR质粒转染细胞相对荧光强度,但是对突变型PTEN-3′UTR质粒转染细胞无影响,证明PTEN为miR-21的直接作用靶点。近年来肿瘤靶向治疗逐渐重视miRNA的靶向作用[15]。miRNA是一种非编码单链小分子RNA,作为转录后负调节因子,可与靶基因mRNA互补,结合到靶基因mRNA的3′UTR,抑制靶标基因蛋白翻译或使其降解,参与原癌和抑癌基因的调节作用,调节细胞代谢过程[16]。miR-21由22个核苷酸组成,参与癌症的发生发展,在肿瘤中呈过表达现象[17]。有研究[18-19]报道miR-21可促进乳腺癌的增殖和转移,参与调控食管鳞癌细胞增殖和凋亡。PI3K是一种磷脂酰肌醇激酶,Akt是一种蛋白激酶,mTOR是一种丝氨酸/苏氨酸激酶,三者均参与细胞的增殖、分化和凋亡;活化的PI3K磷酸化Akt,p-Akt水平升高,使Akt处于活化状态,在肿瘤中PI3K/Akt信号通路被异常激活后促进肿瘤细胞的增殖、迁移,促进肿瘤生长,是肿瘤靶向治疗的关键分子,同时mTOR可活化PI3K/Akt信号通路[20-21]。PTEN作为抑癌基因,可抑制胆管癌细胞生长并负调节PI3K/Akt信号通路;而PTEN表达被抑制时,PTEN/PI3K/Akt信号转导通路失衡进而促进肿瘤细胞的增殖、侵袭和迁移并抑制凋亡,最终导致肿瘤发生[22-23]。有研究[24]证明miR-21可调节PTEN/PI3K/AKT信号通路调控卵巢癌细胞的增殖和凋亡。本研究结果与既往研究结果一致,据此推测miR-21可能通过靶向抑制抑癌基因PTEN的表达,从而诱导PI3K/Akt磷酸化,促进癌细胞的侵袭和转移,增强胆管癌的恶性行为。
综上所述,miR-21基因干扰可有效抑制胆管癌细胞的恶性行为,具体机制可能通过靶向调控PTEN/PI3K/Akt信号通路信号传导,抑制癌细胞的增殖、侵袭和迁移,促进癌细胞凋亡。为进一步研究miR-21对胆囊癌细胞恶性生物学行为提供了一定理论依据,针对miR-21的小分子抑制剂有望成为潜在的胆管癌治疗方案。
伦理学声明:本研究于2019年9月27日通过河北工程大学附属医院伦理委员会批准,批号为2019[K]-042。
利益冲突声明:本研究不存在研究者、伦理委员会成员以及与公开研究成果有关的利益冲突。
作者贡献声明:施喆负责课题设计,研究实施,数据分析以及论文撰写;周丽媛、赵国栋负责资料收集,数据分析;孙树刚、薛亮负责课题设计,研究指导,论文修改。
——一道江苏高考题的奥秘解读和拓展

