Sartobind Q膜纯化乙型脑炎灭活疫苗的研究
李庆岸,于海,杨兵,于宏跃
(辽宁成大生物股份有限公司,辽宁沈阳 110179)
乙型脑炎简称乙脑,是由日本脑炎病毒(Japanese Encephalitis Virus,JEV)引起的一种人兽共患的蚊媒传染病,日本脑炎病毒属于黄病毒属,通过蚊虫叮咬而在猪和人之间传播。乙脑发生并流行于东亚、东南亚及其相邻地区,主要侵袭对象是儿童,旅行者和海外军人也存在感染的风险[1]。
乙脑疫苗是将乙脑病毒接种于适合的动物细胞上,经繁殖后病毒释放到培养液中,与此同时一些残余的宿主细胞或其碎片也会进入到培养液中,经澄清、超滤浓缩、凝胶过滤层析后得到乙脑疫苗原液。由于使用传代细胞(如Vero细胞)作为疫苗生产的培养基质,在疫苗中的宿主细胞DNA残留具有潜在的风险,一方面是其具有潜在的致癌性;另一方面是其存在感染性病毒基因组的可能性。因此,各国监管机构均对生物制品中的Vero细胞残留DNA作出了严格规定,以确保健康人群接种疫苗的安全性[2-3],《中华人民共和国药典》三部(2020版)中对冻干乙型脑炎灭活疫苗(Vero细胞)中Vero细胞DNA残留量的要求为小于100 pg/剂[4]。
Sartobind Q膜可在高流速下用于工艺中的杂质去除和产品精纯。Sartobind Q的季铵盐基团共价结合于纤维素配基上,在高流速的条件下可以高效结合蛋白。Sartobind Q膜内孔径大于3 μm,因此大分子蛋白、生物分子、病毒等都可以进入该多孔结构,从而获得比传统膜填料更大的动态结合载量。Sartobind Q是对有价值的蛋白(如病毒蛋白)进行流穿模式精细纯化的完美工具,在去除细胞DNA残留、细胞蛋白、内毒素期间,膜体积可以保持足够小。
Sartobind Q膜的优势:(1)独特的开放式微孔结构,孔径大于3 μm,在高流速下仍然能保持高动态载量;(2)以稳定化再生纤维素为骨架,凝胶填料柱层析的基团都能用共价方式结合到交联膜骨架上,非特异性吸附低,产品回收率高;(3)简化工艺步骤,降低工艺时间,优越的可操作性和安全性,即开即用;(4)产品设备简单,无须硬件投入和维护成本,操作简单,没有体积巨大的硬件。
本实验采用Sartobind Q阴离子交换层析法从乙脑病毒灭活液中除去残留DNA,将分子筛纯化得到病毒蛋白溶液进一步膜分离,在一定的离子强度和pH下,DNA吸附在膜配基上,而乙脑病毒蛋白在纯化过程中与膜上的离子结合位点被氯离子所取代,直接从膜中流出,进一步去除残留DNA的含量。
1 材料与方法
1.1 毒株与细胞
乙型脑炎毒种由中国药品生物制品检定所提供,毒株名称为“乙脑京卫研3株”,代号为“P3”;Vero细胞采购于美国标准菌种保藏中心(ATCC)。
1.2 试剂与仪器
Sartobind Q膜,德国Sartorius Stedim公司;AKTA pure 150层析系统,美国GE Healthcare公司;Vero残留DNA-154检测试剂盒,湖州申科生物技术有限公司;Celligen 7.5 L生物反应器,德国Eppendorf公司;微载体,美国GE Healthcare公司;膜(300 kD),美国Millipore公司;β-丙内酯,德国Serva公司。
1.3 病毒原液的制备
Vero细胞接种至7.5 L生物反应器内,使用微载体Cytodex1大规模培养,37 ℃培养6 d至细胞长满后,温度降低至33 ℃;接种P3株乙脑病毒,按感染复数(Multiplicity Of Infection,MOI)=1∶500的比例感染,48 h后开始收获病毒,直至微载体上细胞汇合率为10%时停止收获。连续制备10批,批号为S1~S10。
1.4 病毒灭活
将病毒收获液澄清后,使用300 kD的膜浓缩约20倍,获得病毒浓缩液;再用2~8 ℃经灭菌的注射用水稀释β-丙内酯40~100倍;向病毒浓缩液中加入β-丙内酯,使病毒浓缩液与β-丙内酯的浓度比为1∶4 000;将混合液置于4 ℃的冰箱中2~8 ℃,搅拌灭活24 h;灭活结束后,将病毒灭活液放置于37 ℃下水解2 h,用1 mol/L氢氧化钠溶液调节pH值为7.2~7.8,获得病毒灭活液。
1.5 传统Sepharose凝胶方法纯化疫苗
将乙脑疫苗灭活液经过装载Sepharose 6 FF凝胶的XK50层析柱,柱体积为1 000 mL,紫外280 nm监测,流速为6.5~9.8 mL/min,流动相为PBS缓冲液,第一个吸收峰即为乙脑病毒蛋白纯化液,产品批号分别为 J1~ J10。
1.6 Sartobind Q方法纯化疫苗
初步纯化液的制备方法与1.5项下内容一致。将收集的初步纯化液进行Sartobind Q膜穿透模式过滤,具体流程如下:排气;使用前用1 mol/L的NaOH溶液清洗30 min,温度20 ℃,清洗体积为10倍Sartobind Q膜床体积(以下简称MV);使用0.4~0.5 mol/L的PBS缓冲溶液平衡,平衡体积为10 MV;将收集的纯化液流穿到Sartobind Q膜上,根据紫外吸收情况,流速10~30 MV/min,进行病毒蛋白的收集;样品全部加载后,使用0.4~0.5 mol/L的PBS缓冲溶液进行洗脱,继续收集;使用1 mol/L的NaCl溶液,收集洗脱出来的蛋白峰;使用1 mol/L的NaOH溶液,清洗30min[5]。得到的产品批号分别记为j1~j10。
1.7 中间产品成分检测
1.7.1 乙脑残留DNA含量检测
PCR-荧光探针法检测Vero细胞宿主DNA。
1.7.2 乙脑灭活液、纯化液抗原含量检测
使用乙型脑炎病毒ELISA实验检测。
2 结果与分析
2.1 疫苗的纯化
2.1.1 Sepharose 6 FF凝胶纯化效果
如图1所示,10批病毒灭活液经凝胶Sepharose 6 FF纯化后,清晰可见紫外吸收第一峰及第二峰,洗脱体积330 mL和750 mL处分别为目标峰和杂质峰,表明该介质可有效分离疫苗原液中的杂质。
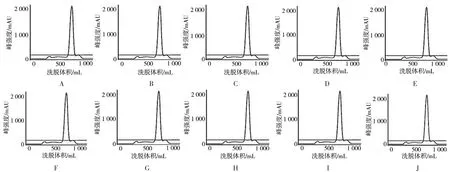
图1 10批乙脑病毒液的Sepharose凝胶纯化图谱
2.1.2 Sartobind Q膜纯化效果
将初步纯化液按40倍膜床工作体积加载到Sartobind Q膜中,当样品全部加载后,继续用0.4~0.5 mol/L的PBS缓冲液洗涤膜,收集的穿透峰为最终纯化液,见图2。
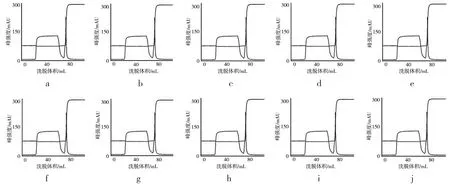
图2 10批乙脑病毒液的Sartobind Q膜纯化图谱
2.2 疫苗纯化液指标检测
2.2.1 Vero细胞残留DNA去除率
如表1所示,经过Sartobind Q膜纯化后,10批疫苗的细胞残留DNA去除率为95.4%~97.8%,平均值为96.7%,标准偏差(SD)为2.1%。

表1 Sartobind Q膜对初步纯化液中DNA的去除效果
2.2.2 乙脑病毒抗原回收率
纯化后10批疫苗纯化液的抗原含量的降幅见表2,经计算,Sepharose 6 FF层析纯化和Sepharose 6 FF层析+Sartobind Q膜纯化方法的标准偏差分别为0.069和0.067,两种方法得到的抗原含量无显著差异(P=0.67>0.05),说明在初步纯化液的基础上增加Sartobind Q膜纯化不会导致产品有效成分损失。
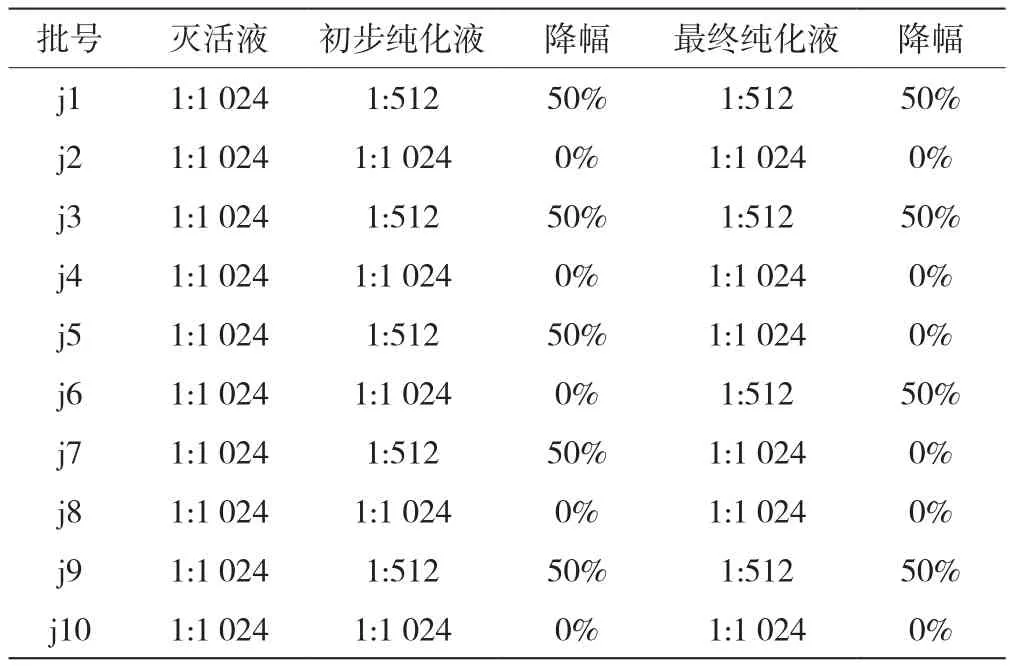
表2 疫苗纯化液的抗原含量变化情况
3 结论
本实验将凝胶过滤层析所获得的病毒蛋白溶液(初步纯化液)进一步经过Sartobind Q 膜过滤,在一定的pH、离子强度下,乙脑病毒蛋白直接穿透,有效去除细胞残留DNA的含量。该方法对产品中的抗原含量没有影响,Sartobind Q膜层析对初步纯化液残留DNA的去除率为95.4%~97.8%,纯化效果显著提升。

