全反式维甲酸与胃癌预后相关性及其机制研究
冯振游, 胡孔旺 , 丁慧明, 黄志国
作者单位:安徽医科大学第一附属医院普外科,合肥 230022
胃癌(gastric carcinoma,GC)是发病率最高的肿瘤之一。大多数胃癌患者确诊时已经处于中晚期。研究[1]表明,胃癌细胞中的上皮间质转化(epithelial-mesenchymal transformation, EMT)会促进细胞的增殖、迁移和侵袭。课题组前期试验表明,全反式维甲酸(all-trans-retinoic acid, ATRA)会提高胃癌患者的生存率。ATRA属于维生素A的一种,其相对分子量大小为300.44。ATRA对于人体的生长发育以及细胞的分化起到了重要的作用。已经有相关研究[2]证明,ATRA与受体RARRa/RXR 结合后,对胃癌细胞的增殖和凋亡等产生了一定的抑制作用。如ATRA与受体 RARα 结合后可诱导神经母瘤细胞分化,与RARβ结合后则使其生长受到抑制[3]。ATRA在临床中已经被用作细胞诱导分化剂,对于多种肿瘤均存在治疗效果。因此,该实验探讨了ATRA对胃癌术后患者预后的影响,以及ATRA参与胃癌发生发展的机制。
1 材料与方法
1.1 病例资料2001年5月—2012年12月在安徽医科大学第一附属医院普外科就诊,并且病理组织学诊断为胃癌组织浸润到黏膜下层以下的胃癌患者,外周血常规检查、肝肾功能和血脂检测指标均正常,美国东部肿瘤协作组(Eastern cooperative oncology group,ECOG)体力状态评分4分以下。
1.2 治疗方法按照均衡循序随机的方法将入选胃癌患者于手术后分为对照组和ATRA组。其中对照组对患者进行静脉辅助化疗的方式,具体为患者采用FLP[5-Fu 400 mg/m2×5 d,DDP 60 mg/m2×1次,亚叶酸钙每天200 mg/m2×5 d] 方案,3周为一个化疗周期,共计6个疗程。ATRA组患者为静脉辅助化疗+口服ATRA的方式,口服ATRA具体为手术后2 d开始服用ATRA,10 mg/次,3 次/d,共计6个月。上述研究方案经安徽医科大学第一附属医院伦理委员会批准,并获得患者的知情同意。
1.3 随访通过当地行政管理人员、社区医疗卫生服务人员及患者或家属电话联系随访,了解患者是否生存或患者的死亡时间。随访截止到2020年10月,248例患者中198例获得随访。其中ATRA组98例,对照组100例。
1.4 细胞株及主要试剂胃癌 MGC-803 细胞购自上海冠道生物科技有限公司;全反式维甲酸购自美国sigma公司;CCK-8试剂盒购自广州济恒医药科技有限公司;胰酶购自武汉金开瑞科技有限公司;胎牛血清购自上海江林生物科技有限公司;DMEM低糖培养基购自合肥欣乐生物科技有限公司;BCA蛋白浓度测定试剂盒,快速凝胶试剂盒购自武汉赛维尔科技有限公司;E-cadherin、N-cadherin和Vimentin一抗购自美国CST公司;GAPHD一抗和过氧化物酶标记的山羊抗兔IgG二抗购自合肥欣乐生物科技有限公司;细胞凋亡试剂盒和荧光二抗购自武汉赛维尔科技有限公司公司; Western-blot凝胶和板均购自康乐有限公司。荧光定量PCR仪器购自美国Thermo Scientific公司。ATRA购自山东良福制药有限公司。亚叶酸钙购自连云港伊特诺化工科技有限公司。
1.5 实验方法
1.5.1细胞培养和药物处理 胃癌 MGC-803 细胞使用DMEM低糖培养基培养,细胞培养箱参数为37 ℃、5% CO2。胎牛血清的浓度为10%。细胞贴壁生长,每2 d进行细胞传代。将培养好的胃癌 MGC-803 细胞分为对照组和ATRA组。ATRA组中用30 μmol/L ATRA溶液进行处理。对照组不进行ATRA溶液处理。
1.5.2CCK-8法检测胃癌MGC-803细胞的增殖能力 取对数生长期的细胞,常规消化,将其接种到96孔板中,96孔板中每个孔中细胞悬液量为100 μl,细胞数为5 000个/孔,每组设置3次重复组。将96孔板放入细胞培养箱中,参数设置为37 ℃、5% CO2。待细胞贴壁生长后,更换不同浓度的ATRA培养 (10、25、50、75和100 μmol/L),同时设置对照组和DMSO组。ATRA溶液分别处理24 h和48 h后,加入CCK-8试剂,在酶标仪测量450 nm波长的吸光度。
1.5.3细胞划痕愈合实验检测胃癌MGC-803细胞的迁移能力 当6孔板中胃癌 MGC-803 细胞的细胞密度为2×105个/孔时,此时加入不含有胎牛血清的培养基,在细胞培养箱中培养12 h。用1 ml的枪头全部沿着同一个方向进行直线划线,之后每孔中的细胞使用PBS进行洗涤,加入含有1%胎牛血清的培养基,放入细胞培养箱中培养,使用相机拍摄显微镜中细胞迁移的照片。
1.5.4Transwell实验检测胃癌MGC-803细胞的侵袭能力 基底膜进行预冷处理,使用不含胎牛血清的培养基稀释。基底膜放置在Transwell的板上室,将整个聚碳脂膜全部覆盖。将其放入细胞培养箱中1 h待其形成稳定的凝胶。在下面加入700 μl DMEM低糖培养基,培养基中含有10%胎牛血清。在上室孔中加入无血清的细胞悬液,密度为2×105个/孔。分别设置对照组和ATRA组,培养36 h后,用甲醇溶液固定胃癌 MGC-803 细胞,加入0.1%的结晶紫染色液染色20 min,用PBS洗涤3次,放在显微镜下用相机拍照。
1.5.5流式细胞术检测胃癌MGC-803细胞的凋亡水平 收集对照组和ATRA组细胞,用不含EDTA的胰酶消化收集,室温下2 000 r/min离心5 min,用4 ℃的PBS重悬细胞,室温下2 000 r/min离心5 min,弃上清液洗涤细胞。加入300 μl的1×Binding Buffer悬浮细胞,加入5 μl的Annexin V-FITC混匀后,避免室温孵育15 min,加入5 μl的PI染色,200 μl的1×Binding Buffer,进行细胞凋亡检测。
1.5.6Western blot实验检测胃癌MGC-803细胞中E-cadherin、N-cadherin和Vimentin的表达水平 收集对照组和ATRA组细胞,使用RIPA裂解液将细胞裂解,离心机参数设置为12 000 r/min,离心时间15 min。收集胃癌 MGC-803 细胞的上清液存储于1 ml离心管中。使用BCA蛋白定量试剂盒测定蛋白浓度。取蛋白样品20 μg加入上样缓冲液(5×)100 ℃加热10 min。将制得的样品分别加入8% SDS-PAGE和12% SDS-PAGE凝胶中。电泳条件为电压120V,电泳时间30 min。当溴酚蓝到达凝胶底部时停止电泳,使用湿转法进行转膜。将蛋白质转移到PVDF膜上后,使用BSA溶液在室温的条件下进行封闭1 h。分别加入一抗E-cadherin(1 ∶2 000)、N-cadherin(1 ∶2 000)、Vimentin(1 ∶1 000)和GAPDH(1 ∶1 000),在4 ℃冰箱中孵育12 h。使用TBST溶液洗涤3次,每次洗涤10 min。使用辣根过氧化物酶标记的山羊兔抗体IgG(1 ∶5 000)在室温的条件下进行孵育1 h。使用TBST溶液洗涤3次,每次洗涤10 min。加入显色液后使用BIO RAD凝胶成像系统观察不同分组的蛋白灰度值,使用Image J 软件分析蛋白的相对表达量。
1.5.7RT-qPCR法检测胃癌MGC-803细胞中E-cadherin、N-cadherin和Vimentin的mRNA表达水平 选择生长密度达到80%~90%之间的胃癌 MGC-803 细胞,丢弃培养基后使用PBS溶液洗涤2~3次。每个培养皿中加入1 ml TRIzol试剂,冰上静止10 min后使用200 μl移液枪进行吹打。将裂解液全部转移至2 ml的EP管中。TaKaRa试剂盒反转录RNA为cDNA。将1μg总RNA反转录为cDNA 后用IDTE缓冲液( pH = 8.0,Integrated DNA Technologies,美国)稀释至10 ng /μl。qPCR反应体系;25 μl SYBR Premix Ex TaqⅡ,20 ng cDNA和上下游引物共40 μmol/L, dd H2O补充至50 μl。依据RT-qPCR说明书进行检测,反应条件为: 95 ℃预变性30 s,95 ℃变性5 s,60 ℃ 45s,70 ℃ 45 s,共40个循环。实验重复3次。各基因引物序列如表1所示。

表1 基因引物序列
1.5.8免疫荧光检测胃癌MGC-803细胞标记蛋白N-cadherin,E-cadherin和Vimentin的表达 将处理后的胃癌细胞以1×104个/皿接种于共聚焦小皿中,培养24 h。将FBS进行更换,使用PBS溶液将细胞培养基洗去,同时使用多聚甲醛将细胞固定30 min,用PBS缓冲液轻轻晃洗4次后吹干,使用1%的曲通进行细胞膜的裂解,使用PBS缓冲液洗去曲通,100 mmol甘氨酸进行封闭,再使用PBS缓冲液进行清洗,每次10 min共3次。5% BSA封闭1 h后加入N-cadherin,E-cadherin和Vimentin一抗,4 ℃孵育过夜,使用TBST缓冲液进行清洗,每次10 min共3次,室温避光孵育荧光二抗1 h,使用TBST缓冲液进行清洗,每次10 min共3次。加入细胞核染液DAPI室温孵育10 min,使用TBST缓冲液进行清洗,每次10 min共3次,用超纯水清洗2次,加入适量的抗淬灭剂,于正置荧光显微镜下分析样本并拍照记录。

2 结果
2.1 基线数据两组性别、TNM分期、分化程度和手术方式等差异无统计学意义,具体见表2。
2.2 ATRA治疗延长胃癌患者的生存时间对198例GC患者进行术后随访, Kaplan-Meier的生存分析结果显示,ATRA组的GC患者生存期高于对照组的GC患者(P<0.01),差异有统计学意义。见图1。
2.3 ATRA抑制胃癌 MGC-803细胞的增殖能力不同浓度的ATRA溶液处理胃癌MGC-80细胞24、48 h后,CCK-8法进行检测结果显示:与对照组相比, ATRA处理的胃癌MGC-803细胞增殖能力降低(P<0.01),且随着浓度的增大增殖能力不断下降,差异有统计学意义(P<0.01)。见图2。
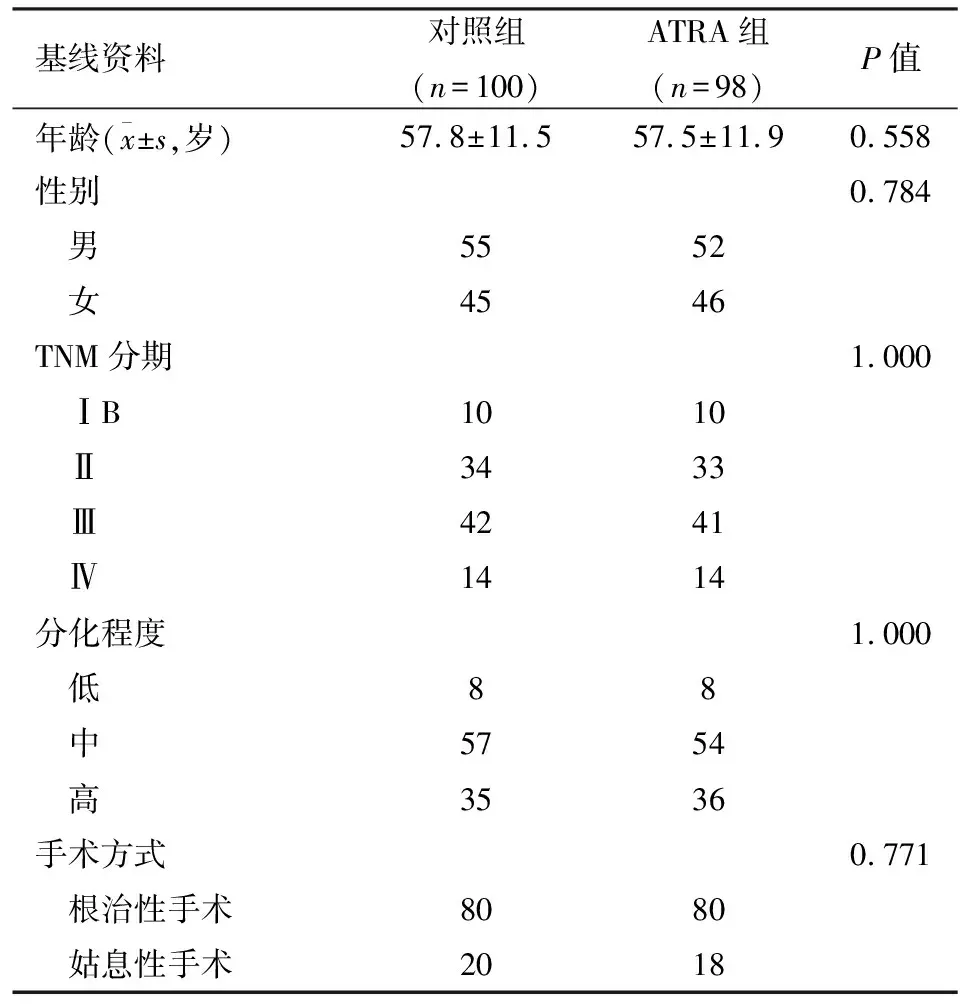
表2 两组基线数据(n)

图1 Kaplan-Meier分析两组胃癌术后患者的生存时间

图2 不同浓度的ATRA对胃癌MGC-803细胞增殖的影响
2.4 ATRA抑制胃癌MGC-803细胞的迁移能力30 μmol/L ATRA溶液处理胃癌 MGC-803 细胞 24、48 h后,与对照组比较,细胞划痕愈合实验结果表明,ATRA组的胃癌 MGC-803 细胞迁移率下降(F=41.718,P<0.01),差异有统计学意义。见图3。
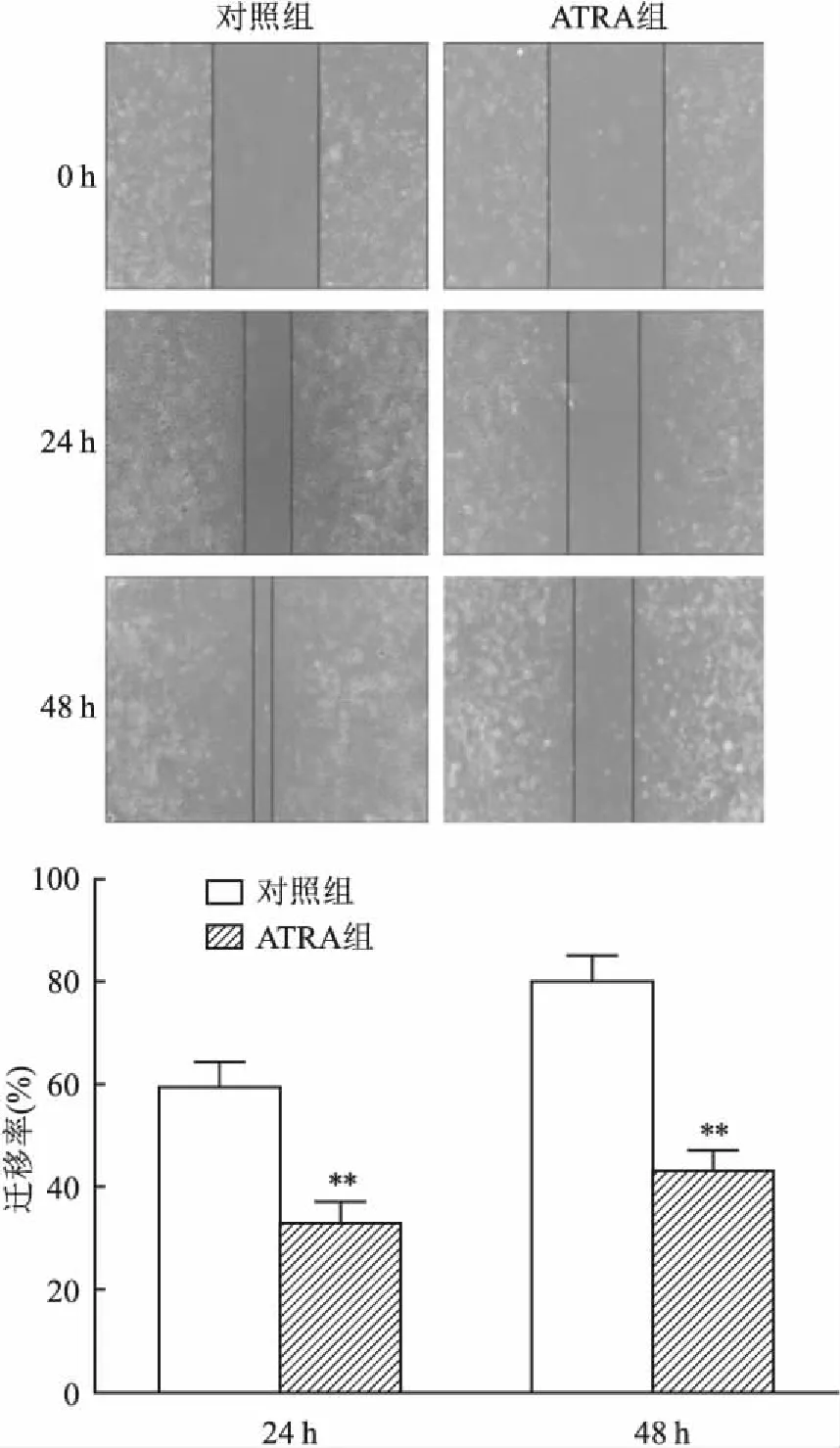
图3 细胞划痕实验检测ATRA抑制胃癌MGC-803细胞迁移能力 ×200
2.5 ATRA抑制胃癌MGC-803细胞的侵袭能力ATRA组中加入30 μmol/L ATRA溶液,培养36 h后与对照组相比,Transwell实验结果表明,ATRA组的胃癌 MGC-803 细胞侵袭细胞数量小于对照组(F=36.098,P<0.01),差异有统计学意义。见图4。
2.6 ATRA诱导胃癌MGC-803细胞的凋亡ATRA组30 μmol/L ATRA溶液作用24 h和48 h后,与对照组相比, ATRA处理后的胃癌 MGC-803 细胞凋亡率升高(P<0.05),差异有统计学意义。见图5。
2.7 ATRA上调E-cadherin,下调N-cadherin及Vimentin蛋白表达水平ATRA组30 μmol/L ATRA溶液处理细胞24、48 h后,Western blot实验检测结果显示,与对照组相比,ATRA组的胃癌 MGC-803 细胞中E-cadherin表达水平上升(F=118.022,P<0.01),且随着时间的增加表达水平上升。N-cadherin(F=149,P<0.01)和Vimentin(F=180,P<0.01)表达水平下降,且随着时间的增加表达水平下降,差异有统计学意义。见图6。

图4 Transwell实验检测ATRA抑制胃癌MGC-803
2.8 ATRA上调E-cadherin,下调N-cadherin及Vimentin mRNA表达水平和对照组相比,ATRA组经过 30 μmol/L ATRA溶液处理24、48 h后。E-cadherin mRNA表达水平上升,差异有统计学意义(P<0.05)。Vimentin、N-cadherin mRNA表达水平下降,差异有统计学意义(P<0.05)。 见表3。

表3 ATRA上调E-cadherin,下调N-cadherin及Vimentin mRNA表达水平
2.9 ATRA增强E-cadherin荧光强度,降低Vimentin 和N-cadherin荧光强度ATRA组30 μmol/L ATRA溶液作用24 h和48 h后,和对照组相比,免疫结果表明,ATRA增强E-cadherin荧光强度,降低N-cadherin、Vimentin荧光强度(P<0.05),差异有统计学意义。见图7。

图5 流式细胞术实验检测ATRA促进胃癌 MGC-803 细胞凋亡
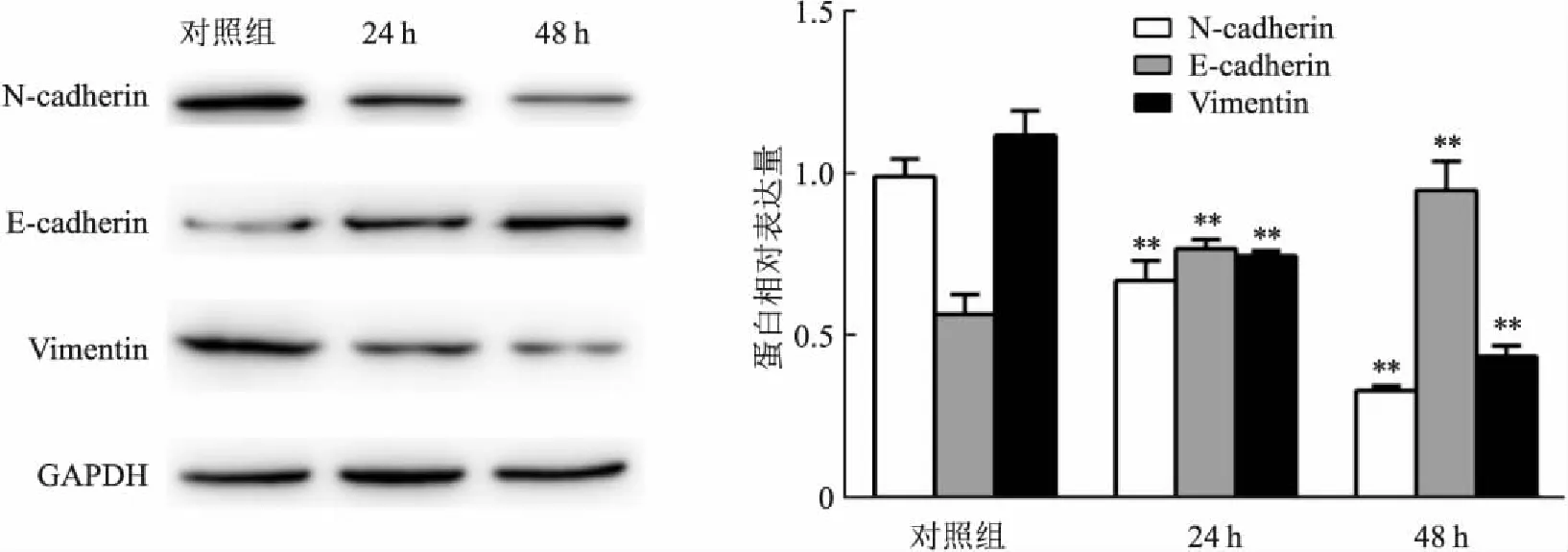
图6 Western blot实验检测ATRA对EMT相关蛋白表达水平的影响
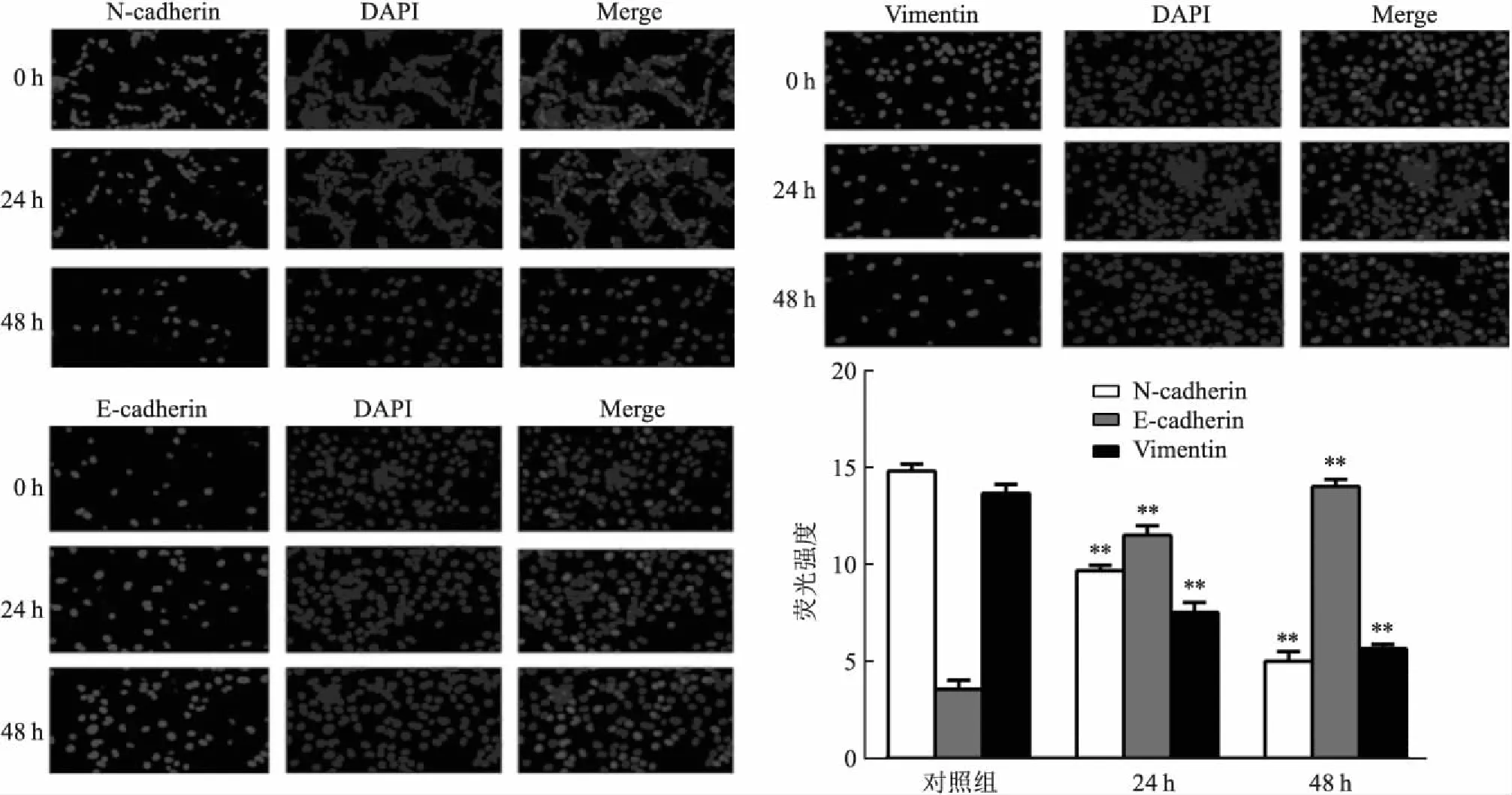
图7 ATRA影响E-cadherin,Vimentin 和N-cadherin的荧光强度 ×200
3 讨论
在目前已知的肿瘤中,GC是发病率较高的一种,且发病率和病死率呈逐年上升趋势。根据报道[4],我国2019年GC患者数量就已经超过了110万例。由于国内的饮食习惯存在一定的差异,导致GC发病率是其他国家的两倍以上[5]。目前对于GC的治疗主要有药物,手术化疗等方式。术后GC患者的预后较差,5年的生存率仅为35%[6]。研究[7]发现,在常规治疗中加入ATRA可改善胃异型增生患者的预后。Rb蛋白的定量可以作为肿瘤转阴的标记物,经过ATRA处理后的样本显示Rb水平升高,这可能有助于抑制胃异型增生。
实验证明,ATRA可以通过抑制GC细胞的上皮间质转化作用,从而抑制GC细胞的增殖、迁移、侵袭等。EMT是大多数肿瘤细胞在进行分化时所存在的一种过程。因此EMT对于肿瘤细胞的侵袭和转移过程存在显著的作用。研究EMT显示,此过程中出现较多的标志性蛋白表达量的改变,例如E-cadherin表达下降, N-cadherin和Vimentin表达增高等。如果抑制此过程,相关蛋白的表达量会呈现相反的趋势。探究ATRA对GC细胞EMT的影响中显示,ATRA组的E-cadherin蛋白表达量增多,N-cadherin和Vimentin蛋白表达量下降,这和预期结果一致。EMT过程中,肿瘤细胞的黏附性降低,同时伴有大量细胞因子分泌,从而发生侵袭和转移的现象。已经有相关实验[8]表明,EMT对于肿瘤细胞的增殖、迁移、侵袭过程具有增强作用。且研究[9]发现,GC细胞中已经明确存在EMT。ATRA属于维生素A的中间代谢产物,是一种新型的细胞诱导分化剂,对肿瘤细胞有着明显的抑制效果。ATRA可以抑制多种肿瘤细胞的增殖、迁移、侵袭,在临床中应用较为广泛。在宫颈癌、甲状腺癌患者的治疗中,口服ATRA的治疗作用和预防效果较为显著[10]。前期研究[11]已经证明,ATRA治疗GC具有一定的疗效,且在一些肿瘤细胞株中ATRA可以增强顺铂的治疗作用[12]。ATRA联合5-氟尿嘧啶(5-fluorouracil,5-Fu) 或顺铂腹腔灌注治疗GC有较好的临床疗效。
本研究中以198例GC患者为研究对象,结果表明,ATRA治疗的GC术后患者生存期大于未进行ATRA治疗的患者。因此ATRA联合化疗治疗的方式可以延长患者的生存时间。ATRA可以抑制GC MGC-803 细胞的增殖、迁移和侵袭能力,促进GC细胞的凋亡。经过ATRA处理后,EMT相关基因(N-cadherin、Vimentin)表达水平下降,E-cadherin表达水平上升。

