CTGF通过调控OPG/RANK/RANKL信号通路在血管钙化中的作用
吴 伟,程 龙,王 杰,杨传蕾,尚玉强
作者单位:华中科技大学同济医学院附属武汉中心医院心脏大血管外科,武汉 430000
血管钙化(vascular calcification,VC)是动脉粥样硬化、慢性肾病、糖尿病、高血压、绝经后综合征、动脉狭窄和老年患者的常见病理表现[1]。VC的病理异常是导致心血管发病率和病死率高的重要因素之一[2-3]。骨保护素(osteoprotegerin,OPG)为肿瘤坏死因子受体超家族的成员之一,主要作用是抑制破骨细胞形成,促进破骨细胞调亡,细胞核因子κB受体活化因子配体(receptor activator of nuclear factor κB ligand,RANKL)能够与破骨细胞表面的RANK结合,促进破骨细胞前体分化和活化形成成熟的破骨细胞[4-5]。大量的研究表明VC主要表现为血管平滑肌(vascular smooth muscle cell,VSMC)发生向成骨细胞的表型转化过程,目前的研究[6-7]认为OPG/RANKL/RANK在血管壁平滑肌细胞收缩表型向成骨表型转化中发挥了重要作用。结缔组织生长因子(connective tissue growth factor,CTGF)是一种由349个氨基酸组成,分子量为34~38 ku的富含半胱氨酸的分泌肽。有研究[8]表明,CTGF可促进成骨细胞OPG分泌,并抑制RANKL的表达,提示CTGF可能间接抑制成熟破骨细胞活化的作用。但是CTGF是否在血管钙化过程中能够通过调控OPG/RANK/RANKL信号通路来影响疾病发生的进展需要进一步的研究。因此,该研究通过沉默细胞中CTGF基因,构建体外血管钙化模型,验证血管钙化过程中CTGF对OPG/RANK/RANKL信号通路的调控作用。
1 材料与方法
1.1 实验材料与仪器大鼠胸大动脉平滑肌A7r5来源于中国科学院上海细胞库;胎牛血清购自天津TBD公司;Opti-MEM和DMEM购自美国Gibco公司;CaCl2和10 mmol/L β-甘油磷酸盐购自美国sigma公司;LipofectamineTMRNAiMAX购自美国Invitrogen公司;茜素红法钙质染色试剂盒购自上海歌凡生物技术有限公司;Boldine和AR234960购自美国MCE公司;碱性磷酸酶测定试剂盒购自南京建成生物科技有限公司;TRIzol试剂购自美国Ambion公司。SYBR FAST qPCR Master Mix购自美国KAPA Biosystems公司;BCA蛋白浓度测定试剂盒购自北京solarbio公司;LBS#111112100 CO2恒温培养箱购自美国LabServTM公司;BM-38XD倒置荧光显微镜购自上海析域仪器设备有限公司;CFX-Connect 96荧光定量PCR 仪购自美国Bio-Rad公司;AMR-100酶标仪购自杭州奥盛仪器有限公司;Tanon-5200全自动化学发光分析仪购自上海天能科技有限公司。
1.2 细胞培养将冻存的A7r5细胞从液氮罐中取出,在37 ℃水浴中完全融化后,将细胞悬液吸至离心管中,加入4 ml完全培养基(90%DMEM+10%FBS),1 337 r/min离心3 min,弃上清液,细胞重新悬浮于1 ml培养基中,转移至培养瓶中,加入4 ml完全培养基,置于37 ℃、5%CO2的培养箱内培养。
1.3 细胞转染检测转染前24 h,将5×105个细胞重悬于1.5 ml完全培养基中。分别取100 pmol siRNA和5 μl Lipofectamine®RNAiMAX稀释于250 μl Opti-MEM中,轻轻吹吸5次混匀,室温下静置5 min。两种稀释液混匀后室温孵育20 min。将500 μl混合物加到含有细胞和1.5 ml新鲜完全培养基的培养板中,最后将细胞板置于37 ℃、5% CO2培养箱中,转染4 h后换新鲜完全培养基培养24 h。采用RT-PCR和Western blot检测转入基因CTGF的表达情况。
1.4 细胞钙化模型构建及分组收集A7r5细胞,调整细胞悬液浓度为1×105个/ml,将1 ml细胞悬液加入12孔板中,置于37 ℃、5%CO2培养箱中培养过夜,使细胞贴壁。钙化培养基[DMEM+10 mmol/L β-甘油磷酸盐(BGP)+3 mmol /L CaCl2]诱导A7r5细胞钙化,诱导0、12、24、48、72 h。取出细胞培养板进行后续检测。为了验证CTGF在主动脉血管钙化中的作用,将实验分为7组。对照组:不进行任何处理;模型组:A7r5细胞诱导钙化;AR234960激动剂组:A7r5细胞诱导钙化后,AR234960激动剂(10 μmol/L,12 h)处理;CTGF-siRNA组:A7r5细胞诱导钙化后,CTGF-siRNA转染处理;siRNA-NC组:A7r5细胞诱导钙化后,siRNA-NC转染处理;Boldine抑制剂组:A7r5细胞诱导钙化后,Boldine抑制剂(80 μmol/L,12 h)处理;Boldine+AR234960组:VSMC细胞诱导钙化后,先进行Boldine(80 μmol/L,12 h)抑制剂处理,再进行AR234960激动剂(10 μmol/L,12 h)处理。
1.5 茜素红染色将12孔板中的A7r5细胞干预后弃去上清液,各组细胞用PBS洗3次。用4%多聚甲醛固定30 min后吸去4%多聚甲醛溶液。加入2 ml茜素红染液,室温染色30 min,蒸馏水速洗。在倒置荧光显微镜下观察染色效果并拍照。
1.6 碱性磷酸酶(alkaline phosphatase,ALP)活性检测将12孔板中的A7r5细胞干预后弃去上清液,设定空白管、标准管和测定管。空白管加入0.03 ml双蒸水,测定管中加入0.03 ml样本,标准管加入0.03 ml标准液;每管加入0.5 ml缓冲液和0.5 ml基质液,充分混匀,37 ℃水浴15 min后加入1.5 ml显色液;在520 nm的波长下测各管吸光度。
1.7 荧光定量qRT-PCR取1 ml的TRIzol加入细胞培养板中提取总RNA,然后将RNA逆转录为cDNA,最后将制备好的cDNA进行PCR扩增,反应程序为:预变性95 ℃、3 min;95 ℃、5 s,56 ℃、10 s,72 ℃、25 s(40 cycles),记录数据,实验重复3次。采用2-ΔΔt计算mRNA的相对含量。PCR引物由武汉天一华煜基因科技有限公司合成,引物序列见表1。

表1 引物序列
1.8 Western blot提取各组细胞的蛋白,采用BCA试剂盒测定蛋白质的含量。20 μg蛋白加入凝胶中(配制12%的分离胶和5%的浓缩胶),浓缩胶恒压80 V 40 min,分离胶恒压120 V 50 min。恒压90 V转膜50 min,5 %脱脂奶粉室温封闭 4 ℃过夜,加入一抗(CTGF 1 ∶500;GAPDH 1 ∶1 000)室温孵育1 h,洗膜后二抗(Goat anti-Rabbit IgG 1 ∶10 000)室温孵育1 h。加入ECL发光液后置于全自动化学发光分析仪中显色。实验重复3次。

2 结果
2.1 细胞钙化模型构建茜素红染色结果显示如图1,钙化模型诱导12 h后能够看到少量橘红色的钙化结节(图中细胞外的红色可能是由于细胞钙化时添加的CaCl2未清洗干净造成的),钙化模型诱导时间为48 h时,钙化结节增多,而诱导时间为72 h时,钙化诱导过度,产生的钙化结节过多。因此钙化模型诱导的最佳时间为48 h。
2.2 转染后细胞中CTGF表达水平检测结果转染CTGF-siRNA表达质粒后,与对照组比较,阴性对照组A7r5细胞中CTGF相对表达量差异无统计学意义,CTGF-siRNA-1、,CTGF-siRNA-2和CTGF-siRNA-3组A7r5细胞中CTGF相对表达量降低,差异有统计学意义(P<0.05),结果如表2。结果表明转染siRNA表达质粒后能有效降低CTGF的表达量。
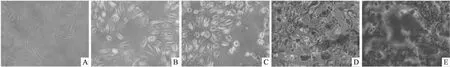
图1 A7r5细胞的钙化表达情况 茜素红×200
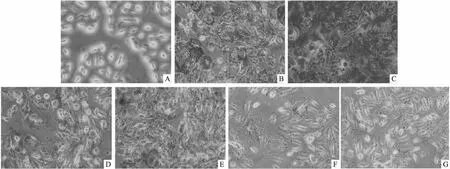
图2 CTGF-siRNA对细胞钙化的影响 茜素红×200

表2 CTGF-siRNA和Western blot检测转染后细胞中CTGF的表达水平(n=3)
2.3 CTGF-siRNA对细胞钙化的影响由图2可知,与模型组相比,siRNA-NC组钙化结节的量基本没有变化,CTGF-siRNA、AR234960 + Boldine和Boldine抑制组的钙化结节减少,AR234960激动剂组的钙化结节增多。
2.4 CTGF-siRNA对细胞的ALP活性影响ALP活性测定结果显示如图3(F=204.3),与模型组相比,siRNA-NC组ALP的活性基本没有变化,CTGF-siRNA组,AR234960+Boldine组和Boldine抑制组的ALP的活性降低(P<0.05),AR234960激动剂组的ALP的活性升高(P<0.05)。
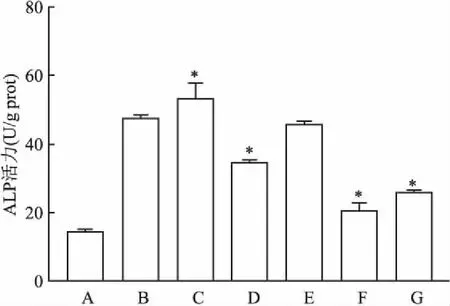
图3 A7r5细胞中的ALP活性
2.5 CTGF-siRNA对细胞中OPG、RANK、RANKL表达的影响由表3可知,与模型组相比,siRNA-NC组OPG、RANK、RANKL的表达量基本没有变化,CTGF-siRNA、AR234960+Boldine和Boldine抑制组的CTGF、RANK、RANKL的表达量降低(P<0.05),OPG表达量升高(P<0.05)。AR234960激动剂组 CTGF、RANK、RANKL的表达量升高(P<0.05),OPG表达量降低(P<0.05)。

表3 A7r5细胞中CTGF、OPG、RANK和RANKL的表达水平
3 讨论
VC是指在血管中以磷酸钙复合物的形式沉积的矿物,近年来的研究[9-10]表明,VC与动脉粥样硬化、高血压、糖尿病肾病、心肌梗死等多种疾病密切相关,是心血管疾病高发病率和高病死率的重要原因。随着我国人口老龄化趋势的加重和人们生活水平的提高,血管钙化的发生率也在逐渐提高,与其相关的许多心血管疾病已严重危害到人类的健康。血管钙化是一种与骨发育类似的主动的、可预防和可逆转的高度可调控的生物学过程,因此,研究血管钙化的发生、发展及其发病机制,为血管钙化的有效防治具有重要临床意义。本研究按照已报道的钙化模型[11],即采用10 mmol/L β-甘油磷酸盐(BGP)和3 mmol/L CaCl2诱导A7r5细胞钙化,证明了沉默CTGF能够减少A7r5细胞的钙化。
ALP是一种在碱性条件下能够分解磷酸二甲苯生成游离的酚和磷酸,广泛分布于人体骨骼、肠、肾和胎盘等组织。它能够通过调节矿化抑制剂PPi的水平来促进血管钙化,目前已被证明是血管钙化病理生理焦磷酸途径中的一个具有促进作用的因子[12]。有研究[13]表明,血清中ALP水平与冠状动脉钙化和斑块易损性具有相关性。并且有研究[14]表明ALP是血清中胶原蛋白钙化所必需的因子。因此,降低ALP的活性能够有效预防血管钙化的发生,本实验显示CTGF-siRNA能够有效降低ALP的活性。
OPG/RANK/RANKL信号通路在调控成骨细胞形成及骨重建中发挥重要作用。OPG 通过与 RANKL 结合,阻断 RANK 与其结合,从而抑制骨吸收,维持骨代谢平衡[15]。课题组在实验中使用腺病毒转染A7r5使CTGF基因沉默,显示RANK、RANKL基因水平降低,OPG基因水平上升,说明沉默CTGF基因能够通过调节OPG/RANK/RANKL信号通路从而减轻细胞钙化程度。同时, Liu et al[16]研究发现,补肾活血汤能够通过调节OPG/RANK/RANKL抑制血管平滑肌的成骨分化,有效防止VSMCs从收缩型到成骨表型的表型转换过程,进而影响细胞钙化的形成。为了进一步明确上述猜测,本研究使用OPG/RANK/RANKL信号通路的激动剂(AR234960)和抑制剂(Boldine)干预,测定OPG/RANK/RANKL信号通路对细胞钙化的影响。本实验结果显示,加入AR234960后,RANK和RANKL基因水平上升,OPG基因水平下降,细胞钙化结节增多。但加入Boldine后,RANK和RANKL基因水平下降,OPG基因水平上升,细胞钙化结节减少,这说明沉默CTGF基因与Boldine有相同的作用,进一步证明了CTGF基因是通过调节OPG/RANK/RANKL信号通路从而达到抑制细胞钙化的目的。
综上所述,本研究成功建立了A7r5细胞的钙化模型,通过实验确定沉默CTGF基因能够减轻血管平滑肌的钙化程度,降低ALP活性,调控OPG/RANK/RANKL信号通路,从而抑制主动脉血管钙化的进展,为血管钙化的治疗提供了新的靶点。

